miRNA在食管鳞癌癌变机理中的作用研究
2015-04-14李志华李绍鹏魏春勇汪礼旭洪琼川
李志华,李绍鹏,魏春勇,汪礼旭,洪琼川
(深圳市龙岗中心医院胸外科,广东 深圳 518116)
miRNA在食管鳞癌癌变机理中的作用研究
李志华,李绍鹏,魏春勇,汪礼旭,洪琼川
(深圳市龙岗中心医院胸外科,广东 深圳 518116)
目的 通过研究特定miRNA在食管鳞癌组织及正常食管组织中的表达情况,了解miRNA基因在食管鳞癌癌变机理中的作用。方法应用实时荧光定量PCR技术检测36例食管鳞癌组织和36例正常食管黏膜组织中miRNA-25、miRNA-424、miRNA-151的表达差异情况。结果miRNA-25、miRNA-424、miRNA-151在食管鳞癌组织中的含量明显高于正常食管组织,差异均有显著统计学意义(P<0.01)。结论miRNA-25、miRNA-424、miRNA-151在食管鳞癌组织中存在差异表达,其可能为参与食管癌变的分子机制之一,并可作为食管癌的分子标记物。
miRNA;食管癌;癌基因;分子标记
食管癌发病机制的研究一直以来是医学研究的热点。最新分子生物学研究表明,miRNA基因通过干扰mRNA的翻译而下调靶基因的表达,参与许多重要肿瘤相关基因的表达,可发挥癌基因或抑癌基因的作用,其表达失调与肿瘤发生密切相关[1]。本课题应用RT-PCR方法检测食管癌组织中的miRNA的表达,了解miRNA基因在食管癌癌变机理中的作用。
1 资料与方法
1.1 一般资料 选取2011年6月至2014年6月在我院胸外科住院的食管癌患者36例,其中男性29例,女性7例,年龄46~65岁,中位年龄52岁,患者均为初治病例,未行放化疗,无其他恶性肿瘤,无心脏病、高血压、糖尿病、肾病等病史,所有病例均行食管癌根治手术,取术中切除的癌组织及正常组织作为标本,正常组织为食管上切缘,距肿瘤边缘大于5 cm且病理检查无癌细胞浸润的组织,术后病理结果为鳞状上皮细胞癌。标本作石蜡包埋处理。
1.2 试剂和仪器 实时定量使用ABI 7500 PCR仪(美国AB公司);荧光实时定量PCR试剂盒hsa-miRNA-25、hsa-miRNA-424、hsa-miRNA-151和hsa-RNU6(Applied biosystems,美国);Eppendorf Bio-Photometer核酸定量;石蜡标本的提取用Ambion RecoverALLTotal Nucleic试剂盒。
1.3 实验方法 采用相对定量法,以hsa-RNU6作为内参序列,以hsa-miRNA-25、hsa-miRNA-424、hsa-miRNA-151作候选序列分别检测石蜡包埋食管癌标本、正常食管黏膜组织。
1.3.1 实验前准备 注意清洁,戴一次性的塑料薄膜手套。在提取RNA之前使用RNase(核糖核酸酶)清除液清洁实验台及相关仪器设备、处理吸头。
1.3.2 RNA提取 石蜡包埋组织20 μm厚度切10张白片脱蜡,按石蜡组织试剂盒说明书方法操作并检测 OD260值,A260/A280比值为1.8~2.1为高纯度RNA,核酸定量仪检测RNA浓度,提取总mRNA,洗涤沉淀出mRNA溶解后待用。
1.3.3 RNA逆转录 按照TAKARA逆转录试剂盒(TAKALA,日本)的方法,以溶解的总mRNA为模版,加入试剂盒提供的逆转录酶、dNTP以及反应缓冲液,将mRNA逆转录成cDNA,-40°C低温下保存待用。
1.3.4 荧光定量PCR 按照美国Applied biosystems试剂盒说明上的操作方法,进行荧光实时定量PCR。反应条件:95℃10 min,95℃15 s,60℃1 min,共50个循环。在ABI7500荧光定量PCR仪读出各个组织达到荧光阈值所需循环数(Ct)值。miRNA-25、miRNA-424、miRNA-151相对表达量的MicroRNA分析用U6作内参,以2-ΔCt(Ct代表循环阈值)表示基因表达量,以食管癌组织组与正常食管组织组相对表达量差值为样本相对量[2],公式如下:
ΔCt=[Ct(target gene)-Ct(U6)]食管癌组织-[Ct (target gene)-Ct(U6)]正常食管组织
1.4 统计学方法 应用SPSS17.0统计软件完成数据分析,计量数据以均数±标准差(±s)表示,组间比较采用配对设计t检验,以P<0.05为差异有统计学意义。
2 结果
miRNA-25、miRNA-424、miRNA-151在食管鳞癌组织中的表达选定合适的荧光信号阈值后,统计各组织miRNA-25、miRNA-424、miRNA-151达到荧光阈值所需循环数(Ct)值,计算出各组织miRNA-25、miRNA-424、miRNA-151的相对含量。如表1所示,食管鳞癌组织中miRNA-25、miRNA-424、miRNA-151的含量与正常食管组织比较差异均有显著统计学意义(P<0.01)。
表1 食管鳞癌和正常食管组织中miRNA-25、miRNA-424、miRNA-151的相对表达量(±s)
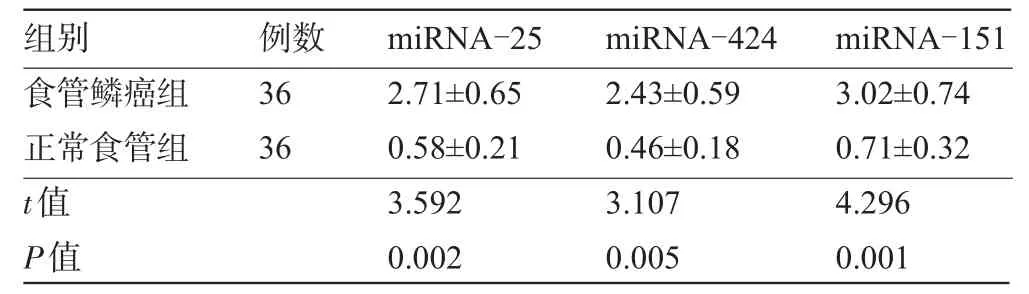
表1 食管鳞癌和正常食管组织中miRNA-25、miRNA-424、miRNA-151的相对表达量(±s)
食管鳞癌组正常食管组t值P值36 36 2.71±0.65 0.58±0.21 3.592 0.002 2.43±0.59 0.46±0.18 3.107 0.005 3.02±0.74 0.71±0.32 4.296 0.001
3 讨论
食管癌为胸外科的常见病,男性发病率高于女性,是目前世界上最常见的六种恶性肿瘤之一。我国是食管癌高发区,其发病率达十万分之十七,仅次于胃癌,肺癌和肝癌[3]。食管癌变是多种基因变化及多种因素综合作用的结果,近年来分子生物学研究证实,食管癌的发生与Rb、p53等抑癌基因失活以及环境等多因素使原癌基因H-ras、c-myc和hsl-1等激活有关。microRNA(miRNA)是一类内源性的有调控功能的非编码单链RNA家族,长度为21~25个核苷酸,人类基因组编码了超过1 000个miRNA,它通过识别并降解mRNA或者阻止mRNA的翻译而影响靶基因的表达。研究表明miRNA在细胞的增殖和凋亡过程中起多种调节作用,参与组织细胞内多种基本信号的传导途径,包括许多与肿瘤发病密切相关的基因的调控表达。miRNA作为继蛋白质之后又一高效的基因表达调控因子,已证实在多种肿瘤的发生发展中起到重要作用[4]。
食管癌的发病较隐匿,早期可无症状,大多数患者出现明显吞咽困难症状才发现。目前的主流治疗措施仍然是以手术治疗、化疗和放疗相结合的综合治疗方法,但是其治疗后五年生存率只有5%~10%,因此,早发现、早诊断、早治疗是决定食管癌治疗效果的关键。研究表明,miRNA在肿瘤发生过程中起重要作用,类似于癌基因和抑癌基因的作用,miRNA直接参与食管癌的发生、发展,其表达与食管癌的诊断、分期、进展和预后密切相关[5]。尽管miRNA在食管癌的发生、发展、侵袭和肿瘤转移等方面起着重要作用,但其作用的根本机制目前尚不清楚。Guo等[6]通过基因芯片技术分析食管癌及癌旁组织中的miRNA表达情况,首次探测到了46种miRNA在冰冻食管癌组织中的表达明显区别于癌旁正常组织。研究结果显示至少7种在食管癌组织和正常食管组织中呈差异性表达,其中miRNA-25和miRNA-130b与癌肿的分化程度有关,miRNA-7,miRNA-25、miRNA-181d、miRNA-335和miRNA-495与食管癌的大体分型有关,miRNA-25、miRNA-424在癌组织中的含量明显高于正常组织,这与本研究结果相符,说明其在食管癌的发病过程中起重要作用。
研究表明在肿瘤组织中miRNA通过使异常miRNA沉默使抑癌基因表达下调,从而发挥癌基因作用[7],miRNA能抑制细胞凋亡控制细胞生长,当凋亡途径被阻遏,癌基因可以诱导细胞不受控制地增殖,导致肿瘤发生。食管癌的发生发展在分子水平上涉及众多原癌基因、抑癌基因以及蛋白质的改变。Xu等[8]的研究也发现miRNA-25在食管鳞癌组织中表达显著上调,且与肿瘤的淋巴结转移和临床分期有关,miRNA-25过度表达能促进食管癌细胞的迁移和侵袭,下调抑制细胞的迁移和侵袭,提示其在食管鳞癌的发生、发展中起到重要作用。
本研究应用实时荧光定量PCR,以U6为内参对照定量分析食管癌组织中miRNA-25、miRNA-424、miRNA-151的表达,结果表明在食管鳞癌组织中miRNA-25、miRNA-424、miRNA-151的含量较正常食管组织中明显增加,且差异有显著统计学意义(P<0.01),肿瘤组织及正常组织中miRNA的表达有明显差异,它们的过度表达发挥了癌基因的作用,抑制正常食管黏膜细胞的凋亡,诱导细胞失去控制地增殖,最终导致食管癌变。本研究为进一步探明miRNA在食管癌变分子机制中的作用提供了有用的数据支持,表明miRNA-25、miRNA-424、miRNA-151可能为参与食管癌变的分子机制之一,并可作为食管癌的分子标记物,对食管癌的早发现、早诊断具有积极意义。
[1]Lussier YA,Stadler WM,Chen JL.Advantages of genomic complexity:bioinformatics opportunities in microRNA cancer signatures[J].Journal of the American Medical Informatics Association, 2012,19(2):156-160.
[2]郭晓东,杨 美,皋月娟,等.实时定量PCR检测miRNA-29a在肝癌中的变化[J].现代生物医学进展,2013,13(8):1484-1485.
[3]He B,Yin B,Wang B,et al.MicroRNAs in esophageal cancer[J]. Mol Med Rep,2012,6(3):459-465.
[4]Matsushima K,Isomoto H,Kohno S,et al.MicroRNAs and esophageal squamous cell carcinoma[J].Digestion,2010,82(3):138-144.
[5]Yang M,Liu R,Sheng J,et al.Differential expression profiles of microRNAs as potential biomarkers for the early diagnosis of esophageal squamous cell carcinoma[J].Oncol Rep,2013,29(1):169-176.
[6]Guo Y,Chen Z,Zhang L,et al.Distinctive microRNA profiles relating to patient survival in esophageal squamous cell carcinoma[J]. Cancer Re,2008,68(1):26-34.
[7]Zhou SL,Wang LD.Circulating microRNAs:novel biomarkers for esophageal cancer[J].World J Gastroenterol,2010,16(19): 2348-2354.
[8]Xu X,Chen Z,Zhao X,et al.MicroRNA-25 promotes cell migration and invasion in esophageal squamous cell carcinoma[J].Biochem Biophys Res Commun,2012,421(4):640-645.
Role of miRNAs in carcinogenesis of esophageal squamous cell carcinoma.
LI Zhi-hua,LI Shao-peng,WEI Chun-yong,WANG Li-xu,HONG Qiong-chuan.
Department of Cardiothoracic Surgery,Longgang District Central Hospital of Shenzhen,Shenzhen 518116,Guangdong,CHINA
ObjectiveTo study the differential expression of specific miRNA in esophageal squamous cell carcinoma and normal esophageal tissues,as well as the mechanism of miRNA in esophageal carcinogenesis.MethodsReal-time fluorescent PCR was used to investigate the differential expression of miRNA-25,miRNA-424,miRNA-151 in 36 cases of esophageal squamous cell carcinoma tissues and 36 cases of normal esophageal tissues.ResultsThe levels of miRNA-25,miRNA-424,miRNA-151 in esophageal squamous cell carcinoma tissues were significantly higher than those in normal esophageal tissues(P<0.01).ConclusionThe levels of miRNA-25,miRNA-424,miRNA-151 have differential expression in esophageal squamous cell carcinoma tissues,which might be one of the molecular mechanisms in esophageal carcinogenesis,and can be used as a molecular marker for esophageal cancer.
miRNA;Esophageal cancer;Cancer gene;Molecular marker
R735.1
A
1003—6350(2015)13—1885—03
10.3969/j.issn.1003-6350.2015.13.0679
2014-12-28)
深圳市龙岗区科技计划项目(编号:YS2012156)
李志华。E-mail:hunter_li@163.com
