外源尸胺增强黄瓜幼苗耐冷性的生理机制
2015-04-13曹玉杰薄凯亮程春燕钱春桃陈劲枫
曹玉杰, 薄凯亮, 程春燕, 钱春桃, 陈劲枫
(南京农业大学园艺学院,作物遗传与种质创新国家重点实验室,江苏 南京210095)
黄瓜(Cucumis sativus L.)起源于亚热带,属于喜温性植物,对低温非常敏感。黄瓜作为中国早春、秋冬季节设施栽培的主要蔬菜作物,由于其冷敏性在生育期内遇到0 ~15 ℃低温时经常遭受冷害,生理活动失调,生长缓慢或停止发育[1-5],产量和品质显著下降。因而提高黄瓜的耐冷性依然是目前设施栽培黄瓜的重点研究内容之一。当前,关于改善黄瓜抗冷性的措施主要包括以下几个方面:培育耐低温品种、改进栽培措施、利用转基因技术和采用化学调控技术,这些方法的应用有赖于黄瓜耐冷机制的最终阐明,而应用不同方法提高黄瓜抗冷能力的研究也将有利于黄瓜耐冷机制的进一步阐明。目前已有多种生长调节物质被报道可以提高黄瓜幼苗的抗冷性,如:5-氨基乙酰丙酸[6]、腐胺、亚精胺和精胺[7-9]、脱落酸、水杨酸[10]、壳聚糖、表油菜素内酯、油菜素内酯、茉莉酸甲酯等。我们的前期研究结果表明黄瓜发芽期耐冷性与赖氨酸脱羧酶基因表达有关,而尸胺(Cad)是赖氨酸脱羧酶的产物,推测Cad与黄瓜发芽期耐冷性有关[11]。已有报道就尸胺对水稻种子萌发的作用进行了研究[12]。而黄瓜种子低温发芽能力与苗期的耐冷性呈显著正相关,所以关于尸胺与黄瓜耐冷性的关系是一条值得探索的新途径,对于深入探讨黄瓜耐冷性机制研究具有重要意义。本试验研究Cad 对低温胁迫下黄瓜幼苗抗氧化酶活性、膜脂过氧化作用及可溶性物质含量等的影响,以期为改善黄瓜耐冷性、进一步研究黄瓜的耐冷机理提供参考。
1 材料与方法
1.1 试验材料
黄瓜材料[11]由南京农业大学蔬菜重点实验室黄瓜课题组提供,一份材料为耐冷性材料长春密刺,另一份材料为冷敏性材料北京截头。
1.2 幼苗培养
分别将两份材料种子消毒,55 ℃温汤浸种,放于铺有2 层湿润滤纸的培养皿中,28 ℃黑暗条件下催芽。种子发芽后播于装有草炭∶ 蛭石=1∶ 1 的塑料营养钵中,于日光温室内培养。每2 d 浇灌1次1/2 倍Hoagland 营养液,中间浇清水,幼苗培养至2 片真叶完全展平时用作试验材料进行处理。
1.3 试验处理
幼苗在低温处理开始前12 h,进行如下处理:(1)喷施清水(对照);(2)喷施1 mmol/L Cad (分析纯,购于Sigma 公司)。每200 ml 喷施的溶液(包括对照)中加入1 滴(约0.05 ml)吐温-20,以提高附着叶片的能力。用微型塑料喷雾器对植株2 片真叶喷施清水或Cad 溶液,以溶液不从叶面下滴为宜(注意不要滴到培养基质中)。将幼苗转移到光照培养箱中进行低温处理,选用昼/夜温度为12 ℃/7 ℃的温度作为冷处理温度,光照度为 150 μmol /(m2·s),光周期为12 L/12 D,相对湿度为60% ~75%,处理2 d。第3 d 将幼苗移回常温状态,恢复2 d,这期间间隔给幼苗浇Hoagland 营养液(1/2 倍)。在冷害处理的0 d、1 d、2 d 及恢复后2 d分别取样测定相关生理生化指标,重复3 次。
1.4 测定指标与测定方法
电解质渗漏率测定采用沈文云等的方法[13];MDA 含量测定采用硫代巴比妥酸(TBA)比色法[14];SOD 活性测定参考李合生的方法[15];POD 活性测定按照Quintanilla-Guerrero 等[16]的方法;CAT活性测定参照Aebi[17]的方法;APX 活性参照Nakano 等[18]的方法测定;可溶性总糖的含量采用蒽酮比色法测定[19];可溶性蛋白质含量测定按照文献[20]的考马斯亮蓝G-250 方法;游离脯氨酸含量测定采用茚三酮显色法[21];叶绿素含量测定参照沈伟其[22]的乙醇提取方法。
叶绿素荧光参数的测定[23],分别于处理后第0 d、2 d、恢复后2 d 选取幼苗第2 片真叶采用mini-PAM(Walz,德国)便携式调制荧光仪测定。测定前将叶片夹入叶夹暗适应20 min,然后依次测得参数最小荧光(F0)、最大荧光(Fm),并计算可变荧光Fv、PSII 原初光能转换效率(Fv/Fm)、PSII 的潜在光化学活性(Fv/F0)以及Fm/F0。每个处理重复3 次。
试验数据采用SPSS 统计软件Duncan’s 新复极差法进行显著性分析,采用Microsoft Excel 软件进行绘图。
2 结果与分析
2.1 外源Cad 对低温胁迫下黄瓜幼苗相对电导率的影响
低温胁迫会导致植物细胞膜结构破坏,细胞内含物外渗,细胞质相对电导率增加。由图1 可以看出,低温胁迫2 d 后,长春密刺和北京截头黄瓜幼苗叶片电解质渗透率均显著增加,分别为处理前的158.33%、181.26%,而且冷敏材料北京截头较耐冷材料长春密刺高出15.77%,说明低温胁迫对北京截头细胞膜造成的损伤较重;外源Cad 预处理可使两份材料幼苗电解质渗透率分别比对照降低18.61%、9.54%,说明Cad 对长春密刺的缓解效果大于对北京截头的缓解效果。提示外源尸胺预处理有利于维持细胞膜半透性的稳定,有效缓解电解质外渗。在恢复期,除北京截头对照的电解质渗透率仍保持较高水平外,其他处理均基本恢复到处理前的水平。
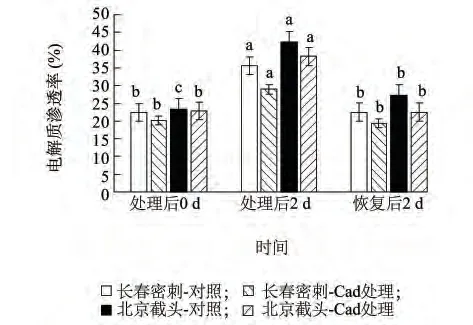
图1 外源Cad 对低温胁迫下黄瓜幼苗电解质渗透率的影响Fig.1 Effect of exogenous Cad on electrolytic leakage rate in the leaves of cucumber seedlings under low temperature stress
2.2 外源Cad 对低温胁迫下黄瓜幼苗MDA 含量的影响
丙二醛(MDA)是膜过氧化作用的终产物,其积累程度可以反映植物膜系统的损伤程度。如图2 所示,低温处理后两份材料MDA 含量皆有显著增加,在处理后1 d、2 d 长春密刺MDA 含量分别为处理前的117.97%、110.03%,北京截头MDA含量分别为处理前的127.97%、131.91%,说明低温胁迫引发北京截头膜脂过氧化的程度大于长春密刺;外源Cad 处理使长春密刺MDA 含量在低温胁 迫 后1 d、2 d 较 对 照 分 别 降 低13.13%、10.10%,北京截头MDA 含量在低温胁迫后1 d、2 d 较对照分别降低12.54%、11.49%。在恢复期,除北京截头对照的MDA 含量仍保持较高水平外,其他处理MDA 含量则降低到与处理前相同或比处理前更低的水平。
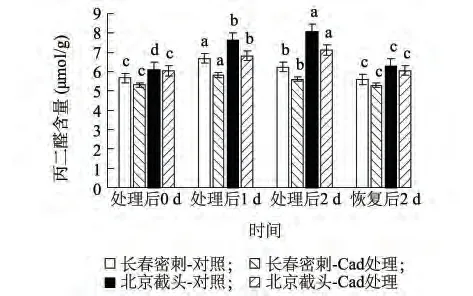
图2 外源Cad 对低温胁迫下黄瓜幼苗叶片MDA 含量的影响Fig.2 Effects of exogenous Cad on MDA contents in the leaves of cucumber seedlings under low temperature stress
2.3 外源Cad 对低温胁迫下黄瓜幼苗可溶性蛋白质含量的影响
由图3 可知,两份材料长春密刺、北京截头在低温胁迫下可溶性蛋白质含量均增加,在低温处理后1 d,分别比处理前增加10.30%、9.14%,处理后2 d分别比处理前增长了18.66%、13.81%;Cad 预处理可使低温处理下长春密刺、北京截头可溶性蛋白质含量在处理后1 d 时比对照分别提高9.82%、3.11%,在2 d 时相对于对照分别上升16.99%、11.20%,外源Cad 对长春密刺的促进蛋白质含量增加的效果大于北京截头。说明喷施外源Cad 能促进低温胁迫下黄瓜幼苗叶片可溶性蛋白质含量的增加,提高叶片细胞的渗透调节能力,增强幼苗对低温胁迫的抗性。在恢复期,各处理基本恢复到处理前的水平或略低于处理前的水平。
2.4 外源Cad 对低温胁迫下黄瓜幼苗可溶性糖含量的影响

图3 外源Cad 对低温胁迫下黄瓜幼苗可溶性蛋白含量的影响Fig.3 Effect of Cad on soluble protein content in the leaves of cucumber seedlings under low temperature stress
可溶性糖类作为植物体内一类重要的渗透调节剂,其在逆境胁迫下的积累对增加细胞汁液浓度,降低细胞水势,提高植物的抗逆性有重要作用[24]。图4 表明低温胁迫处理使长春密刺及北京截头幼苗可溶性糖含量上升,处理后1 d 即增加显著,分别比处理前高出8.73%、7.95%,2 d 时分别是处理前的1.18 倍和1.15 倍,提示植株通过调节体内可溶性糖的含量来对抗外界低温胁迫。外源Cad 预处理可以提高长春密刺、北京截头可溶性糖的含量,处理后2 d 分别比对照提高9.35%、2.90%。在恢复期,各处理基本恢复到处理前或略低于处理前的水平。

图4 外源Cad 对低温胁迫下黄瓜幼苗可溶性糖含量的影响Fig.4 Effect of exogenous Cad on soluble sugar content in the leaves of cucumber seedlings under low temperature stress
2.5 外源Cad 对低温胁迫下黄瓜幼苗脯氨酸含量的影响
脯氨酸作为植物体内的一种渗透调节物质,其含量变化对低温比较敏感[25]。由图5 所示,低温胁迫处理使长春密刺、北京截头幼苗脯氨酸含量上升明显,处理后1 d 分别比处理前上升了19.08%、10.59%,处理后2 d 分别比处理前增加52.04%、42.37%;Cad 预处理可以提高低温胁迫下两种材料的脯氨酸含量,与单纯低温胁迫相比,在1 d、2 d 时长春密刺分别提高14.57%、20.54%,北京截头分别提高14.37%、17.36% 。在恢复期,各处理脯氨酸水平略高于处理前。
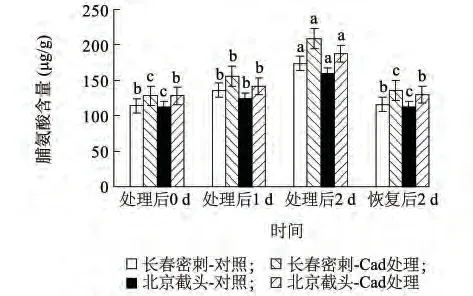
图5 外源Cad 对低温胁迫下黄瓜幼苗脯氨酸含量的影响Fig.5 Effect of exogenous Cad on proline content in the leaves of cucumber seedlings under low temperature stress
2.6 外源Cad 对低温胁迫下黄瓜幼苗抗氧化酶活性的影响
本试验对两份材料中的抗氧化酶SOD、POD、CAT 和APX 的活性进行了测定,以期了解低温条件下这些酶的调节功能。如图6 所示,在低温处理后1 d,长春密刺SOD 活性比处理前增加5.65%,北京截头却比处理前下降11.26%;在胁迫后2 d 长春密刺、北京截头SOD 活性分别比处理前提高24.76%和7.29%。Cad 处理可明显提高低温胁迫下长春密刺、北京截头幼苗叶片SOD 活性,低温处理后1 d 分别比对照增加10.28%、9.64%,2 d 时分别比对照增加21.72%、8.42%。在恢复期,除北京截头对照尚未恢复到处理前的活性水平外,其他处理均恢复到处理前的活性水平。
长春密刺和北京截头的POD 活性低温处理后1 d 分别比处理前下降了7.75%和12.56%,而在胁迫后2 d,长春密刺POD 活性为处理前的102.64%,北京截头仅为处理前的79.84%。喷施Cad 可使低温条件下长春密刺和北京截头幼苗叶片POD 活性在1 d 时分别比处理前提高10.37%和3.87%,2 d时分别比处理前提高23.37%和10.68%;长春密刺和北京截头幼苗叶片POD 活性在1 d 时分别比对照提高19.83%和18.97%。在恢复后2 d,各处理的酶活性基本恢复到处理前的水平。
低温处理使长春密刺和北京截头叶片CAT 活性均明显降低,于1 d 时分别比处理前降低14.49%和25.78%,2 d 时分别比处理前降低10.13% 和34.62%。Cad 预处理可促进长春密刺、北京截头叶片CAT 活性的增加,在1 d 时分别比处理前升高6.81%、4.20%;在2 d 时分别比处理前升高18.39% 和降低7.73%,而比对照分别提高31.95%、41.29%。各处理叶片CAT 活性恢复2 d 后趋于处理前的酶活性水平。
低温处理后1 d 和2 d 长春密刺叶片APX 活性上升,分别为处理前的1.18 倍和1.43 倍,北京截头分别为处理前的91.49%和117.39%。外源Cad 可使低温处理下长春密刺、北京截头叶片APX 活性提高,1 d 时长春密刺和北京截头幼苗叶片APX 活性分别是处理前的1.27 倍和1.12 倍,2 d 时分别为处理前的1.60 倍和1.32 倍;2 d 时长春密刺和北京截头幼苗叶片APX 活性比对照分别提高10.66%和17.13%。在恢复期各处理APX 活性恢复到低温处理前的水平。
综上所述,外源尸胺引起黄瓜长春密刺及北京截头低温处理过程中SOD、POD、CAT、APX 活性的提高,且长春密刺中这4 种抗氧化酶的活性在各个检测点均高于或略高于北京截头。

图6 外源Cad 对低温胁迫下黄瓜幼苗叶片抗氧化酶活性的影响Fig.6 Effects of Cad on antioxidant enzymes activities in the leaves of cucumber seedlings under low temperature stress
2.7 外源Cad 对低温胁迫下黄瓜幼苗叶绿素荧光参数的影响
初始荧光F0是PSII 反应中心处于完全开放状态时的荧光产量[23]。如图7 所示,低温胁迫处理后,长春密刺与北京截头F0均显著增加,说明低温胁迫引发幼苗叶片PSII 反应中心失活,发生了可逆或不可逆伤害;北京截头增幅大于长春密刺,说明其PSII 反应中心受到的损伤较大。Cad 预处理可以明显降低低温胁迫过程中F0的增加,说明其对低温下黄瓜幼苗叶片光合机构PSII 的损坏具有明显的缓解作用。
最大荧光Fm是PSII 反应中心处于完全关闭状态时的荧光强度[23]。由图7 可知,低温条件下长春密刺与北京截头的Fm均明显下降,而长春密刺Fm下降幅度小于北京截头,Cad 预处理可明显缓解低温条件下两者幼苗叶片Fm的下降。
可变荧光Fv是Fm与F0的差值,反映光合作用中PSⅡ原初电子受体QA 的还原情况[23]。图7 表明低温条件下长春密刺与北京截头的Fv显著下降,Cad 预处理可使低温条件下两份材料Fv下降减少。恢复2 d 后各处理F0、Fm、Fv基本恢复到处理前的水平。
Fv/Fm表示PSII 的最大光化学效率[23]。从图7可以看出,长春密刺与北京截头的Fv/Fm在低温胁迫后显著下降,说明低温胁迫降低了黄瓜叶片PSII原初光能转化效率;而长春密刺下降幅度小于北京截头,说明长春密刺PSⅡ反应中心所受的伤害较轻,反应中心进行光合作用的能力较高;Cad 预处理有效减缓了两份材料Fv/Fm的降低,但仍低于处理前的水平。而在恢复期,各处理的Fv/Fm均恢复到略低于处理前的水平。
Fv/F0代表了PSII 的潜在活性[23]。如图7 所示,低温胁迫处理2 d 使北京截头Fv/F0显著下降,并且大于长春密刺,表明北京截头PSII 活性中心受损比长春密刺严重;Cad 预处理可使两份材料Fv/F0有一定程度的恢复,但仍低于处理前的水平。恢复后2 d 各处理Fv/F0仍略低于处理前的水平,表明PSII 活性中心水平仍未恢复到处理前的状态。
Fm/F0用来表示通过PSⅡ的电子传递情况[23]。图7 表明低温条件下Fm/F0显著降低,说明通过PSⅡ的电子传递受到抑制;Cad 预处理可明显缓解低温下Fm/F0的下降,一定程度上促进了电子的顺利传递。在恢复期除北京截头对照略低于处理前外,其他处理基本恢复到处理前的状态。
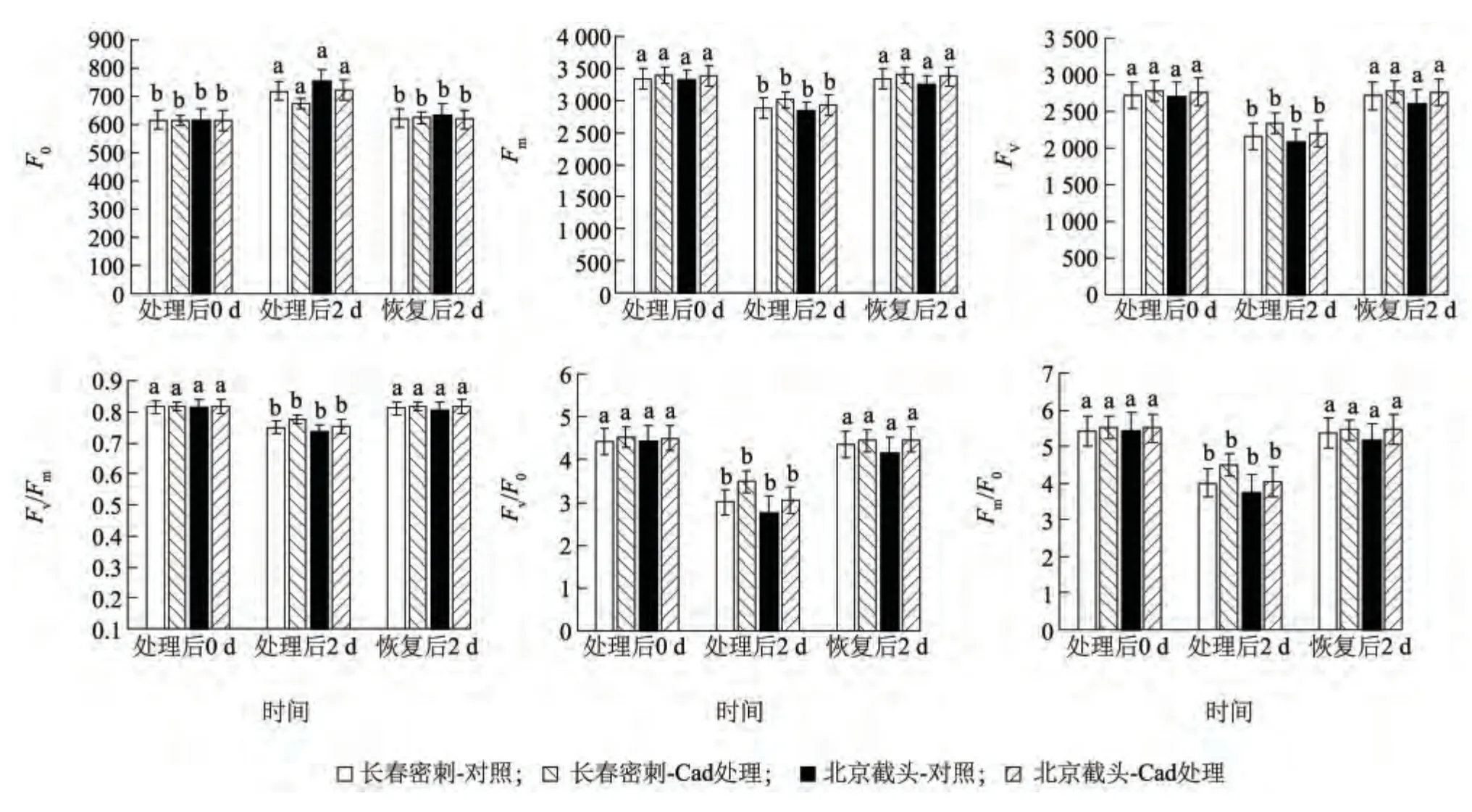
图7 外源Cad 对低温胁迫下黄瓜幼苗叶片叶绿素荧光参数的影响Fig.7 Effects of exogenous Cad on chlorophyll fluorescence parameters in the leaves of cucumber seedlings under low temperature stress
3 讨论
黄瓜发生冷害的生理机制之一是低温胁迫对细胞膜造成的损伤。而低温引起的活性氧(ROS)积累是造成细胞膜损伤的化学原因[26],由此产生的MDA 一定程度上反映了活性氧在植物体内过量积累对细胞膜系统产生伤害的程度[27]。本试验结果表明低温胁迫处理使长春密刺和北京截头的MDA含量显著增加,后者大于前者,说明低温胁迫造成黄瓜幼苗细胞膜的严重损伤,北京截头细胞膜受伤害程度大于长春密刺。抗氧化酶活性水平代表着对活性氧的清除水平[27]。在抗氧化酶类SOD、POD、CAT、APX 中,APX 起维护活性氧信号调节作用,而SOD 和CAT、POD 共同作用可以使超氧阴离子自由基和H2O2转变成水和氧,维持体内的活性氧代谢平衡[28]。本试验结果表明低温胁迫引起黄瓜长春密刺的抗氧化酶(SOD、POD、APX)活性增加,而引起黄瓜北京截头的抗氧化酶活性降低;据此认为长春密刺较北京截头有着相对较强的活性氧清除水平,进而表现出相对较强的耐低温能力。综合前人研究,低温胁迫下SOD、POD、CAT 等酶活性变化趋势存在差异,这可能与研究者所用材料种类[29-31]、低温处理强度[29-32]、低温处理方式(渐降、直接及自然低温)、处理的时期、以及取样部位等的不同有关。由本试验结果可知,尸胺(Cad)处理使黄瓜幼苗叶片中MDA 含量低于对照,而使幼苗叶片抗氧化酶(SOD、POD、CAT、APX)活性高于对照,据此认为Cad 可以提高低温胁迫下黄瓜幼苗叶片抗氧化酶活性,增强细胞清除活性氧的能力,降低质膜过氧化程度,减少MDA 积累,有利于维持细胞膜的完整性,降低细胞质膜透性。Shen 等[32]的研究结果表明其他多胺在增强黄瓜耐冷性时表现出相似的耐冷生理作用机制。
低温胁迫下植物体内可溶性糖的含量增加,可溶性糖含量与植物的抗冷性密切相关[33];脯氨酸是非常重要和有效的有机渗透调节物质,脯氨酸含量的高低可作为衡量植物抗冷性的指标[34];可溶性蛋白质因为其极强的亲水特性,可提高细胞的持水力,因此可提高植物的抗冷性,可溶性蛋白质含量与抗冷性表现正相关关系[35]。电解质渗漏率的增加是膜相变和膜脂过氧化双重反应的结果。试验结果表明低温胁迫使长春密刺和北京截头叶片内可溶性糖、脯氨酸、可溶性蛋白质含量以及电解质渗透率均增加,而外源尸胺处理可使这些细胞内可溶性物质的含量进一步提高,而使电解质渗透率的增加量减少。据此认为外源尸胺还可以通过诱导黄瓜幼苗叶内的非抗氧化系统(通过调节细胞内成分)维持细胞膜的稳定性,降低细胞质膜透性,进而增强幼苗对低温胁迫的适应性。有研究报道脯氨酸的积累需要碳水化合物,碳水化合物通过氧化磷酸化作用为脯氨酸的合成提供必要的氢和还原能力[36],可溶性糖和脯氨酸的同步积累可能与此相关。
植物在低温条件下,叶绿体会受到破坏,叶绿素含量下降,从而发生严重的光抑制现象。正常情况下叶绿素荧光与光化学反应、发射和热耗散是相互联系的[37],可以通过对荧光的监测来研究光合作用效率和热耗散的相关情况。本试验测定结果表明低温胁迫使黄瓜幼苗F0上升,表明PSⅡ反应中心失活,结合Fv/F0和Fv/Fm的降低,则反映出PSⅡ的潜在活性和原初光能转换效率的减弱。而Cad 预处理可以缓解低温胁迫引起的黄瓜幼苗的光抑制,一定程度上恢复PSⅡ的潜在活性和原初光能转换效率,提高光合作用效率。
[1] SALTVEIT M E J,MORRIS L L. Overview on chilling injury of horticultural crops[C]//Wang C Y. Chilling injury of horticultural crops. Florida:CRC Press,1990:3-15.
[2] 徐 刚,彭天沁,高文瑞,等. 不同基质含水量和钾肥施用量对黄瓜生长及光合作用的影响[J]. 江苏农业学报,2014,30(5):1109-1114.
[3] 徐 艳,王东华,纪明山.5 种常见食用菌液体发酵产物对黄瓜褐斑茵的抑制作用[J].江苏农业科学,2014,42(8):114-115.
[4] 万景旺,邵 颖,朱 华,等.生防菌Jdm2 与生物源农药混用防治黄瓜根结线虫病的效果[J].江苏农业科学,2014,42(4):108-110.
[5] 张黎杰,周玲玲,李志强,等.菌渣复合基质栽培对目光温室黄瓜生长发育和产量品质的影响[J]. 江苏农业科学,2014,42(3):109-111.
[6] 尹璐璐,于贤昌,王英华,等. 5-氨基乙酰丙酸对黄瓜幼苗抗冷性的影响[J].西北农业学报,2007,16(4):166-169.
[7] ZHANG W P,JIANG B,LI W G,et al. Polyamines enhance chilling tolerance of cucumber (Cucumis sativus L.)through modulating anti-oxidative system[J]. Scientia Hortic,2009,122:200-208.
[8] SHEN W,NADA K,TACHIBANA S. Involvement of polyamines in the chilling tolerance of cucumber cultivars[J]. Plant Physiology,2000,124:431-439.
[9] 王 学. 低温胁迫下精胺对黄瓜幼苗抗氧化酶系统及膜脂过氧化的影响[J]. 种子,2008,27(11):34-36.
[10] ZHANG W P,JIANG B,LOU L N,et al. Impact of salicylic acid on the antioxidant enzyme system and hydrogen peroxide production in Cucumis sativus under chilling stress[J]. Z Natur Forsch,2011,66:413-422.
[11] 逯明辉,李晓明,陈劲枫. 黄瓜发芽期耐冷性与赖氨酸脱羧酶基因表达[J].中国农业科学,2005,38(12):2492-2495.
[12] 孔垂华,胡 飞,谢华亮,等. 外源多胺对水稻萌发和前期生长的作用及其在土壤中的滞留[J]. 应用生态学报,1996,7(4):377-380.
[13] 沈文云,侯 锋,吕淑珍,等. 低温对杂交一代黄瓜幼苗生理特性的影响[J]. 华北农学报,1995,10(1):56-59.
[14] KUMAR G N M,KNOWLES N R. Changes in lipid peroxidation and lipolytic and free-radical scavenging enzyme activities during aging and sprouting of potato (Solanum tuberosum)seed-tubers[J]. Plant Physiol,1993,102:115-124.
[15] 李合生. 植物生理生化实验原理和技术[M].北京:高等教育出版社,2001:278.
[16] QUINTANILLA-GUERRERO M A,DUARTE-VÁZQUEZ B E,GARCÍA-ALMENDAREZ R,et al. Polyethylene glycol improves phenol removal by immobilized turnip peroxidase[J]. Bio-resource Technology,2008,99(18):8605-8611.
[17] AEBI H. Catalase in vitro[M]//Packer L. Methods in enzymology. Orlando,FL:Academic Press,1984:121-126.
[18] NAKANO Y,ASADA K. Hydrogen peroxide scavenged by ascorbate-specific peroxidase in spinach chloroplasts [J]. Plant Cell Physiol,1981,22:867-880.
[19] FAIRBAIRN N J. A modified anthrone reagent[J]. Chem and Ind,1953(4):86.
[20] 汤章城. 现代植物生理学实验指南[M]. 北京:科学出版社,1999:12.
[21] BRADFORD M M. A rapid and sensitive method for the quantification of microgram quantities protein utilizing the principle of protein dye binding[J]. Analytical Biochemistry,1976,72:248-254.
[22] 沈伟其. 测定水稻叶片叶绿素含量的混合液提取法[J]. 植物生理学通讯,1988(3):62-64.
[23] DEMMIG-ADAMS B. Carotenoids and photoproleetion in plants. a role for the xanthophylls zwaxanthin[J]. Biochin Biop Hys Acta,1990,1024:1-24.
[24] 张正斌,山 仑. 作物生理抗逆性的若干共同机理研究进展[J].作物杂志,1997(4):10-12.
[25] 汤章城. 逆境下植物脯氨酸的累积及其可能意义[J].植物生理学通讯,1984(4):6-10.
[26] 陈少裕. 膜脂过氧化对植物细胞的伤害[J]. 植物生理学通讯,1991,27(2):84-90.
[27] 朱素琴. 膜脂与植物抗寒性关系研究进展[J]. 湘潭师范学院学报:自然科学版,2002,24(4):49-54.
[28] 马德华,金 安,霍振荣,等. 黄瓜对不同温度逆境的抗性研究[J].中国农业科学,1999,32(5):28-35.
[29] 吴雪霞,查丁石,邰 翔. 低温胁迫对茄子幼苗生长、抗氧化酶活性和渗透调节物质的影响[J]. 江苏农业学报,2008,24(4):471-475.
[30] 康恩祥,陈年来,安翠香,等. 低温弱光对西葫芦幼苗抗氧化酶活性和质膜透性的影响[J]. 中国蔬菜,2007(4):16-19.
[31] 崔 岩,王丽萍,霍春玲,等. 外源抗冷物质对低温胁迫下黄瓜幼苗抗冷性的影响[J].中国蔬菜,2008(8):15-18.
[32] SHEN W,NADA K,TACHIBANA S. Involvement of polyamines in the chilling tolerance of cucumber cultivars[J]. Plant Physiology,2000,124:431-439.
[33] 艾 琳,张 萍,胡成志. 低温胁迫对葡萄根系膜系统和可溶性糖及脯氨酸含量的影响[J]. 新疆农业大学学报,2004,27(4):47-50.
[34] 冯建灿,张玉洁,杨天柱. 低温胁迫对喜树幼苗SOD 活性、MDA 和脯氨酸含量的影响[J]. 林业科学研究,2002,15(2):197-202.
[35] 王荣富. 植物抗寒指标的种类及其应用[J]. 植物生理学通讯,1987(3):49-55.
[36] 彭志红,彭克勤,胡家金,等. 渗透胁迫下植物脯氨酸积累的研究进展[J].中国农学通报,2002,18(4):80-83.
[37] MAXWELL K,JOHNSON G N. Chlorophyll fluorescence-a practical guide[J]. Jourmal of Experimental Botany,2000,51(345):659-668.
