硒通过调控小白菜幼苗根内NO与H2S信号诱导BrRbohG1/BrRbohG2表达
2015-06-09吕文静李丽娜杨立飞
陈 义, 陈 健, 吕文静, 李丽娜, 杨立飞
(1.南京农业大学园艺学院,江苏南京 210095;2.江苏省农业科学院食品质量安全与检测研究所,江苏南京 210014)
硒通过调控小白菜幼苗根内NO与H2S信号诱导BrRbohG1/BrRbohG2表达
陈 义1,2, 陈 健2, 吕文静1,2, 李丽娜1,2, 杨立飞1
(1.南京农业大学园艺学院,江苏南京 210095;2.江苏省农业科学院食品质量安全与检测研究所,江苏南京 210014)
为了研究硒对农作物胁迫的机理,本试验以小白菜(Brassica rapa chinensis)幼苗为材料,研究了亚硒酸钠(Na2SeO3)处理下,根中内源信号分子一氧化氮(NO)和硫化氢(H2S)的变化与BrRbohG1和BrRbohG2表达的关系。结果表明:0.03~0.46 mmol/L的Na2SeO3显著抑制根的生长,并呈现浓度效应;随着Na2SeO3处理浓度的升高,内源NO含量逐渐上升,而内源H2S逐渐下降,两者呈显著负相关;添加NO合成抑制剂(L-NMMA和Tungstate)或NO清除剂(cPTIO)能够显著抑制Na2SeO3对内源H2S的诱导作用;Na2SeO3处理能够显著诱导根内BrRbohG1和BrRbohG2的表达,分别添加L-NMMA、Tungstate、cPTIO、H2S供体NaHS均能显著抑制Na2SeO3对上述两基因表达的诱导作用。说明Na2SeO3处理下,内源NO介导了Na2SeO3对BrRbohG1和BrRbohG2的诱导表达,而H2S则可能抑制了两个基因的表达;NO也可能作用于H2S信号的上游。
小白菜;亚硒酸钠;硫化氢;一氧化氮;BrRbohG1/BrRbohG2
硒是动植物必需的微量元素之一,兼具营养、毒性、解毒三重生物学功能,是许多重要生物酶的主要成分[1-4]。研究发现通过对施硒浓度的调整,选择蔬菜作为生物载体可以保证安全的有机硒摄入量[5-6]。因此近年来,通过施用富硒肥提高农作物中的硒含量已成为重要的农事操作之一。但这亦导致了大量硒在农业环境中的过量累积,成为一种新的重金属污染源[7-8]。硒在动植物中的营养剂量和毒性剂量范围非常狭窄[9]。低浓度的硒对植物的生长发育具有保护和促进作用,但是过量的硒会对植物产生胁迫作用,致使产量和品质下降[10]。目前为止,硒对植物产生胁迫的机理主要集中于其通过诱导活性氧(Reactive oxygen species,ROS)的过量产生,进而诱发氧化胁迫反应。但植物硒毒害深入的生化机理尚不明晰。已有研究结果显示,由Rboh(Respiratory burst oxidase homologues)基因编码的膜蛋白NADPH氧化酶是植物在多数非生物胁迫下产生ROS的主要来源[11-13]。但硒通过何种途径诱导Rboh的表达还不清楚。
一氧化氮(Nitric oxide,NO)是调控植物响应环境胁迫的重要气体信号分子[14]。最近的研究结果显示,植物体内NO既能通过启动防卫反应帮助植物抵抗重金属胁迫[15],亦能通过促进ROS的过量产生进而介导重金属的毒害效应[16-17]。已有研究结果显示,过量硒在抑制拟南芥幼苗生长的同时,能够诱导根内NO的过量产生[18]。但这些过量产生的NO在调控植物硒毒害反应中发挥何种作用尚不明确。硫化氢(Hydrogen sulfide,H2S)是最近被鉴定出的调控植物多种生理过程的一种全新气体信号分子[19]。H2S可通过减少植物体内ROS的过量产生缓解植物的重金属毒害反应[19]。另外,最近的研究结果显示,H2S与NO的互作参与植物对镉胁迫的响应和调控侧根发育[20-21]。因此,明确硒通过调控H2S与NO互作的下游靶标将有助于进一步揭示硒毒害诱导植物产生过量ROS的分子机理。
小白菜属十字花科芸薹属常见蔬菜,在实际生产中常作为富硒载体,但是外源添加无机硒易造成小白菜硒中毒。本试验以小白菜幼苗根为材料,研究小白菜幼苗硒处理后根内源NO和H2S的变化情况,以及这种变化与小白菜体内2个Rboh基因(BrRbohG1和BrRbohG2)表达的相关性。以期为进一步阐明植物硒毒害的分子机理提供部分理论基础。
1 材料与方法
1.1 材料与试剂
供试小白菜品种为南京绿领种业生产的五月慢。总NOS抑制剂L-NMMA、NO清除剂cPTIO、NO荧光染料DAF-DA均购自海门碧云天生物科技有限公司;NR抑制剂Na2WO4、H2S供体硫氢化钠(NaHS)购自Sigma公司;TaKaRa Prime Script RT reagent购自TaKaRa公司;Trizol Reagent购自Invitrogen公司;H2S荧光染料WPS-1[3′-methoxy-3-oxo-3H-spiro(isobenzofuran-1,9′-xanthen)-6′-yl2-(pyridin-2-yldisulfanyl)benzoate],由美国华盛顿大学生化系Prof.Ming Xian惠赠。其余试剂均购自国药集团。
1.2 试验方法
1.2.1 幼苗培养和处理 种子经过1%NaClO消毒10 min后,用蒸馏水冲洗3次,在25℃条件下避光催芽12 h,然后转入1/2 Hoagland营养液,在光照培养箱(RDN-300B-3)中培养,培养条件为25℃/22℃(昼/夜),光照周期14 h/10 h(光/暗),相对湿度75%。当幼苗根长至0.3 cm时开始处理。挑选生长健壮的幼苗到1/2 Hoagland营养液中。设置营养液中Na2SeO3最终浓度分别为:0 mmol/L、0.03mmol/L、0.06mmol/L、0.12 mmol/L、0.23 mmol/L、0.46 mmol/L,处理48 h时检测根尖中内源NO、H2S;处理72 h后统计根长,每个处理10棵苗,3次重复,选取抑制率为50%左右的处理浓度作为后续试验条件。为探讨内源NO与内源H2S上下游关系设置以下处理: Na2SeO3(0 mmol/L)、Na2SeO3(0.06 mmol/L)、Na2SeO3+L-NMMA(200 μmol/L)、Na2SeO3+Tungstate(30 μmol/L)、Na2SeO3+cPTIO(100 μmol/L),处理48 h后检测根尖中H2S含量。然后探讨内源NO和内源H2S与BrRbohG1/BrRbohG2表达量关系,设计以下处理:Na2SeO3(0 mmol/L)、Na2SeO3(0.06mmol/L)、Na2SeO3+L-NMMA(200 μmol/L)、Na2SeO3+Tungstate(30μmol/L)、Na2SeO3+cPTIO(100 μmol/L)、Na2SeO3+NaHS (0.5 mmol/L)、NaHS(0.5 mmol/L)处理48 h后,取下根部保存于液氮中供后续试验使用。
1.2.2 H2S组织荧光检测与分析 根内H2S采用特异性荧光探针WSP-1进行原位检测[21]。将不同处理的小白菜幼苗根部用蒸馏水冲洗3次,再吸干表面水分,将根系浸入到20 μmol/L WSP-1探针溶液中,在25℃、避光条件下装载40 min。探针装载完后用蒸馏水冲洗3次,通过在荧光显微镜(ECLIPSE,TE2000-S,Nikon)下以465 nm为激发波长、515 nm为发射波长,并结合使用Image-Pro Plus 6.0软件统计根尖中WSP-1荧光密度,以此来反映H2S的相对含量。
1.2.3 NO组织荧光检测与分析 根内NO采用特异性荧光探针DAF-DA进行原位检测[22]。将不同处理的小白菜幼苗根部用蒸馏水冲洗3次,再吸干表面水分,将根系浸入到15 μmol/L DAF-DA探针溶液中,在25℃、避光条件下装载15 min。探针装载完后用蒸馏水冲洗3次,通过在荧光显微镜(ECLIPSE,TE2000-S,Nikon)下以490 nm为激发波长、525 nm为发射波长,并结合使用Image-Pro Plus 6.0软件统计根尖中DAF-DA荧光密度,以此来反映NO的相对含量。
1.2.4BrRbohG1/BrRbohG2表达分析 首先以NCBI(http://www.ncbi.nlm.nih.gov/)中拟南芥的RbohG序列在小白菜基因组Brassica database(BRAD)(http://brassicadb.org/brad/index.php)中进行BLAST检索,获得相似性较高的小白菜BrRbohG类似基因。然后通过同源比对和序列结构分析进行确认。多重比对采用DNAMAN5.2. 2;蛋白质氨基酸序列结构分析采用SMART(http://smart. embl-heidelberg.de/)[23];蛋白质亚细胞定位预测采用WoLF PSORT(http://wolfpsort.org/)[24];启动子调控区域分析采用PLACE(http://www.dna. affrc.go.jp/PLACE/signalscan.html)[25]。
基因表达分析采用RT-PCR。采用Trizol法提取根总RNA。使用TaKaRa PrimeSriptTMRT reagent试剂盒合成cDNA模板,保存于4℃条件下。分别以BrRbohG1(Bra019189)、BrRbohG2(Bra19191)、Actin序列设计特异性引物,引物序列分别为:BrRbohG1-F:5′-CATGACGGCTATCTGAGCGT-3′,BrRbohG1-R:5′-CGTGCTGCGATTTCGTTCAT-3′;BrRbohG2-F:5′-TTGGCTTGCGATTTTCCACG-3′,BrRbohG2-R:5′-GGATAAACCGCAGCGTTCAC-3′;Actin-F: 5′-GTGACAATGGAACTGGAATG-3′,Actin-R:5′-AGACGGAGGATAGCGTGAGG-3′。PCR反应体系:模板1 μl,前后引物各1 μl,PCR Mix 12 μl,超纯水10 μl。PCR反应条件:94℃5 min;94℃30 s,BrRbohG1、BrRbohG2(50℃30 s),Actin(58℃30 s);72℃1 min,28个循环;72℃10 min。PCR产物用1%琼脂糖凝胶电泳进行检测,使用凝胶成像系统(Tanon-3500,上海天能)观察拍照。
1.3 统计分析
每个结果采用3次重复的平均值±标准差表示,首先采用SPSS 2.0对试验数据进行单因素方差分析(ANOVA),然后进行F检验检测不同处理之间的差异显著性。
2 结果与分析
2.1 Na2SeO3对小白菜幼苗根长的影响
Na2SeO3处理显著抑制了小白菜根的生长(图1)。在Na2SeO3浓度为0.06 mmol/L处理时平均根长约为对照组的36.9%,随着Na2SeO3增加,根长逐渐变短,当Na2SeO3浓度为0.46 mmol/L时根长最短,抑制率达到93.0%,小白菜根部几乎停滞生长,说明,在一定范围内,Na2SeO3对小白菜幼苗根部生长有抑制作用,且抑制率与Na2SeO3浓度呈正相关。
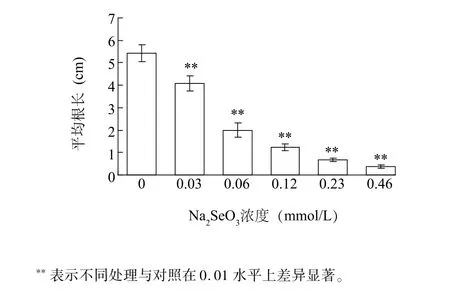
图1 不同浓度Na2SeO3对小白菜根生长的影响Fig.1 Effects of Na2SeO3concentrations on the growth of Brassica rapa root
2.2 Na2SeO3对小白菜幼苗根尖内源NO和H2S含量的影响
图2为DAF-DA荧光密度统计图。随着Na2SeO3浓度增加,小白菜根尖中DAF-DA荧光密度逐渐增加(图2)。低浓度Na2SeO3(0.03 mmol/L)处理时,DAF-DA荧光密度与对照组差异不显著;在0.06 mmol/L处理时DAF-DA荧光密度显著高于对照组,比对照组增加42.9%。Na2SeO3浓度为0.12 mmol/L、0.23 mmol/L、0.46 mmol/L处理时DAF-DA荧光密度分别为对照组的2.18倍、2.34倍、2.89倍,与对照组均有极显著差异。说明Na2SeO3处理下小白菜根尖内源NO含量增加,且随着Na2SeO3浓度增加NO含量逐渐增加。
图3为WSP-1荧光密度统计。随着Na2SeO3浓度增加,WSP-1荧光密度逐渐降低(图3)。0.03 mmol/L的Na2SeO3处理时,根尖WSP-1荧光密度与对照差异不显著;当Na2SeO3为0.06 mmol/L时, WSP-1荧光密度显著低于对照组,为对照的71.1%。当Na2SeO3浓度分别为0.12 mmol/L、0.23 mmol/L、0.46 mmol/L处理时,WSP-1荧光密度分别为对照组的57.5%、58.1%、39.4%,差异达到极显著。由此发现Na2SeO3处理后小白菜根尖内源H2S含量下降,且随着Na2SeO3浓度增加H2S含量逐渐下降。

图2 不同浓度Na2SeO3处理下小白菜幼苗根尖内源NO含量Fig.2 Effects of Na2SeO3concentrations on the content of endogenous NO in B.rapa root
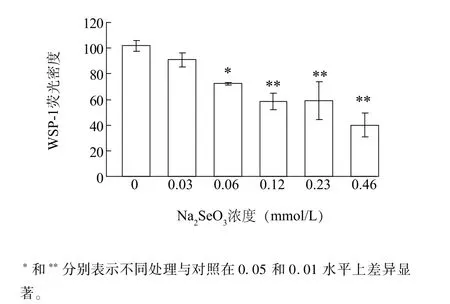
图3 不同浓度Na2SeO3处理下小白菜根尖内源H2S含量Fig.3 Effects of Na2SeO3concentrations on the content of endogenous H2S in B.rapa root
2.3 Na2SeO3胁迫下小白菜根内源NO与H2S的互作
相关性分析结果显示,不同浓度Na2SeO3处理过程中,根内源NO与H2S含量变化成显著负相关,即:随着NO含量的上升,H2S逐渐下降(图4)。我们的前期研究结果显示,H2S可作为NO的下游信号调控侧根发育[21]。为了进一步探究NO与H2S在介导Na2SeO3对小白菜幼苗氧化损伤过程中的上下游关系,本试验外源添加NO产生抑制剂(L-NMMA和Tungstate)与NO清除剂(cPTIO),再检测根尖中内源H2S含量。由图5可知, Na2SeO3处理后根尖WSP-1荧光密度与对照组相比显著下降,为对照的43.7%;但是加入NO抑制剂(L-NMMA和Tungstate)和清除剂(cPTIO)后,根尖中WSP-1荧光密度分别为Na2SeO3处理组的1.43倍、1.37倍、1.78倍,差异均达到显著水平。由此发现,通过抑制或清除根尖中NO,能够增加根尖内源H2S含量,即外源硒处理条件下,根尖中内源NO抑制H2S产生。
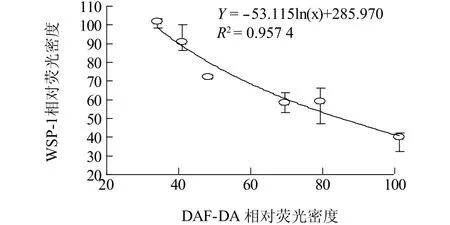
图4 不同浓度Na2SeO3处理下小白菜根尖内源H2S含量(WSP-1荧光强度)与内源NO(DAF-DA荧光强度)相关性分析Fig.4 The correlation analysis between H2S content(WSP-1 fluorescent density)and NO content(DAF-DA fluorescent density)in B.rapa root under the stress of different concentration of Na2SeO3
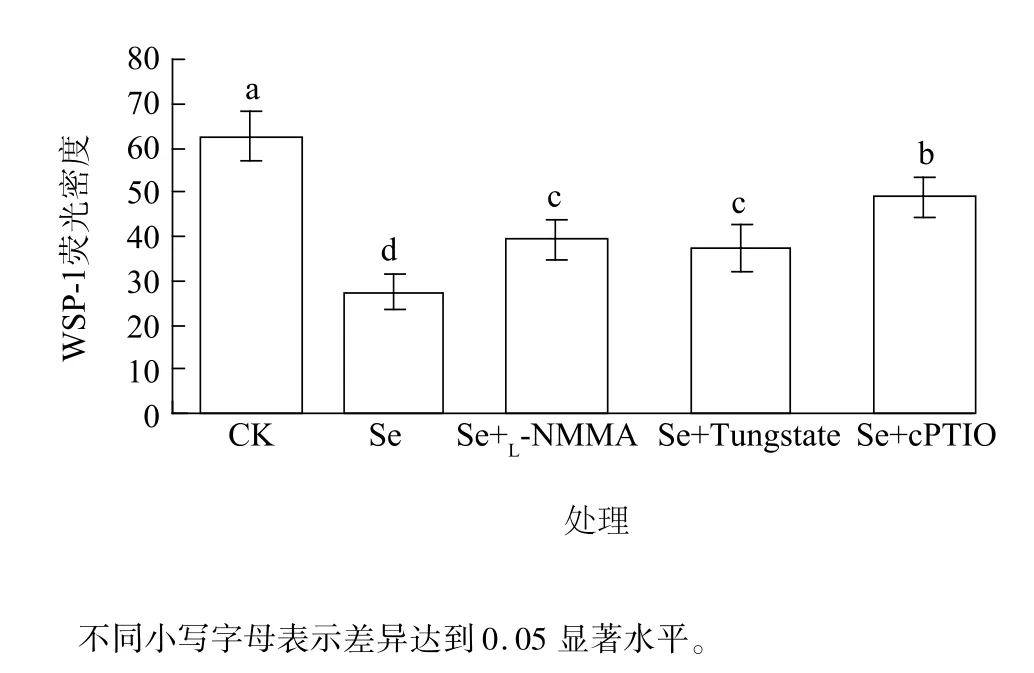
图5 不同NO抑制剂和清除剂对小白菜幼苗根尖内源H2S的影响Fig.5 Effects of NO inhibitors and scavenger on the endogenous H2S in B.rapa root
2.4 Na2SeO3胁迫下小白菜根内源NO与H2S互作对BrRbohG1/BrRbohG2基因表达的影响
目前植物中报道的Rboh基因家族主要包含11个成员(RbohA-J)。相比较其他成员,RbohG的研究相对较少,其参与调控生理过程的报道也相对缺乏。因此,我们以拟南芥中的AtRbohG基因序列在小白菜基因组中进行BLAST,检索到两条同源序列:Bra019189(BrRbohG1)和Bra019191 (BrRbohG2)。亚细胞定位预测结果显示,他们均定位于质膜或类囊体膜,属于膜蛋白。根据已报道的植物氧化酶结构[26],我们进行了进一步的组成结构分析,结果表明:BrRbohG1和BrRbohG2中含有植物NADPH氧化酶典型的保守结构特征,如在EF-1和EF-2手型结构域、在EF-1上游N端方向的Ca2+互作结构域、Fe3+还原结构域、FAD结合域、NAD结合域(图6)。多重比对结果显示,上述特征性区域的关键作用位点在BrRbohG1、BrRbohG2和AtRbohG中相对保守一致(图7)。
图8显示为不同处理对BrRbohG基因表达量的影响。与对照相比,经Na2SeO3处理的小白菜根系中BrRbohG1、BrRbohG2基因表达量均显著上调,分别为对照的4.33倍和1.63倍。由于Na2SeO3处理能够诱导内源NO的产生,因此我们在Na2SeO3处理时外源添加NO合成抑制剂L-NMMA、Tungstate,或NO清除剂cPTIO后,BrRbohG1和BrRbohG1的表达量分别比Na2SeO3单独处理时下降了46.7%~61.7%和47.9%~83.6%。另外,由于Na2SeO3处理能够抑制内源H2S的产生,因此在Na2SeO3处理时通过外源添加H2S供体NaHS来增加内源H2S含量。结果显示,BrRbohG1和BrRbohG1的表达量分别比Na2SeO3单独处理时下降了57.4%和78.8%。由此发现,在Na2SeO3处理条件下,减少根中的NO或增加H2S均能降低BrRbohG1和BrRbohG2的表达量。
2.5 BrRbohG1和BrRbohG2基因启动子区域分析
在BRAD中定位BrRbohG1和BrRbohG2基因,下载起始密码子上游2 000 bp序列并通过PLACE(http://www.dna.affrc.go.jp/PLACE/)进行启动子区域预测分析。结果(表1)显示,BrRbohG1和BrRbohG2的上游启动子区域包含响应金属离子调控元件MRE(TGCACAC)响应NO调控元件,如与bZIP转录因子结合的ACGT框(ACGT)等;响应生长素调控元件,如生长素响应因子ARFAT(TGTCTC))等。启动子区域的不同响应元件说明在Na2SeO3胁迫下,BrRbohG1和BrRbohG2基因可能受金属离子、NO、生长素等调控。
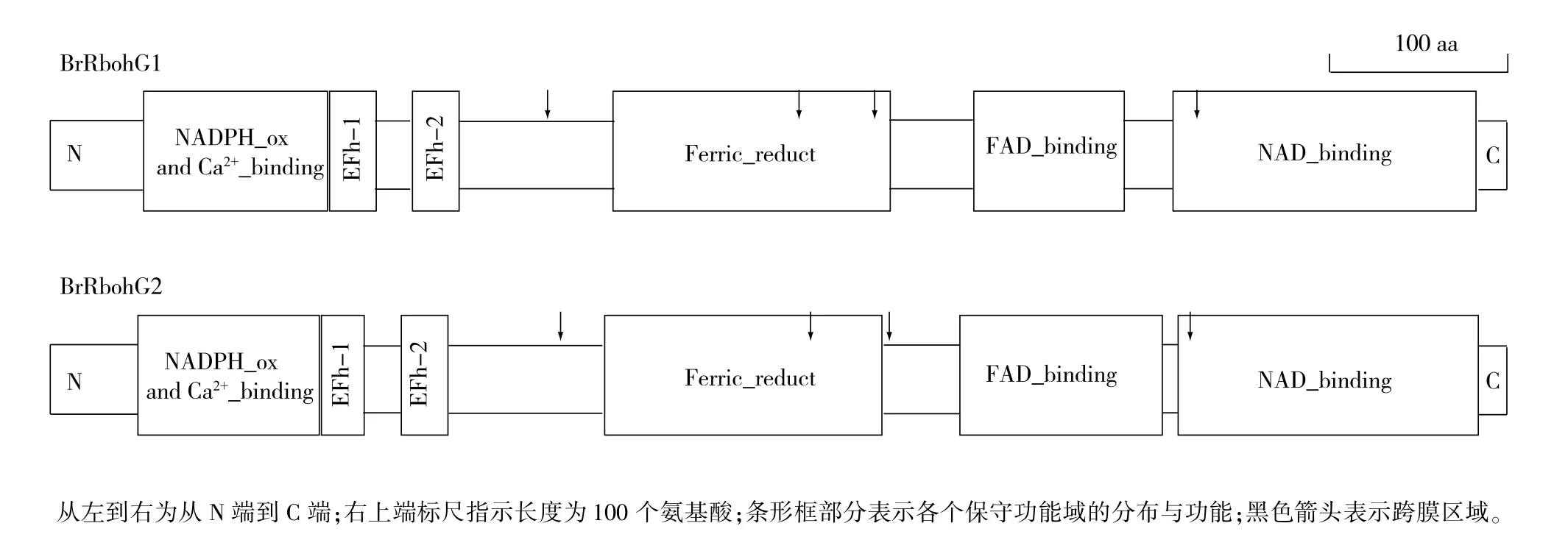
图6 小白菜中BrRbohG1和BrRbohG2蛋白质序列保守域SMART分析Fig.6 SMART analysis for the conserved domains in BrRbohG1 and BrRbohG2 protein sequence

图7 拟南芥中AtRbohG与小白菜中BrbohG1和BrRbohG2的多重比对分析Fig.7 The multi-alignment of AtRbohG in Arabdopsis and BrRbohG1 and BrRbohG2 in B.rapa
3 讨论

图8 抑制、清除NO或外源添加H2S对小白菜幼苗根部BrRbohG1和BrRbohG2表达量变化的影响Fig.8 Expression levels of BrRbohG1 and BrRbohG1 in B.rapa root treated with NO inhibitors,scavenger and H2S donor

表1 BrRbohG1与BrRbohG2基因上游启动子区域不同信号响应元件Table 1 Signal responsive elements in the promoters of BrRbohG1 and BrRbohG2
目前关于硒在植物上的研究大多集中于硒在植物体受到外界胁迫时起到保护作用[27-28],而本试验则关注在一定浓度时硒会导致植物生长受到抑制。植物遭受多数外界胁迫都会导致ROS积累,打破原有氧化与抗氧化系统的平衡[29],造成植物体细胞膜损伤、蛋白质合成受阻和含金属的酶失活等,抑制植物生长。目前在拟南芥和水稻中分别发现10条和9条Rboh基因,它们都与ROS产生有关。前期试验发现在小白菜中有12条具有NADPH氧化酶功能的基因,并发现在硒胁迫下根中BrRbohG1和BrRbohG2的表达量明显上调。通过对BrRbohG1和BrRbohG2两基因的启动子区域分析得出二者启动子区域包含NO、生长素和金属离子响应元件,结合本试验中硒抑制小白菜根生长并导致BrRbohG1和BrRbohG2基因表达上调,说明硒可能通过直接或间接的方式使小白菜中Rboh基因的表达量上调,继而导致ROS积累。
NO和H2S是当下植物生理学的研究热点。经过近20年的研究,发现NO几乎在植物生长过程中的各个时期、部位都有调节作用[30]。NO在植物中有信号和毒害双重作用,大部分文献阐述了NO作为信号分子对植物受逆境胁迫时的保护作用。有文献从NO与ROS互作方面解释了NO存在的毒害作用[31]。在本试验中发现硒处理后内源NO含量明显上升,继而通过一系列信号传递调节下游的Rboh基因最终导致植物受到胁迫作用,这一发现可能是内源NO对植物产生毒害的又一个新的途径。相比于NO,H2S作为气体信号分子在植物中的研究时间较短,通过外源添加或清除H2S证明了H2S参与了植物气孔运动、光合作用、衰老以及对生物和非生物胁迫的调节作用[32-33]。对于H2S的研究也大都集中于其正面效应,在本试验中外源硒导致小白菜根中内源H2S含量下降,当外源补充H2S时,BrRbohG1和BrRbohG2表达量相比硒处理有明显下降,说明低浓度的H2S可能介导了硒诱导植物Rboh基因表达造成植物受到抑制。已有研究发现NO与H2S有上下游关系,Lisjak[34]发现H2S在调节拟南芥气孔张开过程中使NO含量下降;而Li[35]发现NO能够诱导下游H2S产生提高玉米幼苗耐热性,说明在不同物种或不同处理条件下NO的上下游关系不是固定的。本试验中降低内源NO含量能够缓解Na2SeO3对H2S产生的抑制作用,且增加内源NO或降低内源H2S均能诱导BrRbohG1/G2表达上调,说明H2S的产生受上游NO含量调控,而H2S能够直接或间接的调控BrRbohG1/BrRbohG2表达。
至于植物中NO与H2S间的相互调控机理还不是很清晰。研究发现在人体中发现NO和H2S能够发生生物化学反应,形成RSNO类化合物[36];而且在大鼠中外源添加NO能够改变CBS(Cystathionineβ-lyase)活性和H2S水平[37]。那么植物中NO与H2S也可能有类似的生化反应和调节机制,即过量的NO可能与H2S反应降低了内源H2S水平,也有可能抑制LCD或DCD基因表达,使内源H2S含量保持较低水平。因此NO与H2S在植物中的相互作用还需要更深入研究。
总之,本研究结果表明,Na2SeO3处理下,小白菜根尖产生过量的内源NO可能抑制下游内源H2S产生,且低浓度的H2S能够诱导BrRbohG1和BrRbohG2的表达。
[1] ZHU Y G,PILON SMITS,ZHAO F J,et al.Selenium in higher plants:understanding mechanisms for biofortification and phytoremediation[J].Trends in Plant Science,2009,14(8):436-442.
[2] 方 勇,陈 曦,陈 悦,等.外源硒对水稻籽粒营养品质和重金属含量的影响[J].江苏农业学报,2013,29(4):760-765.
[3] 陈剑侠.葡萄叶片和果实对硒的吸收和累积特性[J].江苏农业科学,2013,41(7):154-156.
[4] 吴丽军,孙小风,张 荣,等.硒对不同品种春油菜含硒量、生物量及产量的影响[J].江苏农业科学,2013,41(4):77-79.
[5] 张现伟,郑家奎,张 涛,等.富硒水稻的研究意义与进展[J].杂交水稻,2009,24(2):5-9.
[6] DE T L,WAEGENEERS N,TACK F,et al.Selenium content of belgian cultivated siols and its uptake by field crops and vegetables [J].Science of the Total Environment,2014,468:77-82.
[7] HUANG S,HUA M,FENG J,et al.Assessment of selenium pollution in agricultural soils in the Xuzhou District,Northwest Jiangsu[J].China J Environ Sci,2009,21:481-487.
[8] NAVARRO-ALARCON M,CABRERA-VIQUE C.Selenium in food and the human body:a review[J].Sci Total Environ,2008,400:115-141.
[9] MACFARQUHAR J K,BROUSSARD D L,MELSTROM P,et al.Acute selenium toxicity associated with a dietary supplement [J].Archives of Internal Medicine,2010,170(3):256-261.
[10]MROCZEK-ZDYRSKA M,WÓJCIK M.The influence of selenium on root growth and oxidative stress induced by lead inVicia faba L.minor plants[J].Biological Trace Element Research,2012,147 (1-3):320-328.
[11]李 秀,巩 彪,徐 坤.外源NO对高温胁迫下姜叶片活性氧代谢的影响[J].园艺学报,2014,41(2):277-284.
[12]魏志琴,陈志勇,秦 蓉,等.Cu2+对拟南芥根的局部毒性及诱导DNA损伤和细胞死亡[J].植物学报,2013,48(3):303-312.
[13]伏 毅,戴 媛,谭晓荣,等.干旱对小麦幼苗脂类和蛋白质氧化损伤的影响[J].作物杂志,2010(3):45-50.
[14]BESSON-BARD A,PUGIN A,WENDEHENNE D.New insights into nitric oxide signaling in plants[J].Annual Review of Plant Biology,2008,59:21-39.
[15]GALLEGO S M,PENA L B,BARCIA R A,et al.Unravelling cadmium toxicity and tolerance in plants:Insight into regulatory mechanisms[J].Environ Exp Bot,2012,83:33-46.
[16]BESSON-BARD A,GRAVOT A,RICHAUD P,et al.Nitric oxide contributes to cadmium toxicity inArabidopsisby promoting cadmium accumulation in roots and by up-regulating genes related to iron uptake[J].Plant Physiol,2009,149:1302-1315.
[17]CHEN M,CUI W,ZHU K,et al.Hydrogen-rich water alleviates aluminum-induced inhibition of root elongation in alfalfa via decreasing nitric oxide production[J].J Hazard Mater,2014,267: 40-47.
[18]LEHOTAI N,PETÖ A,ERDEI L,et al.The effect of selenium (Se)on development and nitric oxide levels inArabidopsis thalianaseedlings[J].Acta Biologica Szegediensis,2011,55:105-107.
[19]LISJAK M,TEKLIC T,WILSON I D,et al.Hydrogen sulfide: environmental factor or signalling molecule?[J].Plant Cell Environ,2013,36:1607-1616.
[20]SHI H,YE T,CHAN Z.Nitric oxide-activated hydrogen sulfide is essential for cadmium stress response in bermudagrass[Cynodon dactylon(L.)Pers.][J].Plant Physiology and Biochemistry. 2014,74:99-107.
[21]LI Y J,CHEN J,XIAN M,et al.In site bioimaging of hydrogen sulfide uncovers its pivotal role in regulating nitric oxide-induced lateral root formation[J].PLoS ONE,2014,9:e90340.
[22]GUO K,XIA K,YANG Z M.Regulation of tomato lateral root development by carbon monoxide and involvement in auxin and nitric oxide[J].Journal of Experimental Botany,2008,59:3443-3452.
[23]LETUNIC I,DOERKS T,BORK P.SMART 7:recent updates to the protein domain annotation resource[J].Nucleic Acids Res, 2012,40:302-305.
[24]HORTON P,PARK K J,OBAYASHI T,et al.WoLF PSORT: protein localization predictor[J].Nucleic Acids Res,2007,35: 585-587.
[25]HIGO K,UGAWA Y,IWAMOTO M,et al.Plant cis-acting regulatory DNA elements(PLACE)database[J].Nucleic Acids Res, 1999,27:297-300.
[26]D MAARINO,C DUNAND,A PUPPO,et al.A burst of plant NADPH oxidase[J].Trends in Plant Science,2012,17(1):9-15.
[27]SOLEIMANZADEH H.Response of sunflower(Helianthus annuusL.)to selenium application under water stress[J].World Applied Sciences Journal,2012,17(9):1115-1119.
[28]DJANAGUIRAMAN M,PRASAD P,SEPPANEN M.Selenium protects sorghum leaves from oxidative damage under high temperature stress by enhancing antioxidant defense system[J].Plant Physiology and Biochemistry,2010,48(12):999-1007.
[29]王东明,贾 媛,崔继哲.盐胁迫对植物的影响及植物盐适应性研究进展[J].中国农学通报,2009,25(4):124-128.
[30]史庆华,赖齐贤,朱祝军,等.一氧化氮在植物中的生理功能[J].细胞生物学杂志,2005,27(1):39-42.
[31]WENDEHENNE D,PUGIN A,KLESSIG D F,et al.Nitric oxide:comparative synthesis and signaling in animal and plant cells [J].Trends in Plant Science,2001,6(4):177-183.
[32]崔为体,沈文飚.植物中硫化氢的生理功能及其分子机理[J].生命的化学,2012,32(4):385-389.
[33]LI L,WANG Y,SHEN W.Roles of hydrogen sulfide and nitric oxide in the alleviation of cadmium-induced oxidative damage in alfalfa seedling roots[J].Biometals,2012,25(3):617-631.
[34]LISJAK M,SRIVASTAVA N,TEKLIC T,et al.A novel hydrogen sulfide donor causes stomatal opening and reduces nitric oxide accumulation[J].Plant Physiology and Bochemistry,2010,48 (12):931-935.
[35]LI Z G,YANG S Z,LONG W B,et al.Hydrogen sulphide may be a novel downstream signal molecule in nitric oxide-induced heat tolerance of maize(Zea maysL.)seedlings[J].Plant,Cell& Environment,2013,36(8):1564-1572.
[36]WHITEMAN M,LI L,KOSTETSKI I,et al.Evidence for the formation of a novel nitrosothiol from the gaseous mediators nitric oxide and hydrogen sulphide[J].Biochemical and Biophysical Research Communications,2006,343(1):303-310.
[37]MOK Y Y P,ATAN M,BIN M S,et al.Role of hydrogen sulphide in haemorrhagic shock in the rat:protective effect of inhibitors of hydrogen sulphide biosynthesis[J].British Journal of Pharmacology,2004,143(7):881-889.
(责任编辑:陈海霞)
Selenium-induced expression of BrRbohG1/BrRbohG2 in Brassica rapa root through nitric oxide and hydrogen sulfide signalling
CHEN Yi1,2, CHEN Jian2, LÜ Wen-jing1,2, LI Li-na1,2, YANG Li-fei1
(1.College of Horticulture,Nanjing Agricultural University,Nanjing 210095,China;2.Institute of Food Quality Safety and Detection,Jiangsu Academy of Agricultural Sciences,Nanjing 210014,China)
Selenium(Se)has been becoming an emergent pollutant in the agricultural environment.In order to explore the mechanism of Se-induced stress responses in crops,the present study investigated the effect of Na2SeO3treatment on two important endogenous signalling molecules,hydrogen sulfide(H2S)and nitric oxide(NO),on the roots ofBrassica rapaand the regulation of the expression ofBrRbohG1andBrRbohG2by H2S and NO.Results were achieved as follows.The root growth was significantly inhibited by Na2SeO3varying from 0.03 mmol/L to 0.46 mmol/L in a dose-dependent manner.Compared to the control group,the root elongation was decreased by almost 60%in the treatment of Na2SeO3at 0.06 mmol/L.Treatment with Na2SeO3resulted in the increase in endogenous NO content and the decrease in endogenous H2S content in root in dose-dependent manners.The correlation analysis suggested that there was asignificantly negative correlation between NO and H2S in root with Na2SeO3treatment.The inhibition of H2S induced by 0.06 mmol/L Na2SeO3could be significantly attenuated by the addition of both NO synthesized inhibitors (L-NMMA and Tungstate)and NO scavenger(cPTIO).The expressions ofBrRbohG1andBrRbohG2could be induced significantly by Na2SeO3at 0.06 mmol/L,which could be inhibited by the addition ofL-NMMA,Tungstate, cPTIO,and H2S donor sodium hydrosulfide(NaHS),respectively.In conclusion,both endogenous NO and H2S are probably involved in the regulation of the expressions ofBrRbohG1andBrRbohG2in the root ofB.rapaunder Na2SeO3stress.The endogenous NO mediated Na2SeO3-induced expressions ofBrRbohG1andBrRbohG2while the endogenous H2S might inhibit the expressions ofBrRbohG1andBrRbohG2in the roots ofB.rapaunder Na2SeO3stress. And NO might have functioned the upstream of H2S in the above process.
Brassica rapa;selenium;hydrogen sulfide;nitric oxide;BrRbohG1/BrRbohG2
S634.3
A
1000-4440(2015)01-0149-09
陈 义,陈 健,吕文静,等.硒通过调控小白菜幼苗根内NO与H2S信号诱导BrRbohG1/BrRbohG2表达[J].江苏农业学报, 2015,31(1):149-157.
10.3969/j.issn.1000-4440.2015.01.024
2014-08-14
国家自然科学基金项目(31401857);江苏省农业科技自主创新基金项目[CX(13)5052]
陈 义(1990-),男,安徽六安人,硕士研究生,研究方向为蔬菜生理与生物技术。(E-mail)2012104082@njau.edu. cn
杨立飞,(E-mail)lfy@njau.edu.cn
