植物内生菌醇提取物对草坪草抗旱性的影响
2015-04-13马晓颖
肇 莹, 杨 镇, 杨 涛, 曹 君, 马晓颖, 肖 军
(辽宁省农业科学院/微生物工程中心,辽宁 沈阳110161)
草坪是人类生态系统的重要组成部分,绿色的草坪不仅能美化环境、净化空气、防止水土流失,还能降低噪音、调节大气温度与湿度[1-2]。草坪草作为一种优良的绿化物种,在城市绿地建设中得到广泛应用。然而,中国地域辽阔,气候各样,干旱和半干旱地区的总面积占国土总面积的47%[3]。水资源的匮乏已是一个普遍性的问题,人们在日益倚重于草坪的功能性、娱乐性和观赏性的同时,又面临着解决草坪草生长所需水分的问题。因此,抗旱性研究是草坪科学领域不可忽视的方向。
内生真菌是一类在植物体内度过大部分或全部生命周期、而宿主植物不显示外部症状的一类真菌[4]。由于内生真菌与植物共生关系对植物的影响显著,引起了国内外学者的广泛关注。特别是内生真菌代谢物能促进植物生长发育及提高宿主植物对生物胁迫和非生物胁迫的抵抗能力逐渐受到研究者的重视。
笔者从不同植物中分离并筛选了大量内生真菌,获得了具有诱导草坪草提高抗旱能力的3 株内生真菌醇提取物,并对这3 株菌进行了种属鉴定,分别为链格孢属(Alternariasp)、链格孢种(Alternaria alternata)、晶粒鬼伞种(Coprinus micaceus)。在此基础上,本试验对草坪草进行了4 种浓度PEG-6000 模拟干旱胁迫处理,通过喷施3 株菌醇提取物的混合物,测定草坪草形态指标和生理生化指标,深入研究植物内生菌醇提取物诱导草坪草提高抗旱性的效果,为其在草坪草上的科学使用提供理论依据。
1 材料与方法
1.1 试验地点和材料
本试验在辽宁省农业科学院盆栽场完成。
供试草坪:为冷季型草坪草,多年生草地早熟禾(品种为优异)。
供试材料:来源于3 株野生植物根系内生菌醇提取物,分别标记为R、S、D,其生产菌株分别为链格孢属(Alternariasp)、链格孢种(Alternaria alternata)、晶粒鬼伞种(Coprinus micaceus),均由辽宁省农业科学院微生物工程中心分离保存。
1.2 试验设计
试验采用培养盆(直径28 cm、高30 cm)种植草坪草,基质配比为沙∶ 草炭∶ 有机肥=4∶ 1∶ 2(体积比),且每盆装入同等质量的基质。待草坪草成坪后,叶面均匀喷施植物内生菌醇提取物混合物R+S+D(50.0 ng/ml +0.5 ng/ml +50.0 ng/ml),喷施清水作为对照。2 d 后,用不同浓度的聚乙二醇(PEG-6000)溶液(0、10%、20%、30%)对草坪草模拟干旱(无、轻度、中度、重度)胁迫处理,分别于处理后第8 d 进行形态指标和生理指标的测定,每个处理3 次重复。
1.3 草坪管理
草坪修剪:试验草坪修剪高度为5 cm,试验期间每14 d 修剪1 次,以后修剪高度相同。水分管理:草坪草按需水情况进行定量浇水,模拟干旱胁迫处理。病虫害控制:根据天气状况及草坪草生长情况使用杀菌剂进行病害预防,保证草坪草正常生长。
1.4 测定内容与方法
1.4.1 形态指标测定 自干旱胁迫处理开始第8 d,采用五点取样法测定每盆植株生物量。(1)株高测定:株高净增高度=植株株高-草坪修剪高度。(2)草屑量测定:每盆中间直径20 cm 部分所收集的草屑在105 ℃杀青1 h,再在80 ℃烘至恒质量,后称质量。(3)根系干物质量测定:取出植株根系,将根部细砂轻轻洗去,在水中将根系理顺,放入盛满水的根盘中,吸水纸沾干,取地下部分进行根系分析。
1.4.2 生理生化指标测定 (1)采用TTC 法测定根系活力[5],单位为mg/(g·h),FW。(2)参照萃取比色法测定叶绿素含量[6],单位为(mg/g),FW。(3)采用蒽酮法测定可溶性糖含量[7],单位为%。(4)采用茚三酮比色法测定脯氨酸(Pro)含量[8],单位为(μg/g),FW。(5)采用硫代巴比妥酸法测定丙二醛(MDA)含量[9],单位为(μmol/g),FW。
1.5 数据处理
利用Microsoft Excel、SPSS11 对数据进行统计、整理、分析和作图。
2 结果与分析
2.1 植物内生菌醇提取物对草坪草株高、草屑量、根干质量的影响
草坪草根系的好坏是影响草坪素质的重要因素,而干物质积累是反映草坪草生长情况的另一项重要指标[10]。从表1 可知,在不同浓度PEG-6000胁迫下,喷施R+S+D 草坪草株高、草屑量、根干质量均高于喷施清水(对照)处理;与喷施清水(对照)相比,在无干旱胁迫时,喷施R+S +D 草坪草株高、草屑量、根干质量分别增加3.4%、3.3%、3.8%;轻度胁迫(10% PEG-6000)时,喷施R +S +D 草坪草株高、草屑量、根干质量分别提高6.5%、3.1%、11.6%;中度胁迫(20% PEG-6000)时,喷施R+S+D 草坪草株高、草屑量、根干质量分别提高25.1%、77.4%、24.6%;重度胁迫(30% PEG-6000)时,对照草坪草几乎没有生长,R +S +D 处理的草坪草生长缓慢。表明在干旱胁迫下,植物内生菌醇提取物明显提高了草坪草的抗旱能力,且其完全能够抵抗低、中度干旱胁迫。

表1 干旱胁迫对各处理草坪草生物量的影响Table 1 Effect of drought stress on biomass of turfgrass in each treatment
2.2 植物内生菌醇提取物对草坪草生理生化特性的影响
2.2.1 植物内生菌醇提取物对草坪根系活力的影响 由图1 可知,随着干旱胁迫浓度的升高,喷施R+S+D 和清水(对照)的草坪草根系活力均出现先升高后下降的趋势,且喷施R+S +D 的草坪草根系活力始终高于对照。轻度胁迫下(10% PEG-6000),喷施R+S+D 和对照的根系活力最高,但两者差异并不显著;中度胁迫下(20% PEG-6000),R+S+D 处理的根系活力显著高于对照,是其1.75倍;高度胁迫下(30% PEG-6000),R +S +D 和清水处理的根系活力均明显下降,说明高浓度的干旱胁迫超过了草坪草根系的适应能力范围,趋于死亡。表明,当PEG-6000浓度达20%中度胁迫时,R +S +D 处理明显提高了草坪草的根系活力,对草坪草抗旱能力起显著作用。
2.2.2 植物内生菌醇提取物对草坪草叶绿素含量的影响 叶绿素与光合密切相关,其含量在一定程度上反应了植物光合能力的强弱[11]。在不同浓度PEG-6000 胁迫下,喷施R+S +D 和清水(对照)的叶绿素含量变化见图2。随着胁迫浓度的升高,喷施R+S+D 和对照的叶绿素含量呈现出总体下降趋势,R+S+D 处理的叶绿素含量由最初的3.18 mg/g降为最后的1.31 mg/g。对照叶绿素含量由最初的3.16 mg/g降为最后的0.72 mg/g。当胁迫浓度为0、10.0%时,2个处理的叶绿素含量变化不明显,当PEG-6000 浓度增高到20%、30%时,R+S+D 处理的叶绿素含量较对照分别高出46.0%、59.0%,且存在显著差异。可见,在中度和重度干旱胁迫下,喷施R+S+D 能提高草坪草叶绿素含量,增强叶片的光合能力和绿度,对草坪草抗旱起显著作用。
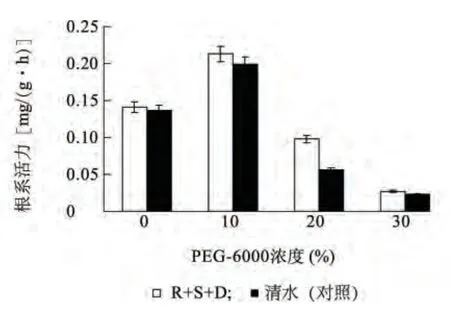
图1 干旱胁迫对草坪草根系活力的影响Fig.1 Effects of drought stress on the root activities of turfgrass
2.2.3 植物内生菌醇提取物对草坪草可溶性糖含量的影响 可溶性糖是高等植物的主要代谢产物之一,糖作为代谢的中间产物或终产物调节了植物生长、发育、抗性形成等多个生理过程,同时参与了胞内信号调节或转导过程[12]。由图3 可知,在无干旱胁迫时,喷施R+S+D 和清水(对照)的草坪草可溶性糖含量无明显差异,可溶性糖含量随着干旱胁迫程度的增大而增加。当胁迫浓度为0、10%时,喷施R+S+D 和对照的可溶性糖含量间差异不明显;当胁迫达到20%、30% PEG-6000 时,R+S+D 处理的可溶性糖含量显著高于对照,分别高出20.1% 和28.0%。尤其PEG-6000 浓度达到30%时,表现最为明显。表明在20%和30% PEG-6000 的模拟干旱胁迫环境中,喷施R+S+D 能促进草坪草体内糖分的积累,从而提高草坪草的抗旱性。
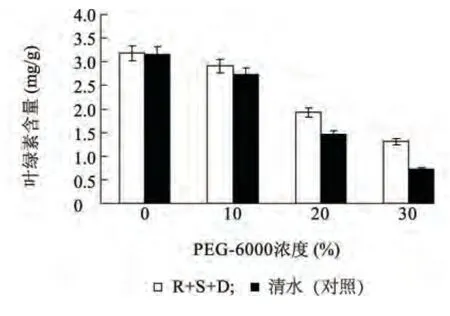
图2 干旱胁迫对草坪草叶绿素含量的影响Fig.2 Effects of drought stress on chlorophyll contents of turfgrass

图3 干旱胁迫对草坪草可溶性糖含量的影响Fig.3 Effects of drought stress on soluble sugar of turfgrass contents
2.2.4 植物内生菌醇提取物对草坪草脯氨酸含量的影响 游离脯氨酸是草坪草蛋白质的组分之一,并以游离状态广泛存在于草坪草体中。结果(图4)显示,在正常水分条件下,与喷施清水(对照)相比,喷施R +S +D 草坪草体内脯氨酸积累量上升幅度不大,无明显差异。在干旱胁迫环境中,草坪草的脯氨酸积累量对干旱胁迫的反应十分敏感,迅速升高,且上升幅度有很大差异。与喷施清水(对照)相比,喷施R +S +D 的草坪草体内脯氨酸含量积累量显著增加。随着干早胁迫的加重,当PEG-6000 浓度达到10%、20%、30%时,喷施R+S+D 的草坪草脯氨酸积累量分别是对照的1.1 倍、1.4 倍、1.2 倍,尤其当PEG-6000 浓度达20%时,差异最为显著。当PEG-6000浓度升高到30%时,脯氨酸含量呈现下降趋势。
草坪草脯氨酸积累量越大越有利于抗旱,由此推断喷施R+S+D 的草坪草有利于维持叶片水势,当PEG-6000 浓度达20%时,草坪草对干旱胁迫的适应性最强,抗旱性相对较好。

图4 干旱胁迫对草坪草脯氨酸含量的影响Fig.4 Effects of drought stress on proline contents of turfgrass
2.2.5 植物内生菌醇提取物对草坪草丙二醛含量的影响 丙二醛可引起生物大分子的变性或降解及生物合成的降低,破坏细胞结构[13]。本试验结果(图5)显示,随着干早胁迫的加重,喷施R+S+D 和清水(对照)的丙二醛含量都有不同程度的升高。正常水分环境下,喷施R +S +D 和清水的丙二醛含量比较稳定,基本维持在同等水平。不同浓度的PEG-6000胁迫下,对照丙二醛含量增加幅度高于喷施R +S +D。当PEG-6000 浓度达到20.0%时,喷施R +S +D和对照的丙二醛含量波动较大,开始迅速上升,对照的丙二醛含量增加幅度显著高于喷施R+S+D,是其1.15 倍。当PEG-6000 浓度达到30.0%时,2 个处理的丙二醛含量继续上升,但两者间差异不显著。表明R+S+D 在20% PEG-6000干旱胁迫下明显降低了脂质过氧化的速度,减少丙二醛对细胞结构的破坏。

图5 干旱胁迫对草坪草丙二醛含量的影响Fig.5 Effects of drought stress on malondialdehyde contents of turfgrass
3 讨论
植物根系是活跃的吸收器官和合成器官,根的生长情况和活力水平直接影响地上部分的生长和营养状况[14]。植物组织的根系活力状况在一定程度上能够反应植物的抗旱性强弱。本研究中,中轻度胁迫时根系活力增加、呼吸速率加快,可以认为是植物对逆境的适应性反应。随着胁迫强度的增加,根系活力逐渐下降。在中度干旱胁迫下,喷施植物内生菌醇提取物(R +S +D)的草坪草根系活力虽然有所降低,但明显高于喷施清水(对照),说明草坪草在中度干旱胁迫下,R +S +D 能够减缓逆境对根系的影响。
中度干旱胁迫时,Hays 等[15]对几个暖季型草的研究认为根系活力是枝条生长的主要因素。本研究在中度干旱胁迫时,喷施R+S+D 的根系干质量比对照增加了24.6%,表明中度胁迫下R+S+D 显著地延缓了根系的衰老,促进了草坪草生物量的提高。同时,根系活力的相对增强也促进了草坪草的光合作用。
可溶性糖和脯氨酸做为植物调节物质在干旱胁迫下大量积累,导致细胞液浓度增加,这对细胞膨压的维持,细胞内束缚水含量的提高,细胞液流动性的增强等均有所帮助。本研究中,在干旱胁迫条件下,可溶性糖含量随着干旱胁迫的加重而有不同程度的上升,喷施R+S+D 的草坪草可溶性糖含量高于对照。脯氨酸含量在重度胁迫时有所下降,但喷施R+S+D 草坪草的下降幅度小于对照。
植物在经受环境胁迫(如低温、干旱等)过程中产生的损伤在很大程度上与产生过量的活性氧有关。干旱胁迫干扰了植物细胞中的自由基的产生与清除之间的平衡,自由基在细胞中积累使蛋白质氧化和生物膜膜脂受到伤害,导致植物受损[16]。本研究中,从草坪草生物量增加不难看出,R +S +D 确实提高了草坪草的抗旱能力。通过对草坪草丙二醛含量的研究发现,干旱胁迫下喷施R+S +D 与对照的丙二醛含量随着胁迫程度的增强始终呈上升趋势。但喷施R+S +D 的丙二醛生成量明显低于对照。因为丙二醛是膜脂过氧化作用的产物之一,其含量的高低代表膜脂过氧化的程度,即丙二醛含量越高,膜脂过氧化程度越严重,膜透性越大[17]。由此说明在干旱胁迫下草坪草发生了明显的膜脂过氧化作用,且随着干旱胁迫程度的增加造成的膜脂过氧化程度逐渐严重。喷施R +S +D 的丙二醛生成量显著低于对照,说明干旱胁迫下,喷施R +S +D的草坪草膜脂过氧化程度低于对照。
植物内生菌提取物的使用是一个非常复杂的问题,外用植物内生菌提取物必然会引发其生理生化特性甚至形态上的效应[18]。因此,确切地了解和掌握干旱胁迫条件下施用植物内生菌提取物对草坪草形态和生理的影响,对干旱环境条件下广泛应用植物内生菌提取物具有重要意义[19]。
目前,对草坪草的抗旱性研究已逐渐得到重视,通过植物内生菌和内生菌代谢产物减轻干旱胁迫的影响还有待进一步深入研究,同时应注重调查、筛选和利用增强草坪草抗旱性的内生菌资源,借鉴一些可提高作物抗旱性的技术措施。
[1] 蒋志峰,姚士宇.长江中下游丘陵果园草坪建植技术[J].江苏农业科学,2013,41(11):214-216.
[2] 李祖祥,胡永进,蒋为民. 无基质培育无土草坪的栽培技术[J].江苏农业科学,2013,41(10):140-142.
[3] 刘 刊,耿士均,商海燕,等. 草坪草抗性研究进展[J]. 草业科学,2012,29(7):7.
[4] SIEGE M R,LATCH G C M,JOHNSON M C. Fungal endophytes of grasses[J].Annu Rev Phytopath-ology,1987,25:293-315.
[5] 李合生. 植物生理生化实验原理和技术[M].北京:北京高等教育出版社,2000.
[6] 邹 琦.植物生理学实验指导[M]. 北京:中国农业科学出版社,2001.
[7] 向 红,陈疏影,于虹漫,等. 植物生理学研究性学习实践探索[J]. 云南农业大学学报:社会科学版,2013(1):15.
[8] 高俊凤. 草坪草生理学实验技术[M]. 西安:世界出版社,2000.
[9] 肇 莹,王丽萍,肖 军,等. 水稻转导外源总DNA 变异后代盐胁迫下株高及生理指标分析[J].生物技术通报,2012(12):71-75.
[10] 鄢 燕,张新全,张新跃. 植物生长调节剂在牧草及草坪草上的应用研究进展[J].草原与草坪,2003(3):7-9.
[11] 赵天宏,沈秀英,杨德光,等. 水分胁迫及复水对玉米叶片叶绿素含量和光合作用的影响[J].杂粮作物,2003,23(1):33-35.
[12] 刘浩荣,宋海星,刘代平. 油菜茎叶可溶性糖与游离氨基酸含量的动态变化[J].西北农业学报,2007,16(1):123-126.
[13] 陈信波,廖爱君,罗泽民. 大穗型水稻生育后期叶片和根系生理的特性[J].生命科学研究,1999,3(3):250-255.
[14] 张 军,李晓萍,陈新宏,等. 长期土壤干旱下扬花期冬小麦部分生理生化反应及抗旱性分析[J]. 麦类作物学报,2014(6):8.
[15] HAYS K L,BARBER J F,KENNA M P,et al. Drougut avoidance mechanisms of selected Bermuda grass genotyps[J]. HortSci,1991,26(2):180-182.
[16] 赵丽英,邓西平,山 仑. 活性氧清除系统对干旱胁迫的响应机制[J].西北植物学报,2005,25(2):413-418.
[17] 王启明,徐心诚,马原松,等. 干旱胁迫下大豆开花期的生理生化变化与抗旱性的关系[J].干旱地区农业研究,2005,23(4):98-101.
[18] 张晓婧,刘润进. 广义与狭义植物内生生物的定义及其研究进展[J]. 微生物学通报,2014,41(3):560-571.
[19] 李艳秋,尹伟伦,夏新莉. 干旱胁迫下四种冷季型草坪草的生理反应[J].草地学报,2007,15(2):165-166.
