锰氧化物的零价汞吸附性能初探
2015-04-11刘德宏谢江坤晏乃强
刘德宏,谢江坤,晏乃强
(1.保利协鑫能源控股有限公司(电力),江苏苏州 215028;2.中建中环工程有限公司,江苏南京 210008;3.上海交通大学环境与科学工程学院,上海 200240)
锰氧化物的零价汞吸附性能初探
刘德宏1,谢江坤2,晏乃强3
(1.保利协鑫能源控股有限公司(电力),江苏苏州 215028;2.中建中环工程有限公司,江苏南京 210008;3.上海交通大学环境与科学工程学院,上海 200240)
以不同锰盐为锰源制备了三种锰氧化物,并将其作为吸附剂用于模拟烟气中零价汞的脱除。采用PXRD、TEM、N2吸附、H2-TPR、XPS等技术手段对制备的吸附剂进行了表征,利用固定床装置考察了其在不同温度下对模拟烟气中零价汞的吸附能力,并对穿透后吸附剂的脱附性能进行试验探讨。结果表明不同锰源制备的锰氧化物在低温条件下对零价汞的吸附性能不同,其中以硝酸锰为锰源制备的锰氧化物具有较高的吸附性能,并且吸附在锰氧化物表面的汞能够在加热条件下释放出来。另外,试验还发现当烟气中无SO2时,制备的吸附剂具有较好的循环使用性能。
锰氧化物;汞污染控制;吸附性能;可再生汞吸附剂;汞的脱附
0 引言
自日本水俣病以来,汞污染引起了越来越多的关注。由于其高毒性、生物累积性及易迁移性[1-3],汞能够对生态系统造成长期伤害。随着经济的发展,工业化的推进,燃煤带来的汞排放逐渐成为最大的人为排放源之一[4]。汞在烟气中主要以三种形态存在:零价汞、颗粒态的汞和二价的汞[5]。颗粒态的汞能够被除尘装置捕获去除,二价的汞由于易溶于水,也能够被下游的湿法脱硫装置洗涤去除。而零价汞由于既难溶于水也无法被现有烟气净化装置捕获,也就成为了汞排放控制的重点和难点。目前针对汞污染控制主要有两种思路:一是利用活性炭等吸附剂将零价汞转化为颗粒态的汞,然后利用除尘装置去除;另一思路是通过添加氧化剂或利用催化剂将零价汞氧化为二价汞,然后利用湿法脱硫装置洗涤去除。然而,国内煤中氯含量相对较低,零价汞的催化氧化效率并不高,而活性炭注射法成本较高,且活性炭的加入会降低飞灰品质。因此,开发新型高效零价汞吸附剂就尤为必要。
MnOx具有较多晶相,是一类比较复杂的金属氧化物,具有较好的氧化还原能力和催化性能,广泛应用于催化领域。然而,将其应用于零价汞吸附剂尚未见成体系的研究报道。本文中分别以硝酸锰、硫酸锰及氯化锰为锰源制备锰氧化物,并将其应用于烟气中零价汞的吸附,考察了不同温度下吸附剂对零价汞的吸附性能。此外,基于循环利用的角度出发,本文还考察了穿透后吸附剂表面汞的脱附性能,讨论了吸附剂再生的可行性,从材料角度为烟气脱汞提供新的研究思路。
1 试验部分
1.1 锰氧化物吸附剂的制备
以硝酸锰为锰源制备锰氧化物:将50mmol的Mn(NO3)2溶于200mL去离子水中,搅拌后得到均匀的Mn(NO3)2溶液,保持中速搅拌,向制备的Mn (NO3)2溶液中加入100 mmol氨水,发现大量沉淀生成,继续搅拌3h后,过滤沉淀,用去离子水洗涤沉淀3次,然后将得到的沉淀转移至马弗炉中,在100℃条件下先干燥1h,然后再在500℃条件下煅烧5h。将得到的固体研磨后过筛40~60目备用;以硫酸锰为锰源制备锰氧化物:制备过程与上同,只是使用的锰源不同,这里使用MnSO4代替Mn(NO3)2作为锰源;以氯化锰为锰源制备锰氧化物:制备过程与上同,只是使用的锰源不同,这里使用MnCl2代替Mn(NO3)2作为锰源。
1.2 吸附剂对零价汞的吸附性能评价试验
吸附剂的零价汞吸附性能评价体系由配气系统、反应系统及检测系统构成。配气系统有多路质量流量计及旁路组成,可方便地开关或调节各路流量,准确模拟烟气组分环境,其中,汞的浓度可以通过汞源油浴的温度及载汞气路的流量进行控制;反应系统主要由反应管,温控系统及旁路组成,反应管由石英加工而成,用于装填吸附剂形成固定床反应器(为防止吸附剂流失,其两端用石英棉封堵),温控系统用于精确控制反应温度,旁路主要是为了方便初始汞信号的检测;检测系统为冷原子吸收光谱仪及其工作系统组成,由Lumex 915+测汞仪结合安大略法进行校正。
本文中采用10h内的吸附容量来表征吸附剂的相对吸附能力。吸附容量的计算基于穿透曲线由下面公式得到:
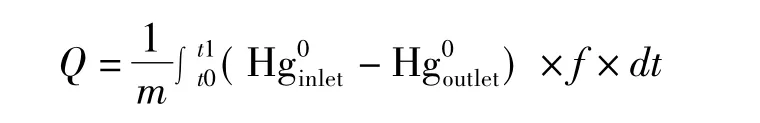
式中:Q表示10h内的吸附容量,单位为mg/g;f表示烟气流速;t0和t1分别代表吸附的开始时间和终止时间;Hginlet和Hgoutlet分别代表进口和出口的零价汞浓度。
模拟烟气中汞的浓度为0.90±0.05mg/m3,载气为N2+4%O2,模拟烟气流量为200mL/min,吸附剂的用量为30mg,计算得到模拟烟气空速约为1.0 ×105h-1,吸附温度为100~350℃。
2 结果与讨论
2.1 吸附剂的晶体结构分析-PXRD表征
本文采用PXRD分析了制备的三种锰氧化物的晶体结构,结果如图1所示。

图1 制备吸附剂的XRD谱图
通过检索数据库,发现以硫酸锰为锰源制备的锰氧化物主要以Mn2O3的形式结晶,对应PDF卡号为24-0508;而以硝酸锰和氯化锰为锰源制备的锰氧化物中除了以Mn2O3形式结晶,还有以Mn5O8的形式结晶的锰物种,对应的PDF卡号为:20-0718。另外,三种锰氧化物的衍射峰噪声较大,推测可能还有无定型的锰氧化物存在。
综上,若单从结晶态来看,以硫酸锰为锰源制备的锰氧化物中锰的平均价态较以硝酸锰和氯化锰为锰源制备的锰氧化物要低,这可能会对其吸附及氧化能力产生一定影响。
2.2 吸附剂的形貌分析-TEM
采用透射电镜观察了制备的锰氧化物的形貌,得到的照片如图2所示。相同的制备条件下,以不同锰盐为锰源制备的锰氧化物的形貌各不相同。以氯化锰为锰源制备的锰氧化物呈现出棒状的堆积;而以硫酸锰为锰源制备的锰氧化物呈现为不规则的块状结构;以硝酸锰为锰源制备的锰氧化物则主要以较小的颗粒形式存在,颗粒尺寸相对较为均匀(约40~60nm)。
结合PXRD结果,推测这些形貌的差异一方面可能与生成锰氧化物的形态不同有关,另一方面可能是与不同锰源得到的锰氧化物在沉淀或煅烧过程中晶体的成核或生长习性不同有关[6-7]。这些结构与形貌的差异可能会改变材料的表面性质,进而影响其对汞的吸附性能。

图2 以不同锰盐为锰源制备的锰氧化物的透射电镜照片
2.3 吸附剂的表面积分析-N2吸附脱附表征
本文中采用比表面积及孔径分析仪测定了吸附剂在液氮温度下的吸脱附等温线,根据BET模型计算了吸附剂的比表面积,结果如表1所示。

表1 不同锰源制备的锰氧化物吸附剂的比表面积
从表中数据可以看出,不论以何种锰盐为锰源,制备的锰氧化物的比表面积均比较小。结合PXRD数据及透射电镜照片,推测这可能是由于单分子锰氧化物在制备条件下更易团聚,倾向于形成较大尺寸的颗粒所致。对吸附剂来讲,比表面积小,暴露于表面的活性位点数就会相对较少,与烟气中污染物接触的机率降低,吸附剂表面吸附的污染物分子数就会减少,进而吸附剂的吸附能力较差。本文中制备的锰氧化物虽然比表面积较小,但通过预试验发现其对零价汞具有不错的吸附性能,据此推测作为零价汞吸附剂锰氧化物的吸附性能还有较大的提升空间。
2.4 吸附剂的氧化能力分析(H2-TPR)
众所周知,程序升温还原(H2-TPR)是考察催化剂的氧化还原性能的有效技术手段。本文采用H2-TPR技术考察了吸附剂的氧化能力。对于锰氧化物来说,在还原过程中一般会发生以下反应:
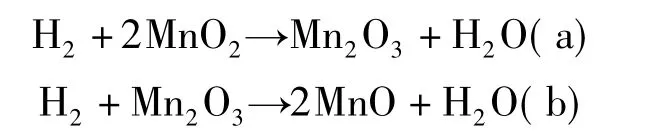
从制备的三种锰氧化物的H2-TPR曲线可以看出,以MnCl2和Mn(NO3)2为锰源制备的锰氧化物在300~550℃左右出现两个还原峰,应该分别归属于Mn4+到Mn3+的还原峰和Mn3+到Mn2+的还原峰;从两个峰的相对大小来看,以Mn(NO3)2为锰源制备的锰氧化物中高价态锰的含量较高;而以MnSO4为锰源制备的锰氧化物在500℃左右出现一个很小的还原峰,其主要的还原峰出现在600℃以上,说明以硫酸锰为锰源制备的锰氧化物的氧化能力较差;另外值得一提的是,前面的衍射结果表明,以MnSO4为锰源制备的锰氧化物主要以Mn2O3的形式结晶,但其H2-TPR还原峰却大幅度向高温偏移,这可能是由于表面存在部分未结晶的物种,抑制了锰氧化物的还原,从而降低其氧化能力,也说明表面结构对材料的氧化能力具有较大影响。
综上所述,用于制备锰氧化物的锰盐能够对产物的化学性质产生较大影响,通过不同锰源制备的锰氧化物具有不同的氧化能力。就本文的结果来看,以Mn(NO3)2为锰源制备的锰氧化物具有最强的氧化能力,而以MnSO4为锰源制备的锰氧化物的氧化能力最弱。
2.5 吸附剂的表面元素形态分析-XPS
文中采用XPS对以Mn(NO3)2为锰源制备的锰氧化物吸附剂吸汞前后的表面元素形态进行了分析,结果如图3所示。
从图3中可以看出,新制备的锰氧化物吸附剂在Hg 4f的结合能范围内没有出现的XPS峰;当吸附剂在模拟烟气中吸附零价汞10h后,在105.9eV及101.9eV结合能位置出现两个XPS峰,说明汞吸附在吸附剂表面,且以HgO的形式存在[8-9];当吸附剂在无氧条件下吸附10h零价汞后,在相近的结合能位置同样出现XPS峰,说明在无氧条件下,锰氧化物吸附剂依然具备吸附氧化零价汞的能力,只是结合能略向低能方向偏移,且没有发现对应于Hg0的XPS峰,说明在无氧条件下吸附的汞仍以氧化态的形式存在;此外,当穿透后的吸附剂在350℃条件下脱附后,吸附剂表面对应于汞结合能处的XPS峰消失,说明经过350℃热处理后,吸附在吸附剂表面的汞能够释放出来。

图3 吸附前后吸附剂表面汞的XPS图谱(Hg 4f)
2.6 吸附剂的汞吸附能力评价
2.6.1 温度对吸附剂吸附容量的影响
图4为通过穿透曲线计算得到的不同温度下吸附剂在10h内的零价汞的吸附容量。

图4 不同温度下不同锰源制备的吸附剂的零价汞吸附容量
从图4中可以看出,低温条件下MnOx对模拟烟气中的零价汞吸附能力较强,温度升高后,特别是150℃以上,MnOx对零价汞的吸附能力大大降低。具体来说,以Mn(NO3)2为锰源制备的MnOx在对零价汞具有最高的吸附容量,而以MnSO4为锰源制备的MnOx对零价汞的吸附容量最低,以MnCl2为锰源的MnOx的吸附容量介于两者之间。因此,后面试验选择以Mn(NO3)2为锰源制备的锰氧化物为例考察了空速及烟气组分对其吸附性能的影响,并探讨了吸附在表面的汞的脱附性能。
从上述结果可以看出,单组分锰氧化物具有一定的零价汞吸附氧化能力,但吸附容量还有待提高,这可能也是与其较低的比表面积息息相关的。通过掺杂改性,提高吸附剂的比表面积可能是改善其吸附性能的有效方式。
2.6.2 SO2及空速对吸附剂捕汞性能的影响
本文还考察了空速及烟气组分(SO2及O2)对以不同锰源制备的锰氧化物吸附剂零价汞吸附能力的影响,结果如图5所示。

图5 SO2及空速对吸附剂吸附能力的影响(100℃条件下)
从图5可以看出,对以MnCl2和Mn(NO3)2为锰源制备的锰氧化物来说,加入500μL/L SO2后,其零价汞吸附容量降低50%以上,说明SO2对零价汞在其表面的吸附具有明显的抑制作用;此外,当试验空速减半时,以MnCl2和Mn(NO3)2为锰源制备的锰氧化物对零价汞的吸附容量明显提高;值得注意的是关闭模拟烟气中的O2时,吸附剂零价汞的吸附容量进一步降低,说明O2可能参与了吸附反应的某个过程。对于以MnSO4为锰源制备的锰氧化物吸附剂,由于其本身吸附容量较小,试验中空速、烟气组分及O2对其零价汞吸附容量的影响没有反映出来。
2.6.3 材料的脱附性能初探
将吸附汞后的吸附剂进行加热处理,以考察锰氧化物吸附剂的热脱附性能(吸附为N2+4%O2,脱附吹扫气为N2),结果如图6所示。

图6 MnOx(以Mn(NO3)2为锰源)的脱附曲线
从图6中可以看出,在350℃条件下,脱附的汞信号迅速上升,出现了一个平头峰,说明在350℃条件下,吸附的汞能够迅速以零价汞的形式重新释放出来;由于释放的汞浓度很高,超出了仪器检测范围,因此图中出现了一段平头峰。当温度继续升高至400℃时,脱附曲线上仅出现了一个微弱的脱附峰说明吸附的汞在350℃,已基本脱附完毕。
综上,本文中制备的单组分锰氧化物不仅具有一定的零价汞吸附能力,而且吸附在其表面的汞能够经过简单的热处理重新释放出来。据此,后面的工作拟在锰氧化物基础上,通过掺杂进行修饰改性,一方面提高吸附剂的吸附容量,另一方面保持吸附剂的脱附性能,并进一步探讨其循环使用性能。
2.6.4 吸附剂的循环使用性能
本文中还通过吸附-热脱附-再吸附试验对锰氧化物的循环使用性能进行了初步考察,结果发现,当模拟烟气中不含SO2时,在三轮循环使用过程中,锰氧化物对零价汞的吸附容量未见明显下降,说明锰氧化物作为零价汞吸附剂具有较好的再生性能和循环使用性能;然而,当模拟烟气中含有500μL/L SO2时,锰氧化物对零价汞的吸附容量明显降低,且脱附后吸附容量没有恢复,说明SO2能够引起吸附剂的中毒,推测可能是由于部分表面被硫酸盐化,消耗了部分活性位点所致。因此,探寻合适的方法对锰氧化物进行修饰改性,增强其对SO2的耐受性,提高其循环使用性能是将锰基氧化物用于零价汞的脱除的首要任务,也是下一步的主要工作内容。
3 结语
通过不同的锰源制备的锰氧化物对模拟烟气中零价汞具有不同的吸附容量,其中,以Mn(NO3)2为锰源制备的锰氧化物吸附剂的零价汞吸附容量最高;温度对锰氧化物吸附剂的吸附性能影响很大,低温(100~150℃)有利于锰氧化物吸附剂对烟气中零价汞的吸附;通过XPS分析发现吸附的汞主要以HgO的形式附着在吸附剂表面,通过简单的加热处理可以将吸附的汞以高浓度零价汞的形式重新释放出来;SO2能够抑制零价汞在吸附剂表面的吸附;较低的空速有利于零价汞吸附;O2参与了吸附氧化过程,能够促进零价汞在吸附剂表面的吸附;以Mn (NO3)2为锰源制备的单组分锰氧化物虽然具有较强的氧化能力,能够在较低的温度下将吸附的汞氧化,但受限于其较小的比表面积,单组分锰氧化物的吸附容量仍十分有限。因此在保持其氧化能力的基础上设法提高吸附剂的比表面积,以增加汞与吸附剂表面的碰撞机会,进而提高吸附剂的吸附容量是下一步工作的重点。
[1]Pacyna E G,Pacyna K Sundseth,Munthe J,et al.Global emission of mercury to the atmosphere from anthropogenic sources in 2005 and projections to 2020[J].Atomos Environ,2010(44):2487-2499.
[2]Streets D G,Zhang Q,Wu Y.Projections of global mercury emissions in 2050[J].Environ Sci Technol,2009(43):2983-2988.
[3]Fitzgerald W F,Lamborg C H,Hammerschmidt C R.Marine biogeochemical cycling of mercury[J].Chem Rev,2007(107):641-662.
[4]Jiang G B,Shi J B,Feng X B.Mercury pollution in China[J].Environ Sci Technol,2006(40):3672-3678.
[5]Presto A A,Granite E J.Survey of catalysts for oxidation of mercury in flue gas[J].Environ Sci Technol,2006(40):5601-5609.
[6]Zhou K B,Li Y D.Catalysis based on nanocrystals with well-defined facets[J].Angew Chem,2012(51):602-613.
[7]Liu X W,Zhou K B,Wang L,et al.Oxygen vacancy clusters promoting reducibility and activity of ceria nanorods[J].J Am Chem Soc,2009(131):3140-3141.
[8]Tao S S,Li C T,Fan X P,et al.Activated coke impregnated with cerium chloride used for elemental mercury removal from simulated flue gas[J].Chem Eng J,2012(210):547-556.
[9]Hutson N D,Attwood B C,Scheckel K G.XAS and XPS characterization of mercury binding on brominated activated carbon[J].Environ Sci Technol,2007(41):1747-1752.
Discussion on capacities for adsorbing elemental mercury of manganese oxides
A series of manganese oxides were prepared by using different manganese salts as manganese sources.The prepared manganese oxides were first characterized by powder X-ray diffraction(PXRD),transmission electron microscopy(TEM),nitrogen adsorption,H2temperature-programmed reduction(H2-TPR)and X-ray photoelectron spectrum(XPS),and then employed as simulated flue gas mercury sorbent.Their capacities for absorbing elemental mercury from simulated flue gas were experimentally investigated.The results showed that manganese oxides prepared by different manganese source had different mercury capacities at different temperature.Among them,sorbent made from manganese nitrate showed the highest mercury capacity at lower temperature.Moreover,the adsorbed mercury could desorb from sorbent surface at higher temperature which showed the feasibility for preparing regenerable mercury sorbents.
manganese oxides;flue gas mercury pollution control;absorbong capacity;regenerable mercury sorbent;mercury desorption
X701.7
B
1674-8069(2015)03-004-05
2014-12-05;
2015-02-16
刘德宏(1968-),男,江苏盐城人,工程师,主要从事废水、大气污染防治等环保工程的实施应用及工程管理工作。E-mail:liudehong@gcl-power.com
