自动化工作站批量提取烤后烟叶DNA方法的建立与应用
2015-04-11赵杰宏张孝廉
余 婧,赵杰宏,邹 颉,付 强,张孝廉
(1.贵州省烟草科学研究院,烟草行业烟草分子遗传重点实验室,贵州 贵阳550081;
2.贵州烟叶复烤有限责任公司铜仁复烤厂,贵州 铜仁554300)
烟草及烟草制品的出口创汇是国际贸易的重要壁垒,因此,建立高效、快速、准确的烤后烟叶转基因成分检测技术至关重要,而基于DNA 检测的PCR技术中,获取高质量的DNA 模板是转基因检测的前提[1]。在GB/T 24310-2009《烟草及烟草制品转基因检测方法》中[2],烤后烟叶DNA 的提取方法为CTAB法,操作人员需要接触氯仿等有毒试剂,且该方法为手工提取,耗时较长。目前,自动化DNA 提取技术在医学中得到广泛应用,已有关于人的骨骼、血液、毛发等特殊样本的DNA 自动化提取方法[3-7],但该技术应用于植物DNA 的提取鲜见报道。磁珠法DNA 提取方法是利用细胞裂解液裂解细胞,从细胞中游离出来的DNA 分子被吸附到磁性颗粒表面,蛋白质等分子不被吸附而留在溶液中,在磁场作用下,磁性颗粒与液体分开,回收颗粒,再用纯水或TE 洗脱吸附的DNA[8]。该方法无需使用氯仿、异戊醇等有机溶剂,可整合自动化工作站批量提取生物DNA。因此,笔者采用BioMek NXP自动化工作站(96通道)与国产磁珠法植物DNA 提取试剂盒相结合,建立了自动化批量提取烤后烟叶DNA(作为PCR 模板)的方法,以获取高质量的烤后烟叶DNA 满足PCR 检测的需求。
1 材料与方法
1.1 烟叶、试剂与仪器
烟叶:取烤后烟叶300g左右(混合样),报纸包好置于烘箱50℃过夜烘干,用粉碎机研磨成细粉后直接用于DNA 提取。
试剂:磁珠法植物DNA 提取试剂盒(长春市志昂生物科技有限公司产品),内含磁珠原液、裂解液、提取液、洗涤液,洗涤液按说明书要求加入异丙醇,80% 乙 醇 及 无 水 乙 醇 自 备;rTaq 酶(货 号DR100A)、DNA Marker、6×Loading buffer均为大连宝生物公司产品。
仪器:BioMek NXP自动化工作站(美国BECKMAN 公司),含96 通道机械臂、磁力架、振荡加热模块,机械臂可实现样品及枪头盒在各工作模块的转移、加样、洗脱等操作;NanoDrop2000 超微量分光光度计(美国Thermo公司);C1000Touch PCR仪(美国BIO-RAD公司);ChemiDocXRS 凝胶成像系统(美国BIO-RAD 公司);Centrifuge 5471R 离心机(德国eppendorf公司);国产恒温水浴锅。
1.2 BioMek NXP耗材配置及程序
参照磁珠法植物DNA 提取试剂盒操作流程略作修改,在BioMek NXP自动化工作站上进行耗材的配置及软件程序的编写。
1.3 材料预处理
取70~100mg烟叶粉末,加入450μL裂解液,65℃水浴10min或30min,加入150μL提取液,室温放置5min,12 000r/min离心10min,取80μL上清液至96孔深孔板。磁珠原液在使用前按1∶10(V/V)加入无水乙醇制成磁珠混合液,洗涤液在使用前按3∶2(V/V)比例加入异丙醇。
1.4 DNA 提取
将96孔深孔板置于工作站模块台面上,点击操作软件,按以下程序运行:加入100μL磁珠混合液;27℃振荡60s,静置3min,27℃再次振荡60s,静置1min;吸磁2 min,弃废液;加入150μL 洗涤液,27℃振荡90s;吸磁60s,弃废液;加入80%乙醇380μL,27℃振荡90s,吸磁60s,弃废液,该步骤重复2~4次;56℃干燥15min;加入60μL 灭菌双蒸水,65℃振荡20s,室温放置5min,吸磁2 min;吸出50μL DNA溶液至96孔PCR 板中备用。
1.5 DNA 质量评价
1.5.1 紫外吸收法 取1μL 烤后烟叶DNA 溶液,用NanoDrop2000超微量分光光度计检测DNA纯度及浓度。根据国家标准GB/T 24310-2009《烟草及烟草制品 转基因检测方法》规定,DNA 提取物浓度≥100ng/μL,DNA 提取物纯度在1.7≤OD260/OD280≤1.9,计算DNA 提取合格率。
1.5.2 琼脂糖凝胶电泳检测 取DNA 合格率最高的处理,且在OD260nm 处有明显吸收峰的烟叶DNA 溶液5μL,1%琼脂糖凝胶电泳,电泳条件为恒压100V、缓冲液为1×TAE,通过凝胶成像系统对基因组DNA 质量进行观察拍照。
1.6 定性PCR 扩增的适应性检测
为验证上述方法提取的DNA 是否适用于普通PCR 扩增,取DNA 溶液稀释至100ng/μL为模板,对烟草内源硝酸还原酶基因(NR)进行定性PCR 扩增。根据国家标准GB/T 24310-2009《烟草及烟草制品 转基因检测方法》中NR 引物检索基因原序列,设计并合成NR 基因特异性引物(5’-CCGGAGGCGGTGGTTCAAAGTA-3’,5’-AAGTTCAGCATCAACATGGGGAGG-3’;扩增片段266bp)。PCR反应体系20μL:10×PCR Buffer 2μL,dNTP 1μL,rTaq 0.2μL(5 U/μL),DNA 1μL(100ng/μL),引物各1μL(10μmol/L)。PCR 反应条件:95℃预变性5min;94℃30s,65℃45s,72℃45s,35个循环;72℃延伸5 min。反应结束后加入6×Loading buffer 5μL,混匀后取8μL 于凝胶成像系统中检测。
2 结果与分析
2.1 烟叶DNA 溶液的浓度及纯度
从表可知,处理1 收集到的DNA 溶液纯度差且呈淡黄色浑浊状,可能是由于样本量较大,裂解不充分,且水浴时间过长,烟叶中的酚类物质容易氧化而发生褐化,在后期2次80%乙醇洗涤中不能完全洗去杂质。处理4 提取的DNA 浓度较为理想,平均值为153.3ng/μL,且纯度在OD260/OD280的平均值为1.81,标准偏差(SD)为0.06,样本总合格率达95.8%,且最后收集到的DNA 溶液基本无色素污染。表明,处理4 提取的DNA 效果较其他3 种处理好。

表 不同处理自动化提取烟叶DNA的浓度及纯度Table Comparison of the concentration and purity of automatic extracted DNA by different treat
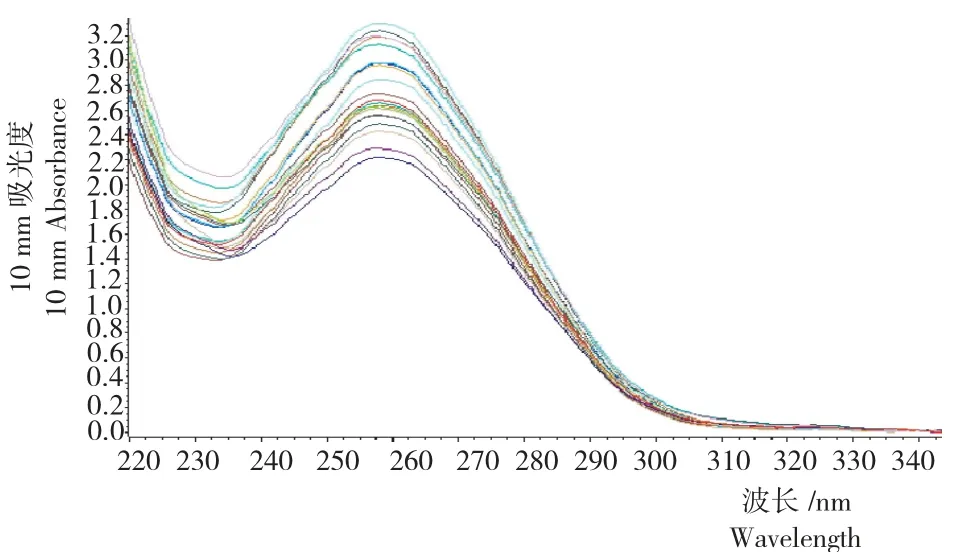
图1 处理4自动化提取烤后烟叶的DNA波长扫描Fig.1 Wavelength of the flue-cured tobacco DNA extracted by automation workstation
对处理4提取的DNA 进行检测,在260nm 处有明显的吸收峰(图1),说明提取的DNA 杂质(多糖及其他代谢产物)含量少,纯度较高。
2.2 提取烟叶DNA溶液质量
从图2看出,DNA 条带呈弥散、拖尾状,这是由于烟叶在调制过程中经过高温(68℃左右)处理后基因 组DNA 降 解 严 重[9-10]导 致。但DNA 主 带 清 晰,且DNA 纯度稳定性较好,符合PCR 检测需要。
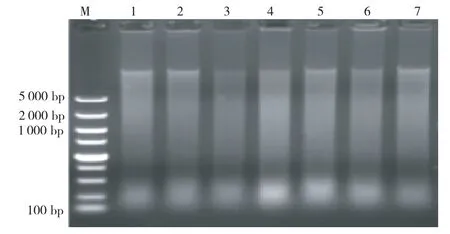
图2 处理4提取烤后烟叶DNA凝胶电泳图谱Fig.2 Gel electrophoresis of the flue-cured tobacco DNAextracted by automation workstation
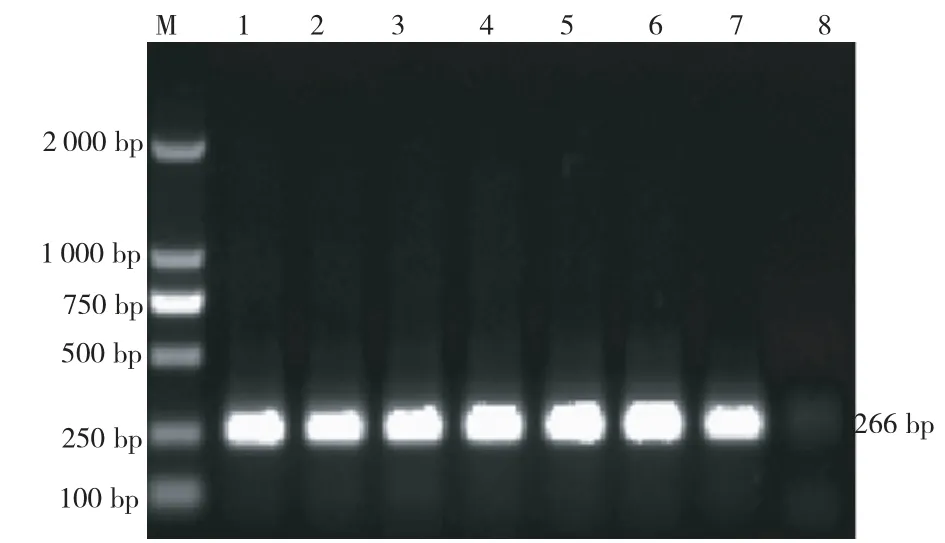
图3 自动化提取烤后烟叶DNA NR 基因PCR 扩增图谱Fig.3 PCR amplification result of NR-gene
2.3 定性PCR 的适应性检测
从图3 看出,提取烟叶DNA 模板均能扩增出266bp左右的特异性条带,表明,DNA 溶液中无酚类、多糖等次生物质抑制Taq酶活性,且在自动化提取过程中,样品经80%乙醇洗涤后在加热振荡器上56℃干燥15 min能有效去除残留乙醇。表明,处理4提取的DNA 符合PCR 定性扩增检测要求。
3 结论与讨论
通过磁珠法结合自动化工作站提取烤后烟叶DNA,处理4 提取的纯度及浓度的总合格率为95.8%,且样品中无酚类、多糖、乙醇等影响Taq酶活性的残留物质,DNA 可直用于PCR 反应。自动化工作站硬件及软件程序适配后,操作人员只需负责预处理、加样及上机,系统即可根据软件设计程序,自动化提取DNA。其中,样本初始量及80%乙醇洗涤次数是DNA 提取的关键,样本量过大则裂解不充分且离心不完全,所取上清液中仍有浑浊的粉末残留,80%乙醇多次洗涤也很难获得高质量的DNA,而在控制好初始样本量的情况下(一般为70mg),80%乙醇4次洗涤能进一步纯化DNA,不会对DNA 浓度造成损失。
烤后烟叶DNA 提取的经典方法,即CTAB 法在提取过程中为人工提取,当样本量较多时需耗费较大的人力,且样品交叉污染可能性增大。本研究建立的自动化提取方法,相对于人工提取而言,样本量越大提取优势越明显,以96份样品的提取工作为例,样本经裂解、水浴、离心后取上清液至96孔深孔板,上样后系统运行约110min便可完成96份样的提取工作;而CTAB法提取烤后烟叶DNA,每个操作人员工作8h最多只能提取48份样品。
目前,基于DNA 提取的PCR 检测技术已在分子标记辅助育种、亲缘关系分析、基因定位及种子纯度鉴定等基础研究及应用领域得到广泛应用,而大规模的PCR 检测中,DNA 模板的制备是进行大批量分子检测的基础[11]。本研究所建立的提取方法同样适于玉米、水稻等其他作物的高通量DNA 提取工作,但根据植物材料DNA 提取特性的不同,需对前处理进行优化及自动化工作站软硬件的适配,以提取到适于PCR 检测的DNA 模板。
[1] 蔡翠霞,肖维威,康文杰,等.转基因食品DNA 提取研究进展[J].中国生物工程杂志,2011,31(5):121-125.
[2] 中国国家标准化管理委员会.GB/T 24310-2009《烟草及烟草制品 转基因检测方法》[S].北京:中国标准出版社,2009.
[3] Greenspoon S A,Ban J D,Sykes K,et al.Application of the BioMek 2000laboratory automation workstation and the DNA IQTMsystem to the extraction of forensic casework samples[J].Journal of forensic sciences,2004,49(1):29-39.
[4] Stangegaard M,Meijer P J,Bφrsting C,et al.Biomek 3000The Workhorse in an Automated Accredited Forensic Genetic Laboratory[J].Journal of laboratory automation,2012,17(5):378-386.
[5] 刘 莉,王卫华,唐剑锋.磁珠法在自动化核酸提取工作站中 的 应 用[J].法 医 学 杂 志,2013,29(2):144-144.
[6] 凌 洁,王 昊,张 帅,等.磁珠法半自动提取全血基因组DNA 条件的优化[J].浙江大学学报:医学版,2012,41(3):321-326.
[7] 高林林,徐念来,谢 炜,等.利用AutoMate ExpressTM自动化法医DNA 提取系统提取骨骼及牙齿DNA[J].法医学杂志,2013,29(2):127-129.
[8] 杨 电,张丽萍,刘 超,等.Chelex法和两种磁珠法提取接触DNA 效果的比较[J].刑事技术,2012(1):11-13.
[9] 郭兆奎,万秀清,魏继承,等.适于PCR 分析的烤后烟叶DNA 提 取 方 法 的 研 究[J].中 国 烟 草 科 学,1999(4):5-8.
[10] 马 林,王广超,罗昭标,等.烤后烟叶基因组DNA提取条件优化[J].郑州轻工业学院学报:自然科学版,2013,28(2):59-63.
[11] 王慧娜,初志战,马兴亮,等.高通量PCR 模板植物基因组DNA 制 备 方 法[J].作 物 学 报,2013,39(7):1200-1205.
