术后放疗在胸腺肿瘤治疗中的临床价值:中国胸腺肿瘤研究协作组回顾性研究
2015-04-11杨富傅剑华中国胸腺肿瘤研究协作组
杨富 傅剑华 中国胸腺肿瘤研究协作组
术后放疗在胸腺肿瘤治疗中的临床价值:中国胸腺肿瘤研究协作组回顾性研究
杨富1傅剑华1中国胸腺肿瘤研究协作组2
目的 探讨术后放疗在Ⅱ、Ⅲ期胸腺肿瘤中的应用价值。方法 回顾性分析中国胸腺肿瘤研究协作组(ChART)数据库中1994年4月至2013年3月间的接受手术治疗的Ⅱ期及Ⅲ期胸腺肿瘤病例共870例,最终共有548例符合条件纳入分析,分为术后放疗组(347例)和术后未放疗组(201例)。Kaplan-Meier法分析预后,Cox风险回归模型进行多因素生存分析。结果 病理类型、Masaoka-Koga分期和手术根治性是胸腺肿瘤主要的预后影响因素。接受根治性手术的胸腺肿瘤患者术后放疗组与未术后放疗组患者的5年、10年生存率分别为87.7%±2.5%、87.8%±4.0%和80.8%±3.6%、83.8%±5.4%,差异无统计学意义(P=0.529,log-rank检验)。接受姑息手术的胸腺肿瘤患者术后放疗组与未术后放疗组的5年、10年生存率分别为73.4%±6.1%、40.4%±15.5%和46.3%±12.4%、40.4%±15.5%,差异有统计学意义(P=0.017,log-rank检验)。胸腺癌患者术后放疗组与未术后放疗组的5年、10年生存率分别为79.3%±3.9%、65.4%±11.1%和49.2%±10.6%、54.5%±13.6%,差异无统计学意义(P=0.054,Breslow检验)。结论 术后放疗未能改善根治性胸腺肿瘤的预后,但能改善胸腺瘤姑息切除患者的预后,并有改善胸腺癌患者预后的趋势。
胸腺肿瘤; 胸腺癌; 术后放疗; 预后
胸腺肿瘤是前纵隔最常见的原发性肿瘤,起源于胸腺上皮细胞,包括了胸腺瘤和胸腺癌。胸腺肿瘤发病率低,根据美国国家癌症研究所报道,发病率仅为0.13/10万,亚裔人群及黑人的发病率相对偏高,在男女间发病率无差异,发病高峰年龄为60~70岁[1]。胸腺肿瘤仅占所有恶性肿瘤的0.2%~1.5%,占纵隔肿瘤的20%,占前纵隔肿瘤的50%左右[2],约30%的胸腺瘤患者合并重症肌无力。
目前,外科手术是胸腺肿瘤最为重要的治疗手段。手术完全切除是独立的预后影响因素[3-6],ITMIG推荐的完整性切除包括胸腺的完全切除以及周围纵隔脂肪组织的切除[7]。局部复发是胸腺肿瘤最常见的治疗失败模式[3,5,8-9],接受完整切除的患者术后复发率低于非完整切除的患者,生存时间明显优于非完整切除的患者[10]。化疗在胸腺肿瘤中应用广泛,常用于术前化疗、非根治性手术后化疗、姑息性化疗、复发后化疗,完整切除的胸腺肿瘤并不推荐术后化疗[4]。对于Ⅰ期胸腺肿瘤,手术切除率高,术后复发率低,故认为完全切除Ⅰ期胸腺肿瘤后,不再推荐放疗。而对于Ⅳ期患者,单纯手术并非理想的治疗方案,完全切除率低下,术后复发率高,故对于可完全切除的Ⅳa期患者,常常给予术后放疗或术后放化疗,而对于无法完全切除的Ⅳ期患者,姑息性放化疗可减轻症状[5,8,11]。而对于Ⅱ、Ⅲ期患者,术后放疗的应用价值存在争论,所报道的结果各异[5,12-17],大多来自单中心的回顾性分析。由于胸腺肿瘤发病率低、复发率低、预后良好等原因,目前仍缺乏临床随机对照研究来明确术后放疗的作用,缺乏统一的治疗方案。为进一步规范胸腺肿瘤的诊治,中国胸腺肿瘤协作组(the Chinese Alliance of Research for Thymomas,ChART)于2012年在上海成立,并收集了国内多家大型治疗中心的胸腺瘤数据,建立了大型数据库。本研究的目的是利用ChART数据库所登记的病例,探讨术后放疗在胸腺肿瘤中的应用价值。
资料与方法
一、病例资料
对在ChART数据库登记的1994年4月至2013年3月间在ChART各治疗中心接受治疗的胸腺肿瘤病例进行回顾性分析。纳入标准:(1)未接受术前治疗;(2)接受手术切除治疗,包括R0、R1和R2切除;(3)Ⅱ期及Ⅲ期患者;(4)无既往肿瘤病史; (5)有随访资料。患者随访由各治疗中心独立完成。
二、病理分期
根据Masaoka-Koga分期系统对所有病例进行重新分期[18]。Ⅰ期:肉眼和显微镜下可见肿瘤包膜完整;Ⅱa期:显微镜下包膜受侵犯;Ⅱb期:肉眼可见肿瘤侵犯正常胸腺或周围脂肪组织,或粘连但未侵犯纵隔胸膜或心包;Ⅲ期:肉眼可见肿瘤侵犯邻近器官;Ⅳa期:肿瘤在胸膜或心包转移;Ⅳb期:经淋巴或血性转移。根据2004 WHO胸腺上皮肿瘤分类标准对病理类型[19-20]进行了回顾并重新分类。
三、统计学处理
采用SPSS 19.0(SPSS Inc,Chicago,IL)进行统计学分析。正态分布的连续变量采用Student’t检验。分类变量采用Pearson’s卡方检验进行分析。生存分析采用 Kaplan-Meier法,log-rank检验或Breslow检验进行单因素生存分析。Log-rank检验或Breslow检验P<0.10的变量将纳入Cox风险回归模型进行多因素生存分析。P<0.05时认为差异有统计学意义。
结果
一、一般资料
ChART数据库中共有Ⅱ、Ⅲ期病例870例,其中599例患者有随访资料,599例中有584例接受了手术治疗(包括 R0、R1和R2切除,不包括活检)。584例患者中36例接受了术前治疗;2例有既往肿瘤病史,也已接受了术前治疗。最终有548例患者纳入最后的分析,其中Ⅱa期59例,Ⅱb期194例,Ⅲ期325例。其中男性323例,女性225例;年龄11~81岁,中位年龄53岁;94例(17.2%)的患者有重症肌无力。
二、治疗组分布情况
347例(63.3%)患者接受了术后放疗,201例(36.7%)患者未接受术后放疗。胸腺癌患者术后放疗比例(81.2%,134/165)最高,B型胸腺瘤(66.7%,176/264)其次,A型和AB型胸腺瘤术后放疗比例(31.1%,37/119)最低。Ⅲ期胸腺肿瘤术后放疗比例为(75.4%,245/325),比Ⅱ期患者高(Ⅱa、Ⅱb期分别为65.5%和42.5%,表1)。男性患者中术后放疗的比例高于女性患者,其中男性患者中胸腺癌和Ⅲ期的比例均高于女性,差异有统计学意义(χ2= 10.238,P=0.006;χ2=6.757,P=0.034,表2、3),推测男性患者术后放疗比例高是由这两方面原因引起。接受胸腔镜手术的患者中胸腺癌的比例最低、Ⅲ期的比例低,由此导致接受胸腔镜手术的患者术后放疗的比例最低。姑息性手术患者术后放疗比例高于根治性手术患者。部分胸腺切除的患者术后放疗的比例高于全胸腺切除的患者。术后放疗的患者更多同时接受了术后化疗。不同年龄组间、有无伴瘤综合征组间术后放疗的比例无统计学差异。伴瘤综合征的患者Ⅲ期的比例(53.5%)低于未伴瘤综合征的患者(60.6%),而且胸腺癌的比例仅为3.0%(表1~3)。

表1 术后放疗与未术后放疗胸腺肿瘤患者临床特征分析

表2 不同病理类型胸腺肿瘤患者的临床病理特征分析
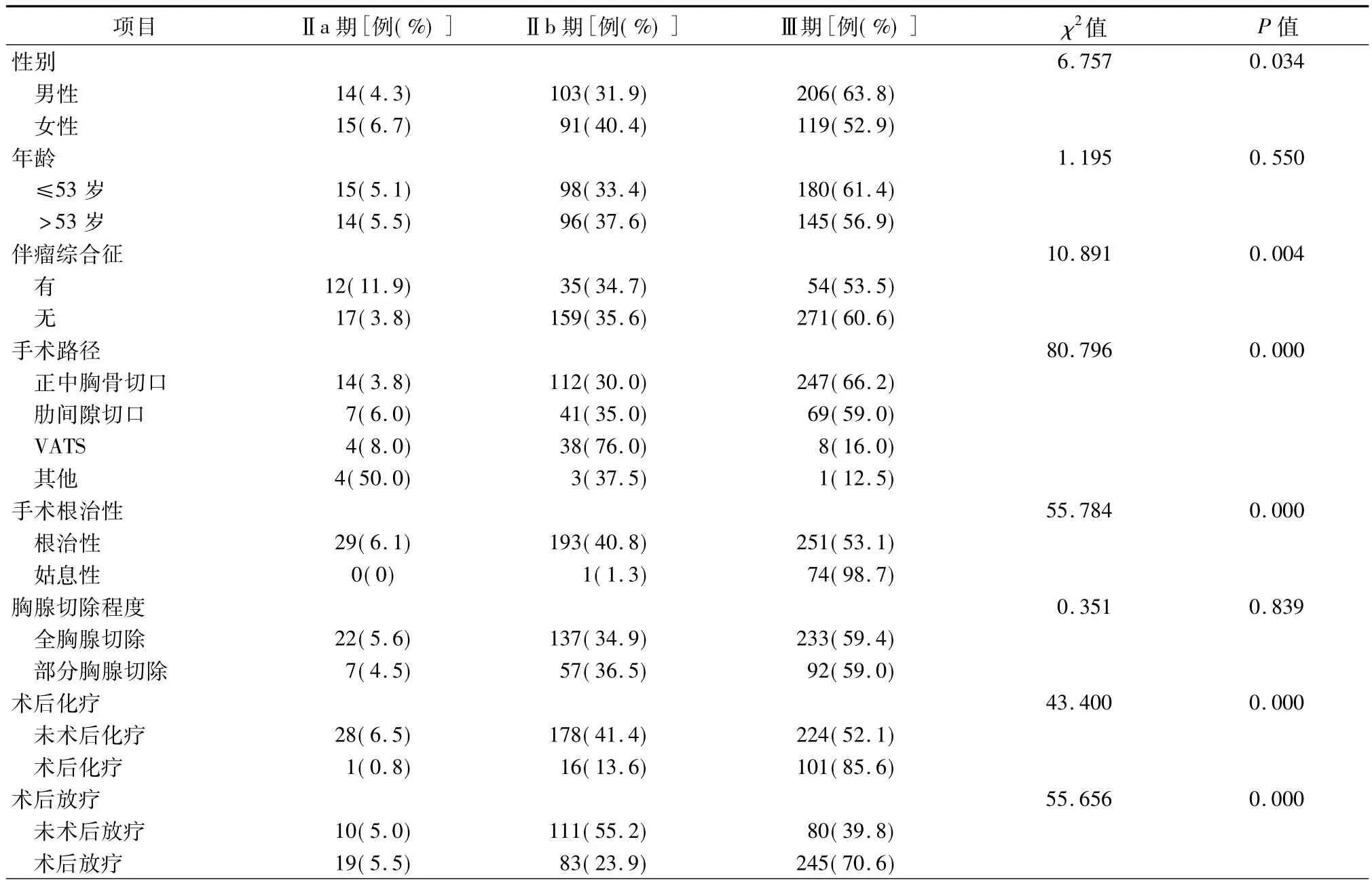
表3 不同病理分期胸腺肿瘤患者的临床特征分析
三、单因素生存分析
Kaplan-Meier法单因素生存分析显示:术后放疗组与未术后放疗组患者的5年和10年总生存率差异均无统计学意义(P=0.706,图1)。性别、手术路径对生存无均显著影响,而年龄、有无伴瘤综合、病理类型、Masaoka-Koga分期、手术的根治性、胸腺的切除程度、术后化疗对预后有显著影响(表4)。其中术后化疗患者的预后更差,进一步分析提示可能是由于术后化疗的患者中Ⅲ期和胸腺癌比例高所导致(表2、3)。
四、多因素生存分析

图1 术后放疗组与未术后放疗组的生存曲线(术后放疗未改善Ⅱ、Ⅲ期胸腺肿瘤患者的预后,P=0.706)

表4 胸腺肿瘤患者的单因素生存分析
Cox风险回归模型进行多因素生存分析,提示病理类型、Masaoka-Koga分期、手术的根治性是独立的预后影响因素,而年龄、伴瘤综合征、胸腺切除程度、术后化疗并非独立的预后影响因素(表5)。
五、分层单因素生存分析
根据手术根治性、病理类型、Masaoka-Koga分期进行分层单因素生存分析,发现根治性手术后放疗并不能改善预后(P=0.529),而姑息性手术后放疗则可显著改善预后(P=0.017,图2)。术后是否放疗对于胸腺瘤患者(A+AB型和B型)的预后无影响(P=0.671和P=0.422);术后放疗有提高胸腺癌患者5年生存率的趋势,但统计学上无显著性意义(P=0.054,图3)。无论是Ⅱ期还是Ⅲ期胸腺肿瘤患者,术后放疗均未能显示出改善预后的效果(P =0.980和P=0.418,表6)。

表5 胸腺肿瘤患者术后生存率Cox风险回归模型进行多因素生存分析

图2 胸腺肿瘤患者术后放疗与未术后放疗的生存曲线。2A为行根治性手术治疗的胸腺肿瘤患者,术后放疗未改善预后,P=0.529;2B为行姑息性手术治疗的胸腺肿瘤患者,术后放疗显著改善了预后,P=0.017) 图3 胸腺瘤和胸腺癌患者术后放疗与未术后放疗的生存曲线。3A为术后放疗未改善A+AB型胸腺瘤患者的预后,P=0.671;3B为术后放疗未改善B型胸腺瘤患者的预后,P=0.422;3C为术后放疗有改善胸腺癌患者预后的趋势,但差异无统计学意义,P=0.054)

表6 分层分析胸腺肿瘤患者术后放疗的作用(x±s)
讨论
术后放疗在胸腺肿瘤中的价值目前仍存在争论。由于胸腺肿瘤是放射敏感肿瘤,所以不少临床医师主张对胸腺肿瘤进行术后放疗[13-14,21-23]。支持术后放疗者认为胸腺肿瘤术后局部复发是最主要的治疗失败模式,Ⅲ期胸腺瘤复发率接近30%,术后放疗可减少复发,提高局部控制率[21,24]。然而,由于胸腺肿瘤发病率低、复发率低、预后良好、大量患者并非死于胸腺肿瘤等原因,目前仍缺乏临床随机对照研究来明确术后放疗的作用,难以准确评价术后放疗的价值。
本研究来自全国多中心数据库,筛选出接受手术治疗的Ⅱ、Ⅲ期胸腺肿瘤患者共548例进行分析,大部分(63.3%)患者接受了术后放疗。然而,对全组胸腺肿瘤患者的预后分析中,术后放疗并不能改善胸腺瘤患者的预后。接受术后放疗与未术后放疗患者的5年、10年生存率分别为84.4%、71.8%和83.9%、80.3%。然而,术后放疗的患者中胸腺癌的比例高于未术后放疗者(分别为 38.6%、15.4%),B型胸腺瘤的比例亦高于未术后放疗者(分别为50.7%、43.8%)。术后放疗的患者中Ⅲ期的比例远高于未术后放疗的患者(分别为70.6%、 39.8%)。术后放疗的患者中姑息性手术的比例高于未术后放疗的患者(分别为18.4%、5.5%)。在分层分析中,无论是Ⅱ期还是Ⅲ期胸腺肿瘤患者,术后放疗均无明显改善预后的作用。而对于姑息性手术的胸腺肿瘤患者,术后放疗有改善预后的趋势,主要是提高了5年生存率,而10年生存率无明显差异。
病理类型、Masaoka-Koga分期及手术切除完整性被认为是胸腺肿瘤最主要的独立预后影响因素[4,8]。本研究中胸腺癌的预后明显差于胸腺瘤患者,但对胸腺瘤进一步细分时,不同类型间的预后却无显著性差异,与Detterbeck等[3]系统综述的结论相似。本研究表明根治性切除对于胸腺肿瘤具有非常重要的作用,对于接受了根治性手术的胸腺瘤患者来说,无须再进一步术后放疗,避免放疗所导致的造血系统恶性肿瘤、放射性肺炎、慢性肺纤维化、食管恶变、限制性心肌病、心包渗出等远期不良反应[25-29]。我们的分析结果与多位学者的研究结果类似。Mangi等[15]对Ⅲ期胸腺瘤患者进行了回顾性分析,认为Ⅲ期胸腺瘤大多能接受根治性手术,对于行根治性手术的患者,术后放疗并不能减少局部复发和远处转移,术后放疗并不能改善Ⅲ期胸腺瘤患者的疾病特异性生存率及无进展生存率。Utsumi等[17]认为对于A型、AB型和B1型的Ⅰ、Ⅱ期胸腺瘤来说,单纯根治性切除已足够;而对于Ⅲ、Ⅳ期胸腺瘤,也未能证实术后放疗能改善预后。Kondo等[5]对来自日本115个医疗机构的1320例胸腺肿瘤患者进行分析,报道显示根治性切除是胸腺肿瘤最主要的预后影响因素,对于根治性切除的Ⅱ期和Ⅲ期甚至完整切除的Ⅳ期胸腺肿瘤,术后放疗既无法减少复发,亦无法改善预后。Korst等[12]对22项回顾性队列研究进行了系统综述,共包含了592例根治性手术的Ⅱ期和Ⅲ期胸腺肿瘤患者,其中有13项研究包含342例患者有完整的数据可以进行Meta分析,结果提示无论是Ⅱ期还是Ⅲ期患者,术后放疗均无减少复发的作用。也有部分学者认为术后放疗是有价值的,Weksler等[16]对医疗保险监督、流行病学和最终结果(surveillance,epidemiology,and end results,SEER)数据库里的476例接受手术治疗的Ⅲ期胸腺瘤患者进行分析,其中 322例患者接受了术后放疗(67.6%),术后放疗明显改善了该组患者的疾病特异性生存率,但总生存率并无明显改善。
放疗能显著改善预后。对于胸腺癌患者,预后给予术后放疗有改善预后的趋势,主要是提高了5年生存率,而10年生存率无明显差异。
病理类型、Masaoka-Koga分期及手术切除完整胸腺癌在胸腺肿瘤中恶性程度最高,首选的治疗方案仍是手术,根治性手术的患者预后远好于姑息性手术患者。Weksler等[30]对SEER数据库进行了分析,共有290例胸腺癌患者,术后放疗并不能显著改善胸腺癌的预后。而Hsu等[31]的报道术后放疗有改善胸腺癌预后的趋势,但术后放疗组与单纯手术组间生存率在统计学上无显著性差异。本研究与Hsu等所报道的类似,术后放疗有改善预后的趋势,但差异无统计学意义(P=0.054),可能与样本量过小有关。
重症肌无力是胸腺肿瘤中最常见的伴瘤综合征,伴有重症肌无力的患者就诊时常常相对早期,而且胸腺癌的比例相对较低[32-34]。我们的研究提示,伴有重症肌无力的患者更多为胸腺瘤,并且分期较无重症肌无力患者要早。因此,在单因素生存分析时,伴有重症肌无力的患者预后要好于无重症肌无力患者,然而在Cox风险回归模型多因素生存分析中,重症肌无力并非独立预后影响因素。
根治性手术、病理类型和Masaoka-Koga分期均是胸腺肿瘤最重要的预后影响因素。对于可手术根治切除的Ⅱ、Ⅲ期胸腺瘤患者,术后接受放疗并不能改善预后。对于姑息性手术的患者,术后放疗是必要的,能显著改善预后;术后放疗有改善胸腺癌预后的趋势,但均有必要通过多中心前瞻性随机对照研究进一步明确术后放疗的价值。
中国胸腺肿瘤研究协作组成员:上海交通大学附属胸科医院:方文涛(胸外科)、谷志涛(胸外科)、王长禄(放疗科),张杰(病理科);复旦大学附属中山医院:谭黎杰(胸外科);复旦大学附属华山医院:庞烈文(胸外科);同济大学附属肺科医院:陈岗(病理科);中山大学附属肿瘤医院:傅剑华(胸外科);郑州大学附属肿瘤医院:李印(胸外科);青岛大学医学院附属医院:沈毅(胸外科);天津医科大学附属肿瘤医院:于振涛(胸外科);四川省肿瘤医院:韩泳涛(胸外科);北京大学附属第三医院:闫天生(胸外科);北京大学附属肿瘤医院:曹登峰(病理科),陈克能(胸外科),付浩(胸外科)
1 Engels EA.Epidemiology of thymoma and associated malignancies[J].J Thorac Oncol,2010,5(10 Suppl 4):S260-S265.
2 Qu YJ,Liu GB,Shi HS,et al.Preoperative CT findings of thymoma are correlated with postoperative Masaoka clinical stage[J].Acad Radiol,2013,20(1):66-72.
3 Detterbeck F,Youssef S,Ruffini E,et al.A review of prognostic factors in thymic malignancies[J].J Thorac Oncol,2011,6(7 Suppl 3):S1698-1704.
4 Detterbeck FC,Zeeshan A.Thymoma:current diagnosis and treatment[J].Chin Med J(Engl),2013,126(11):2186-2191.
5 Kondo K,Monden Y.Therapy for thymic epithelial tumors:a clinical study of 1,320 patients from Japan[J].Ann Thorac Surg,2003,76(3):878-884;discussion 884-875.
6 Rea F,Marulli G,Girardi R,et al.Long-term survival and prognostic factorsin thymic epithelialtumours[J].EurJ Cardiothorac Surg,2004,26(2):412-418.
7 Patterson GA, Deslauriers J, Lerut A, et al.Thoracic and esophageal surgery[M].3rd ed.Philadelphia:Elsevier,2008: 1589-1614.
8 Tomaszek S,Wigle DA,Keshavjee S,et al.Thymomas:review of current clinical practice[J].Ann Thorac Surg,2009,87(6):1973-1980.
9 Falkson CB,Bezjak A,Darling G,et al.The management of thymoma a systematic review and practice guideline[J].J Thorac Oncol,2009,4(7):911-919.
10 Maggi G,Casadio C,Cavallo A,et al.Thymoma:results of 241 operated cases[J].Ann Thorac Surg,1991,51(1):152-156.
11 Kundel Y,Yellin A,Popovtzer A,et al.Adjuvant radiotherapy for thymic epithelial tumor:treatment results and prognostic factors[J].Am J Clin Oncol,2007,30(4):389-394.
12 Korst RJ,Kansler AL,Christos PJ,et al.Adjuvant radiotherapy for thymic epithelial tumors:a systematic review and meta-analysis[J].Ann Thorac Surg,2009,87(5):1641-1647.
13 Chen G,Marx A,Chen WH,et al.New WHO histologic classification predicts prognosis of thymic epithelial tumors:a clinicopathologic study of 200 thymoma cases from China[J].Cancer,2002,95(2):420-429.
14 Ogawa K,Uno T,Toita T,et al.Postoperative radiotherapy for patients with completely resected thymoma:a multi-institutional,retrospective review of 103 patients[J].Cancer,2002,94(5): 1405-1413.
15 Mangi AA,Wain JC,Donahue DM,et al.Adjuvant radiation of stageⅢ thymoma:is it necessary?[J]Ann Thorac Surg,2005,79 (6):1834-1839.
16 Weksler B,Shende M,Nason KS,et al.The role of adjuvant radiation therapy for resected stageⅢthymoma:a population-based study[J].Ann Thorac Surg,2012,93(6):1822-1828;discussion 1828-1829.
17 Utsumi T,Shiono H,Kadota Y,et al.Postoperative radiation therapy after complete resection of thymoma has little impact on survival[J].Cancer,2009,115(2):5413-5420.
18 Detterbeck FC,Nicholson AG,Kondo K,et al.The Masaoka-Koga stage classification forthymic malignancies: clarification and definition of terms[J].J Thorac Oncol,2011,6(7 Suppl 3): S1710-1716.
19 陈岗,朱雄增.2004年WHO胸腺上皮肿瘤分类简介与浅评[J].中华病理学杂志,2005,34(12):769-770.
20 Beasley MB,Brambilla E,Travis WD.World Health Organization classification of tumors:pathology and genetics of tumors of the lung,pleura,thymus and heart.Lyon France:IARC Press,2004: 146-248.
21 Myojin M,Choi NC,Wright CD,et al.StageⅢthymoma:pattern of failure after surgery and postoperative radiotherapy and its implication for future study[J].Int J Radiat Oncol Biol Phys,2000,46(4):927-933.
22 Regnard JF,Magdeleinat P,Dromer C,et al.Prognostic factors and long-term results after thymoma resection:a series of 307 patients[J].J Thorac Cardiovasc Surg,1996,112(2):376-384.
23 Zhu G,He S,Fu X,et al.Radiotherapy and prognostic factors for thymoma:a retrospective study of 175 patients[J].Int J Radiat Oncol Biol Phys,2004,60(4):1113-1119.
24 Ruffini E,Mancuso M,Oliaro A,et al.Recurrence of thymoma: analysis of clinicopathologic features,treatment,and outcome[J].J Thorac Cardiovasc Surg,1997,113(1):55-63.
25 Shulimzon T,Apter S,Weitzen R,et al.Radiation pneumonitis complicating mediastinal radiotherapy post pneumonectomy[J].Eur Respir J,1996,9(12):2697-2699.
26 Yeoh E,Holloway RH,Russo A,et al.Effects of mediastinal irradiation on oesophageal function[J].Gut,1996,38(2):166-170.
27 Velissaris TJ,Tang AT,Millward-Sadler GH,et al.Pericardial mesothelioma following mantle field radiotherapy[J].J Cardiovasc Surg(Torino),2001,42(3):425-427.
28 Johansson S,Svensson H,Denekamp J.Timescale of evolution of late radiation injury after postoperative radiotherapy of breast cancer patients[J].Int J Radiat Oncol Biol Phys,2000,48(3):745-750.
29 Adams MJ,Lipsitz SR,Colan SD,et al.Cardiovascular status in long-term survivors of Hodgkin’s diseasetreated with chest radiotherapy[J].J Clin Oncol,2004,22(15):3139-3148.
30 Weksler B,Dhupar R,Parikh V,et al.Thymic carcinoma:a multivariate analysis of factors predictive of survival in 290 patients[J].Ann Thorac Surg,2013,95(1):299-303.
31 Hsu CP,Chen CY,Chen CL,et al.Thymic carcinoma.Ten years’experience in twenty patients[J].J Thorac Cardiovasc Surg,1994,107(2):615-620.
32 Evoli A,Minisci C,Di Schino C,et al.Thymoma in patients with MG:characteristics and long-term outcome[J].Neurology,2002,59 (12):1844-1850.
33 Strobel P,Bauer A,Puppe B,et al.Tumor recurrence and survival in patientstreated forthymomasand thymic squamous cell carcinomas:a retrospective analysis[J].J Clin Oncol,2004,22 (8):1501-1509.
34 Kondo K,Monden Y.Thymoma and myasthenia gravis:a clinical study of 1,089 patients from Japan[J].Ann Thorac Surg,2005,79 (1):219-224.
Clinical value of Postoperative radiation therapy for thymic tumors:a retrospective study from theChinese Alliance for Research of Thymoma
Yang Fu1,Fu Jianhua1,the Chinese Alliance for Research of Thymoma2.1Department of Thoracic Surgery,Sun Yat-sen University Cancer Centre,Guangzhou 510060,China;2the Chinese Alliance for Research of Thymoma
Fu Jianhua,Email:fujh@sysucc.org.cn
Objective To determine the value of postoperative radiation therapy in stageⅡ-Ⅲthymic tumors.Methods The data of patients from the Chinese Alliance of Research for Thymomas(ChART) database between April 1994 and March 2013 were retrospectively analyzed,and the patients were divided into postoperative radiation therapy group and non-postoperative radiation therapy group.The prognosis was estimated with Kaplan-Meier method,and the multi-variate survival analysis was carried out using Cox proportional hazard model.Results Pathological type,Masaoka-Koga stage and completion of resection were main prognostic factors of thymic tumors.For the thymic tumor patients with complete resection,the 5-year survival of patients in postoperative radiation therapy group and non-postoperative radiation therapy group were 87.7% ±2.5%and 87.8% ±4.0%,and the 10-year survival were 80.8% ±3.6%and 83.8% ±5.4%,respectively(P=0.529,log-rank test).For the thymic tumor patients with incomplete resection,the 5-year survival of patients in postoperative radiation therapy group and non-postoperative radiation therapy group were 73.4% ±6.1%and 40.4% ±15.5%,and the 10-year survival were 46.3% ±12.4%and 40.4% ±15.5%,respectively(P=0.017,log-rank test).For the thymic carcinoma patients,the 5-year survival of patients in postoperative radiation therapy group and non-postoperative radiation therapy group were 79.3% ±3.9% and 65.4% ±11.1%,and the 10-year survival were 49.2% ±10.6%and 54.5% ±13.6%,respectively(P= 0.054,Breslow test).ConclusionsPostoperative radiation therapy after complete resection does not improve the prognosis of thymic tumors.Postoperative radiation therapy is associated with improved prognosis in patients receiving incomplete resection with thymomas and those with thymic carcinoma.
Thymic tumor; Thymic carcinoma; Postoperative radiation therapy; Prognosis
2014-09-20)
(本文编辑:周珠凤)
10.3877/cma.j.issn.2095-8773.2015.01.005
510060广州,广东中山大学附属肿瘤医院胸外科1;中国胸腺瘤协作组2
傅剑华,Email:fujh@sysucc.org.cn
杨富,傅剑华,中国胸腺肿瘤研究协作组.术后放疗在胸腺肿瘤的应用价值[J/CD].中华胸部外科电子杂志,2015,1(1): 20-28.
