组织特异性启动子的结构特征及其调控作用
2015-04-08陈梦词段丽婕王锁民
陈梦词,张 婧,未 丽,段丽婕,王锁民
(草地农业生态系统国家重点实验室 兰州大学草地农业科技学院,甘肃 兰州730020)
植物组织特异性启动子亦称器官特异性启动子,能够调控基因在某些特定器官或组织中表达,并与植物发育相关。基因工程研究的关键是外源基因在细胞中的表达,而组织特异性启动子不仅能够在一定器官或组织部位积累目的基因的表达产物,增加区域表达量,同时也能避免植物营养的不必要浪费[1]。经序列分析研究发现,组织特异性启动子中含有与其特异性调控相关的结构元件,此外,其活性也受特定的物理和化学信号诱导。作为调控外源基因在转基因植株体内定位、定时表达的重要元件,组织特异性启动子已成为分子生物研究工作的热点之一[2]。近年来,研究者在植物的各种组织中都发现有调控基因表达的特异性启动子,特别是在根、维管束和花器官特异性启动子研究中取得了很大进展,并且发现组织特异性启动子在植物器官发育、营养物质运输和贮藏、能量固定、抵抗生物和非生物胁迫以及植物与微生物互作方面具有重要作用。
1 植物组织特异性启动子的结构特征
高等植物组织特异性启动子具有真核生物启动子的基本结构元件,通常由核心启动子元件(Core Pr o moter Element)和启动子近端元件(Pr o moter Proxi mal Element)两部分组成,启动子区域与转录起始点相接,大约位于-250~+250核苷酸区域,大部分植物基因多数情况下转录起点为A(腺嘌呤),且两侧多为嘧啶碱基。通过核心启动子起始转录至少需要-35~+35核苷酸连续区域[3],这个区域在-30至-25 bp处通常包括一段TATAAA 保守序列,称为TATA 盒[4]。近端启动子区域位于核心启动子区上游,-78至-70 bp处有另一段保守序列CCAAT,称为CAAT 盒,-110至-80 bp区域有GC保守序列,称为GC 盒[4]。另外,起始因子(Inr)也是基因启动子的核心结构,与转录起始位点相重叠,一致序列为Py Py ANT/Apy Py,其功能与TATA 盒相似,能指导转录起始前复合物的装配、决定转录起始位点并调节上游激活蛋白的活性[4]。组织特异性启动子除了具有以上基本结构元件外,位于TATA 盒上游的一些特殊元件是决定其特异性调控的关键,以下分类概述了植物不同组织特异性启动子的结构特征于。
1.1 叶片特异性启动子结构特征
有关叶片特异性启动子结构元件的研究较少。Ye等[5]从水稻(Or yza sativa)中克隆了绿色组织特异表达基因的启动子PDX1,该启动子能够驱动GUS基因在绿色组织(如叶片、叶鞘和茎)中表达,同时发现该启动子包含两种顺式作用元件GSE1(CAGGACATATT ) 和 GSE2 (ATGAACTCAAAGAGCC),GSE1位于-71至-61 bp,GSE2位于+1至+16 bp。GSE1元件对于该启动子在所有绿色组织中的GUS 基因表达均有重要影响,而GSE2元件只在叶鞘和茎中发挥作用,且对于GUS基因表达影响较小。也有研究发现,在水杨酸(SA)调控下,玄参(Scrophul aria ningpoensis)花叶病毒启动子中的TGACG 元件能够增强该启动子在叶片中的活性[6]。另外,研究还发现一种重要的顺式作用元件L1盒(TAAATGCA),该元件在分生组织最外层表达的基因启动子中均有发现,对于该类启动子驱动下游基因特异表达发挥关键作用[7]。
1.2 维管组织特异性启动子结构特征
在菜豆(Phaseol us vul garis)GRP1.8启动子的研究中发现维管束特异性启动子元件vs-1(CATGCTCCGTTGGATGTGGAAGACAGCA),是转录激活因子蛋白VSF-1(C 端有一个碱性区及亮氨酸拉链结构-b ZIP基元序列)的结合序列[8]。当两者不能结合时,就会失去维管束特异性[8]。拟南芥(Ar abidopsis thaliana)proflin2维管束特异表达启动子的特异性区域表现在-1 667至-1 380 bp处,该区域中并没有vs-1或类似序列,只在-1 391至-1 388 bp及-565至-562 bp处各有一个ACGT序列,这可能影响该启动子的维管束特异性[9]。Freitas等[10]从大豆(Gl ycine max)中克隆了维管组织特异表达的蔗糖结合蛋白启动子GmSBP2,分析了该启动子不同区域对于驱动下游基因表达部位的影响,发现-1 236至-971 bp区域对于该基因在维管组织特异表达具有重要作用。对菜豆苯丙氨酸裂解酶2启动子PAL2的研究中发现,AC-Ⅰ(CCCACCTACC),AC-Ⅱ(CCACCAACCCCC),AC-Ⅲ(GTTAGGTTA)蛋白结合位点,其中AC-Ⅰ和AC-Ⅱ对于维管束特异性不可或缺[11]。
另外,维管组织中韧皮部特异性启动子结构元件的研究较为详细,其序列中存在一个有13个核苷酸的保守序 列T/ATAAGT/AACGAAT/CC/A,可能调控下游基因在韧皮部的特异表达[12],例如,椰子(Cocos nucif er a)腐叶病毒启动子中的ATAAGAACGAATC[13],水稻东格鲁杆状病毒启动子中的 TTAAGTACHAATC[14],竹 节 花(Dianthus chinensis)黄斑驳病毒启动子中的 ATAAGAACGAACA[15],毛根农杆菌RolC启动子中的TTAAGTACAGACA[16],豌豆(Pisum sativu m)谷氨酰胺合成酶启动子中的 ATAAGACAGAATC[17]。除此保守序列外,(GC)(GC)TATG 序列可能也影响启动子的韧皮部特异性及其活性,例如美洲黑杨(Popul us deltoides)树皮贮藏蛋白(BSP)和笋瓜(Cucur bita pepo)韧皮部蛋白2(PP2)启动子中的GCTATG,竹节花黄斑驳病毒启动子中的CGTATG[18]。另外,该类启动子具有组成型启动子顺式元件,例如竹节花黄斑病毒启动子中存在花椰菜花叶病毒35S启动子的激活序列(as-1),并含有类似该序列的TGACG 重复序列,但区别是该序列在两种启动子中的位置不同[18]。
1.3 根特异性启动子结构特征
ROOT MOTIFTAPOX1(ATATT)元件是根特异性启动子的基本元件[19]。研究发现,水稻根尖特异性启动子Os04g24469 的序列中存在7个与根系特异性密切相关的ROOT MOTIFTAPOX1 元件,其中5个的位置靠近启动子序列5’端,两个位于起始密码子上游500 bp内,并且推测该启动子区域内的一些抑制或者阻遏基因的顺式作用元件同时也影响着Os04g24469 启动子发挥作用[19]。番茄(Lycopersicon esculentu m)根特异性基因LeGRP2 的启动子中也包括9个ROOT MOTIFTAPOX1元件[20]。同时还发现,根特异性启动子中细胞分裂素相关元件的含量很高[21]。另外,根中不同区域特异性启动子也有各自特殊的调控元件,比如影响根毛特异性的RHES调控元件(CACG)[22],影响根冠特异性的AC序列[23]等。
1.4 花器官特异性启动子结构特征
矮牵牛(Petunia hybrida)花器官特异性启动子CHSA 受UV 诱导,其中包含顺式作用元件box2、box1、两个G-box、两个TACPy AT box、TATA box和cap site,-67至+1 bp区域影响该启动子在UV 诱导条件下发挥作用[24]。不同花器官特异性启动子的元件不同,例如,菜豆(Phaseol us vulgaris)MYBPLANT 基因启动子中花茎特异性元件MYBPLANT(MACCWA MC)[25];豌豆MYB26PS基因启动子中花蕾特异性元件MYB26PS(GTTAGGTT)[26]。
1.5 花粉特异性启动子结构特征
番茄花粉特异性启动子LAT52 存在两个PB(Pollen Box)核心基序(TGTGGTT),-71至+110 bp区域为调控花粉特异性的必需区域,-492 至-145 bp和-124至-86 bp区域可以增强该启动子驱动下游基因表达,但是真正影响其花粉特异性的顺式作用元件是位于TATA box 上游-72 至-52 bp的AGAAA 和TCCACCATA 序列[27]。玉米(Zea mays)花粉特异性启动子Zm13 中-314至+61 bp 区域是花粉特异性的关键区域,-84 至-53 bp区域也决定着花粉特异性,-260至-100 bp和-107至-102 bp区域可以增强该启动子驱动下游基因表达,其中TTTCT 序列影响其活性[28]。另外GTGA 序列也影响该类启动子的特异性[29]。
1.6 果实特异性启动子结构特征
由于果实特异性启动子调控的复杂性,对该启动子调控机理的研究不多,相关的顺式作用元件报道也较少[30]。Yamagata等[31]研究了甜瓜(Cucumis melo)cucumisin 基因启动子,发现在-254至-215 bp之间存在1 个嘧啶碱基回文结构TGTCACA,并证明该序列对于果实特异性十分必要。此外,西瓜(Citr ull us l anatus)果实特异性启动子AGPL1 中存在cis元件(TC/TCAAAA),其抑制外源基因在果实外表达,从而形成果实特异性[32]。
1.7 种子特异性启动子结构特征
RY 重复序列(CATGCATG)是种子特异性启动子驱动外源基因表达的重要元件,该序列常见于豆科和禾本科植物种子贮藏蛋白基因的上游调控区,能够调控下游基因的种子特异表达时间顺序[33]。另外,还存在其他与种子蛋白贮藏及驱动下游基因特异表达相关的结构元件,例如,A(G/C/A)CCCA 序 列[34],ACGT 盒[35];TACACAT 盒[36];E盒(CANNTG)[37]等(表1)。
2 植物组织特异性启动子的调控作用
2.1 叶片特异性启动子
叶片特异性启动子能在植物抵御逆境胁迫方面发挥重要作用。叶表皮蜡质能够阻止植物体内非气孔性水分散失[38],因此叶表皮特异性启动子对于植物抵御干旱胁迫具有重要意义。Sessions等[39]最早克隆了驱动下游基因在地上部表皮表达的拟南芥At ML1 启动子,该启动子能驱动CCT8 基因在叶片表皮细胞中表达[40]。另外,拟南芥At CER6启动子也是地上部表皮特异性启动子,其GUS活性在茎、叶表皮细胞均具有较高的表达[41]。Jiang等[42]用拟南芥At CER6 启动子驱动WXP1 表达的转基因紫花苜蓿(Medicago sativa)植株中发现,干旱条件下转基因植株比野生型植株有更高的相对含水量、叶片水势和蜡质含量,增加了植株的抗旱性。笔者课题组(兰州大学草地农业科技学院王锁民课题组)克隆了拟南芥At ML1、At CER6 和蒺藜苜蓿(M.tr uncatul a)Mt ML1 启动子,并通过农杆菌介导的烟草(Nicotiana tabacum)瞬时侵染和拟南芥花粉管通道转染验证其活性,拟构建ML1-Zx ABCG11(霸王蜡质转运蛋白)和CER6-Zx ABCG11 载体并转入Zx N HX-Zx VP1 共表达转基因紫花苜蓿,增加植物表皮蜡质从而提高转基因苜蓿的抗旱性。同时叶片特异性启动子也能够参与植株抵御重金属胁迫和病虫害侵袭[43]。植物通过产生一些有机分子从而降低重金属的毒害作用,由植物螯合肽合酶催化产生的植物低分子质量蛋白螯合肽通过一些金属(Ag、Cu、As、Hg 和Cd,其中Cd 是最有效的催化剂)诱导恢复活性状态,而Cd通常积累在植物叶片中[44]。Peterson和Oliver[43]将叶片特异性的水稻光系统Ⅱ叶绿素a/b 结合蛋白基因启动子(cab3)[45]与拟南芥螯合肽基因构建表达载体,并转入拟南芥Cd 敏感型突变体和野生型植株,研究表明,该启动子能使拟南芥螯合肽基因表达在叶片中,通过Cd催化发挥活性从而降低金属对植物的毒害作用。植物防御过程中还会产生其他次生代谢产物,如异黄酮。咖啡树(Cof f ea atr aica)异黄酮还原酶基因启动子CaIRL 在咖啡叶片机械损伤的情况下发挥活性,并驱动GUS 基因在叶片特异表达,然而该启动子在烟草中能在正常情况下发挥活性,说明该启动子在这两种植物中存在不同的调控机制,并且具有宿主专一性,同时,该启动子驱动异黄酮还原酶基因在咖啡叶片表达能够对其真菌感染和机械损伤产生相应响应[46]。
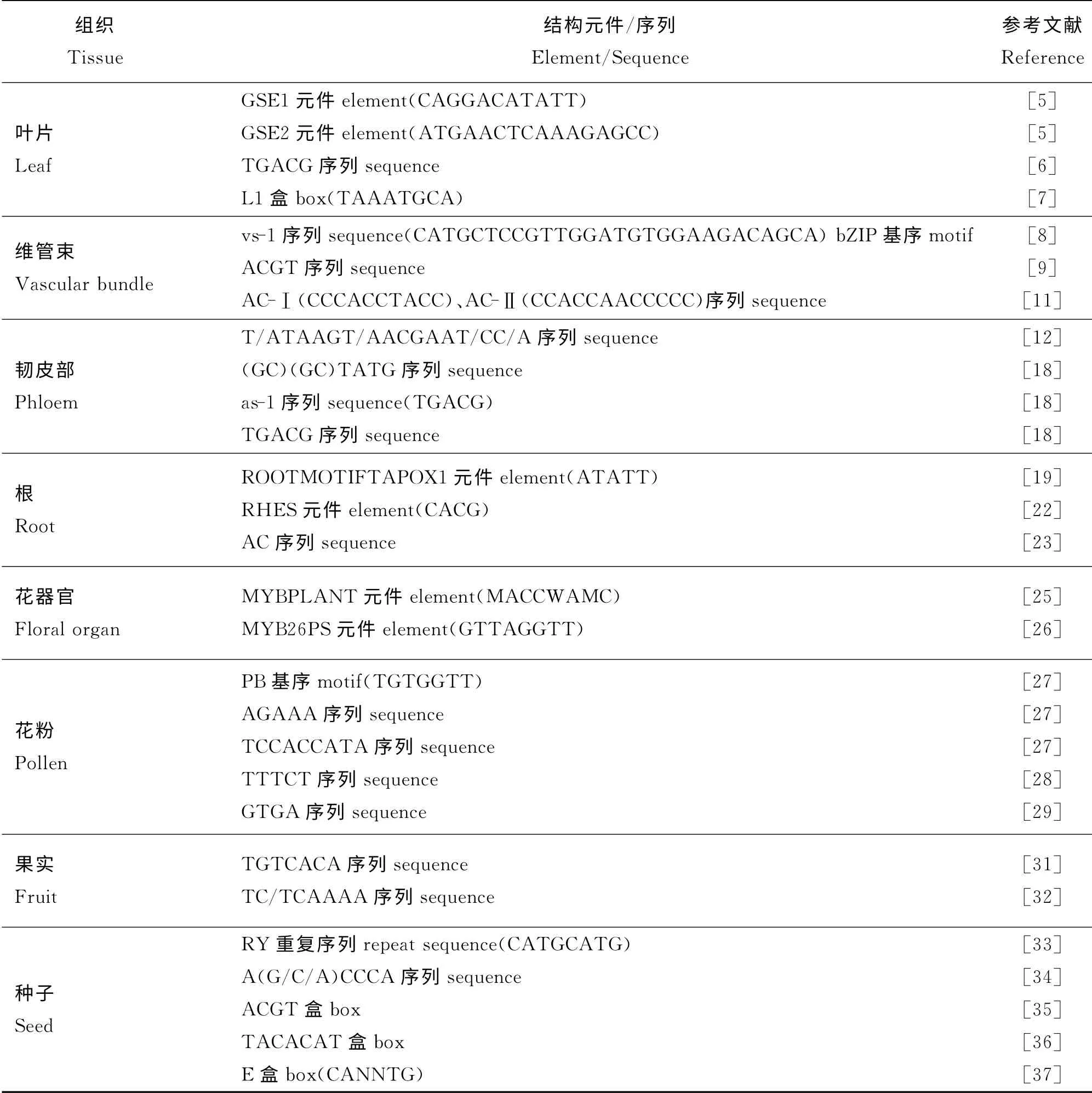
表1 组织特异性启动子结构元件Table 1 Elements of tissue-specific promoter
另一方面,该类启动子活性往往制约着基因工程的发展,因此研究其活性的影响因素尤为重要。叶片特异性启动子介导下游基因表达有时需要光调节,二磷酸核酮糖羧化酶是催化植物碳固定的重要酶类,并在植物体内表达量高,因此对其有多方面的研究。二磷酸核酮糖羧化酶有8 个大小亚基组成,其小亚基(SSU)的启动子使目的基因在叶片表达起到关键作用,Marraccini等[47]克隆了咖啡树二磷酸核酮糖羧化酶亚基叶片特异性启动子RBCS1,转基因烟草GUS染色发现光影响其活性,与此相类似的还有水稻光系统Ⅱ叶绿素a/b结合蛋白启动子CAB2-p[48]。同时,植物生长周期也影响该类启动子的活性。拟南芥赖氨酸合酶(DHS)启动子At DHS驱动GUS 基因在植物莲座叶和花药中表达,其活性随着莲座叶不同发育阶段而有所差异,且在5周龄时活性最强,花芽活性高于盛花期活性,因此该启动子在时间和空间上对植物的发育有至关重要的作用[49]。另外,叶片特异性启动子的活性也受其他诱导条件调节。核糖体失活蛋白(RIPs),例如麻疯树(Jatropha curcas)毒蛋白能使核糖体失活从而抑制蛋白质的生物合成,对于植物抗病毒和真菌侵袭并形成抵御系统有重要意义[50]。麻疯树毒蛋白Curcin-L CP2启动子能够驱动GUS 基因在转基因烟草的叶片中特异表达,并且在不同胁迫诱导条件,譬如脱落酸(ABA)、水杨酸、聚乙二醇(PEG)、4 或45 ℃和紫外灯下活性不同,其中以PEG 诱导活性最高[51]。除此之外,Stenzel等[52]研究了拟南芥丙二烯氧化物环化酶(AOC)多肽的4 个基因启动子AOC1、AOC2、AOC3、AOC4,其中AOC1、AOC2、AOC3 是叶片特异性启动子,其活性受茉莉酸诱导(表2)。
2.2 维管组织特异性启动子
植物维管组织由木质部和韧皮部组成,主要负责水分和营养物质的运输,因此,维管组织特异性启动子可能与营养物质吸收相关(表2)。Kovalchuk等[53]通过将小麦(Triticu m aestivu m)同源异型域-亮氨酸拉链蛋白基因启动子Td GL9 H1 与GUS 基因融合转入小麦、大豆和水稻的研究表明,该基因在小麦和大豆盾片的维管束中表达,并且表达活性高,说明他可能参与种子萌发与营养物质吸收。高木质素含量会对造纸工业产生不利影响,肉桂酰辅酶A 还原酶(CCR)和肉桂醇脱氢酶(CAD)能减少植物木质素合成,银合欢肉桂酰辅酶A 还原酶(LICCR)和肉桂醇脱氢酶(LICAD)基因启动子能驱动GUS 基因在转基因植株的木质化组织中大量表达,同时也观察到其在维管组织木质素含量的降低,因此该研究能够克服下调植物木质素含量的难题[54]。
另一方面,维管组织特异性启动子活性与逆境胁迫相关[55]。与植物抵御病菌相关的类萌芽素蛋白(GLPs)在植物体内普遍存在,将类萌芽素蛋白13基因启动子GLP13 与GUS 基因融合并转入拟南芥和烟草的研究表明,该基因在所有器官的韧皮部表达,并且两者无明显差别,同时该启动子包含病原体的相关元件,植物病害可能影响其活性[56]。茉莉酸(JA)是植物生长和逆境胁迫响应的重要信号,由丙二烯氧化物环化酶(AOC)催化形成,拟南芥丙二烯氧化物环化酶(AOC)多肽包括4 个基因启动子AOC1、AOC2、AOC3、AOC4,其中AOC4 能有效地驱动GUS 基因在叶脉和根维管束中特异表达,并且该启动子活性随着茉莉酸诱导增加[52]。另外,茉莉酸的生物活性分子茉莉酸甲酯也影响相关启动子的活性。番茄原系统素基因启动子SI PS 在转基因烟草的叶柄维管束具GUS特异表达活性,且活性受茉莉酸甲酯诱导,表明该启动子可能参与植物响应逆境胁迫[57]。此外,生长周期也参与该类启动子活性的调控。Saad等[58]从马伴草(Ael uropus littor alis)中克隆了锌脂蛋白Al SAP 基因启动子Pr Al-SAP,研究该启动子在盐、甘露醇、脱落酸和水杨酸处理下对植物不同生长阶段的影响,GUS染色研究表明,其活性随着器官生长发育增强;无胁迫诱导条件下,只在老叶叶脉和茎维管组织中具有活性,且非生物胁迫对活性有促进作用,是一种从顶部向基部发展并与年龄相关的表达模式,根与幼叶组织中没有活性,说明该启动子由转录后机制调控。
研究还发现,其他维管组织特异性启动子:拟南芥热激蛋白相关基因启动子Athspr与植物耐热性相关[59];大豆蔗糖结合蛋白启动子SPB2 与蔗糖吸收相关;桉树EGJFLV3247C08.g 启动子能够提高转基因桉树的纤维素含量,并能抵抗其内生病原菌[3](表2)。
2.3 根特异性启动子
植物依靠根系统固定和支撑,通过其吸收和运输土壤中的水分、养分并合成和贮藏营养物质,因此,根系对于植物生长发育有十分重要的作用。根特异性启动子在干旱响应、病虫害抵御、根系营养成分改善等方面有突出的应用价值[60]。植物水通道蛋白属于多基因家族内在蛋白(MIP),包括5种不同的亚家族,液泡膜内在水通道蛋白是其中一种,他们促进植物水分运输,并响应非生物胁迫[61]。桉树(Eucal yptus robusta)液泡膜内在水通道蛋白(TIP)启动子Eg TI P2 在渗透胁迫条件下表现出维管组织和根尖特异性,甘露醇正向调控其活性,而脱落酸相反,表明该启动子对于桉树适应干旱环境具有重要作用[62]。植物通过根吸收的营养物质主要包括磷和氮。在正常的自然条件下,土壤中硝态氮)的含量要显著高于铵态氮()的含量,因此,硝态氮在植物的生育周期中发挥着更为重要的作用[63]。高等植物中已发现的NO3-转运蛋白主要有NRT1和NRT2两个家族[64],Kong等[65]将百脉根(Lotus cor nicul atus)Lj NRT2 和拟南芥At-NRT2.1 启动子与GUS 基因融合后转入烟草的结果表明,二者在烟草根中均具有活性。几丁质合酶(NIC)能抑制真菌生长,该研究将这两个启动子与NIC 基因构建表达载体并将其转入烟草和番茄,表明转基因的烟草和番茄将NIC 蛋白积累在植物根部从而抵御根部尖孢镰刀菌,使植物正常生长,该研究为植物抑制土传真菌和细菌病原体提供一种重要策略[65]。山葵防御素(WD)也是一种真菌和细菌的抑制剂,Kong等[66]还将这两个启动子与WD 基因构建表达载体转入烟草和番茄中,转基因植物根系同样对尖孢镰刀菌有抵御作用。另外,通过研究木薯颗粒结合型淀粉合成酶启动子GBSSI,表明其活性在茎和根中,且在块状根中活性最高,该研究有助于提高植物块状根的营养物质含量[67]。豆科植物的固氮作用能够促进植物根系吸收营养,研究发现大豆血红蛋白Ibc3 启动子为固氮细菌提供营养需求,从而促进固氮作用[68]。
研究还发现其他根特异性启动子:拟南芥钙调蛋白相关基因CML43 启动子参与根吸收钙离子,并 受 水 杨 酸 诱 导[69];水 稻 Os03g01700 和Os02g37190 启动子调控目的基因在主根及次根中表达,根毛中不表达,且表达量高[70],与之类似的还有大豆根PCit1,9 启动子[71](表2)。
2.4 花特异性启动子
组成型启动子在花的某些特定部位活性较弱,研究花特异性启动子活性的强弱对当前生物技术的发展至关重要[72]。类黄酮及其衍生物参与花的着色,并显著影响花特异性启动子活性[73]。目前已经研究了类黄酮途径中的多种调控基因,并且多集中于类黄酮合酶[74]。类黄酮生物合成第一步反应需要查尔酮合酶(CHS)的参与,Liu 等[75]将 百 合(Liliu m brownii)查尔酮合酶启动子PLoCHS 与GUS 基因融合并转入矮牵牛(Petunia hybrida),发现该基因表达活性在花中最高,且表达主要集中在花药和柱头,子房、花瓣、花萼和花梗的活性相对较低,而叶和茎中几乎没有活性;此外,其活性随着花发育阶段而增强,且在盛花期达到最高。同时,花特异性启动子活性也受植物激素和逆境胁迫的影响。挥发性有机物(VOCs)参与调控植物花气味,主要包括3种化合物:脂肪族化合物、苯环型和苯丙酯类以及萜类化合物。其中萜类化合物的合成需要类萜合酶(TPSs)催化[76]。研究发现,花特异性的姜花(Hedychiu m cor onariu m)类萜合酶基因启动子Pr Hc TPS1 和Pr Hc TPS2 的活性在盛花期最高,且活性强弱与萜类化合物挥发相关,同时受昆虫、茉莉酸甲酯和伤口的显著诱导,该研究对园艺植物花气味的修饰有重要作用[76]。不同的是,某些与植物激素相关的启动子并不受激素或逆境胁迫影响,植物受体激酶(RLKs)是与植物生长调节、激素信号相关以及在生物、非生物胁迫下响应的关键蛋白,其中富含半胱氨酸受体激酶(CRKs)参与抵御植物病原体并调控细胞程序性死亡[77]。将番茄半胱氨酸受体激酶基因启动子Sl CRK1 与GUS 基因融合并转入番茄和拟南芥,该基因只在成熟花粉具表达活性,并且不受非生物胁迫或激素调控[78]。另外,温度也影响花特异性启动子的活性。水稻蔗糖转运基因启动子Os SUT4 能够驱动下游基因在萌芽和成熟的花粉以及花粉管中表达,并且高温条件比低温条件下活性高[79]。此外,为了得到更强活性的花特异性启动子,Du等[80]构建了4 种表达载体(p35S-PCHS-Ω、p35S-LCHS-Ω、p OCS-PCHS-Ω、p OCS-LCHS-Ω),其中包括烟草花叶病毒35S启动子或章鱼碱合酶启动子OCS 的增强子、矮牵牛或百合的查尔酮合酶启动子CHS 的核心区域以及Ω 元件,其中p OCS-PCHS-Ω 表达载体只在花冠处表现出强GUS活性,并培育出只在花冠显蓝的百合新品种,该研究对于花冠颜色的修饰有重要意义。
花的研究包括其颜色的改变,类黄酮类物质的次生代谢产物花青素能够使花表现出更多颜色,因而相比其他植物色素更为重要。花青素合酶(ANS)参与花青素合成的最后阶段,Li m 等[81]克隆了烟草花青素合酶基因启动子Nt ANS1,其活性部位只存在于花瓣的花冠缘,且活性高,该研究为应用基因工程改变花瓣颜色奠定基础。另外,Cook 和Thil mony[82]克隆了水稻成熟花粉精细胞Os GEX2启动子,其活性在转基因水稻花粉的精细胞中,其他组织和器官中没有活性(表2)。
2.5 果实、种子特异性启动子
外源蛋白在果实或者种子中表达是基因工程研究的关键,对于提高营养元素含量有重要意义。种子营养物质含量的积累是植物繁殖的基础,淀粉是种子中不可或缺的营养物质。二磷酸腺苷葡萄糖焦磷酸化酶(AGPase)是淀粉合成步骤中一种关键的酶,该酶由两个大亚基和两个小亚基组成,大小亚基分别由不同的基因编码,其中小亚基由Brittle2 基因编码[83]。Chen等[84]从玉米胚乳中克隆了Brittle2 基因启动子,将该启动子与玉米蛋白基因启动子Ze19[85]进行比较,发现他们均能驱动GUS 基因在烟草种子中特异表达,Ze19 基因启动子的活性高于Brittle2 基因启动子,且在种子发育过程中更早发挥作用,表明Ze19 基因启动子参与调控淀粉的早期合成。另外,该类启动子能够参与重金属毒害的抵御。金属硫因(MTs)是富含半胱氨酸的金属蛋白结合位点,与细胞生长调节、金属离子转运以及重金属毒害防御有关[86]。Kamaladini等[87]从油棕(El aeis guineensis)中克隆了启动子MT3-A,该启动子在150μmol·L-1Cu2+条件下能够驱动GUS基因在果实中高效表达,将MT3-A 启动子与金属硫因基因构建表达载体并转入番茄,发现转基因番茄幼苗的生长会对Cu2+产生响应,表明Cu2+条件下,MT3-A 启动子能够驱动金属硫因和植物螯合肽基因表达。该启动子能够提高植物抵御重金属胁迫的能力从而维持植物果实营养物质含量的稳定,也可能对缓解土壤及水资源的重金属毒害具有重要意义。
种子、果实特异性启动子对于植物品质特征提高有重要影响,种皮结构的修饰可以进一步提高种子质量。拟南芥种皮的表皮细胞分化具显著变化特征,包括大量厚纤维形成的次生细胞壁上果胶粘液的合成和分泌,这种变化对于研究细胞壁(尤其是果胶)的修饰有重要意义[88]。Esfandiari等[88]研究了种皮表达基因DIRIGENT PROTEI N1 启动子DP1,发现在转基因拟南芥中其活性主要集中于表皮的栅栏组织,欧洲油菜(Br assica napus)中也有类似表现,该启动子是高价值重组蛋白研究的重要工具。另外,提高果实、种子特异性启动子的活性是基因工程研究的重点。绿豆贮藏蛋白的90%是8S球蛋白,由3 个亚基组成,分别是8SGα、8SGα′和8SGβ[89]。Chen等[90]将绿豆(Vigna r adiata)种子特异性启动子8SGα 与GUS 基因融合的研究表明,该启动子活性比烟草花叶病毒35S启动子和8SGα′启动子活性高2~4倍,该启动子对于双子叶植物异源蛋白基因在种子中的表达有关键意义。落花生(Ar achis hypogaea)种子特异性启动子GSP 的研究也表现出活性高于烟草花叶病毒35S启动子,该研究有利于改善重要种子作物生态型[91]。油棕硬脂酰-酰基载体蛋白脱饱和酶启动子(Des)5′端缺失分析中发现,该启动子驱动GUS 基因在转基因番茄的果实、种子中特异表达,并且活性比烟草花叶病毒35S启动子高4倍,不同5′端缺失类型启动子驱动GUS 基因表达活性不同,其中Des3 类型活性最高,Des4 类型活性最低[92]。
除此以外,乙烯作为植物的天然激素,影响植物生长习性,促进果实成熟,并参与其衰老和脱落等,所以果实特异性启动子的研究离不开乙烯。研究者已经从番茄中克隆了与果实成熟相关的特异性启动子E4、E8、PG 和2 A11[93-94],其中E8 启动子发挥作用需要乙烯的参与。另外还有其他启动子的研究中发现含有与乙烯相关的结构元件,如小麦脱水蛋白基因启动子Td Cor410b[95]、水稻乙烯响应因子基
因启动子Os ERF4a[96]、葡萄(Vitis vinif er a)乙烯响应因子基因启动子Vv ERF3b[97]等,以上发现对于果实特异性启动子的进一步研究有重要意义。
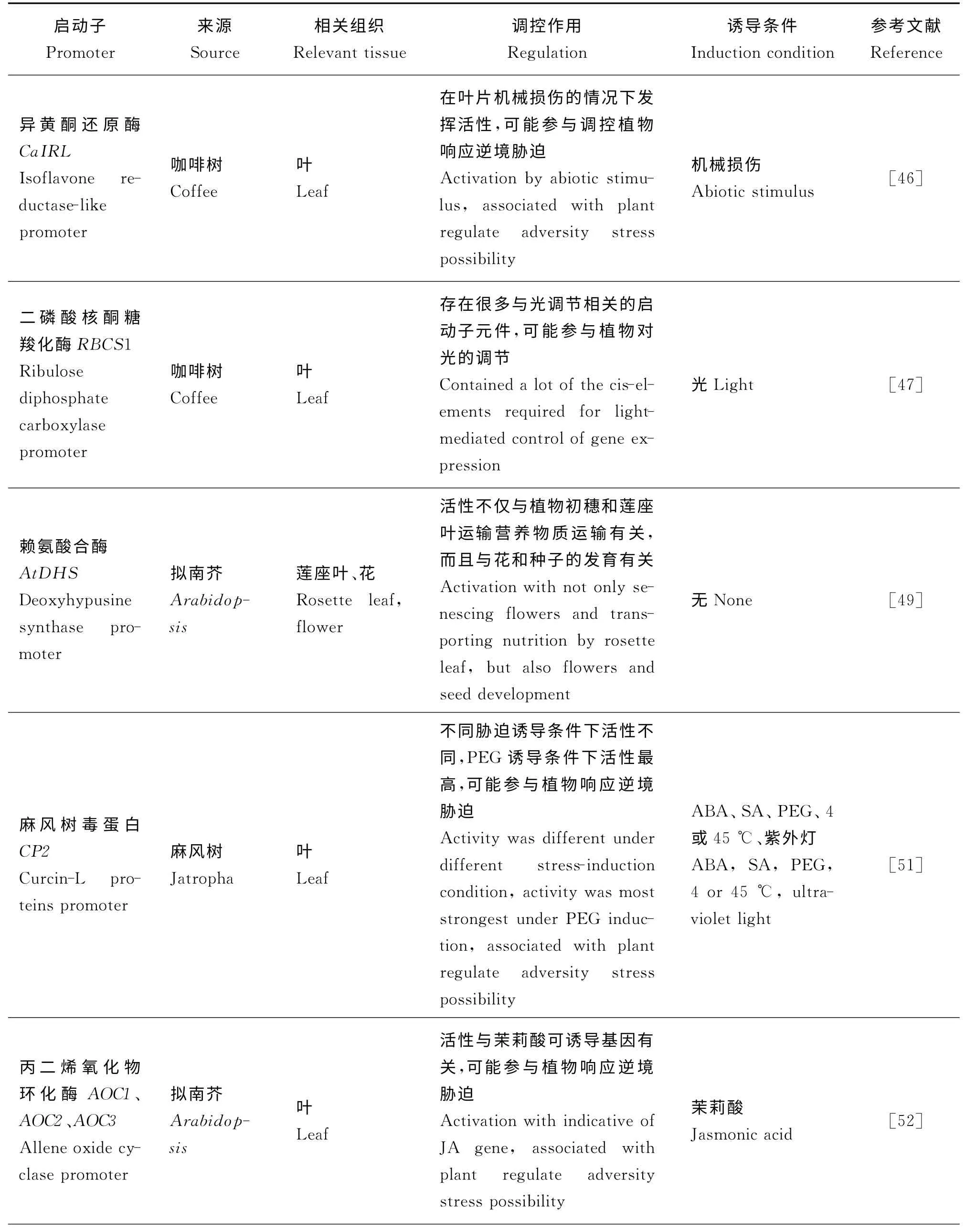
表2 组织特异性启动子的调控作用Table 2 Regulation of tissue-specific promoter
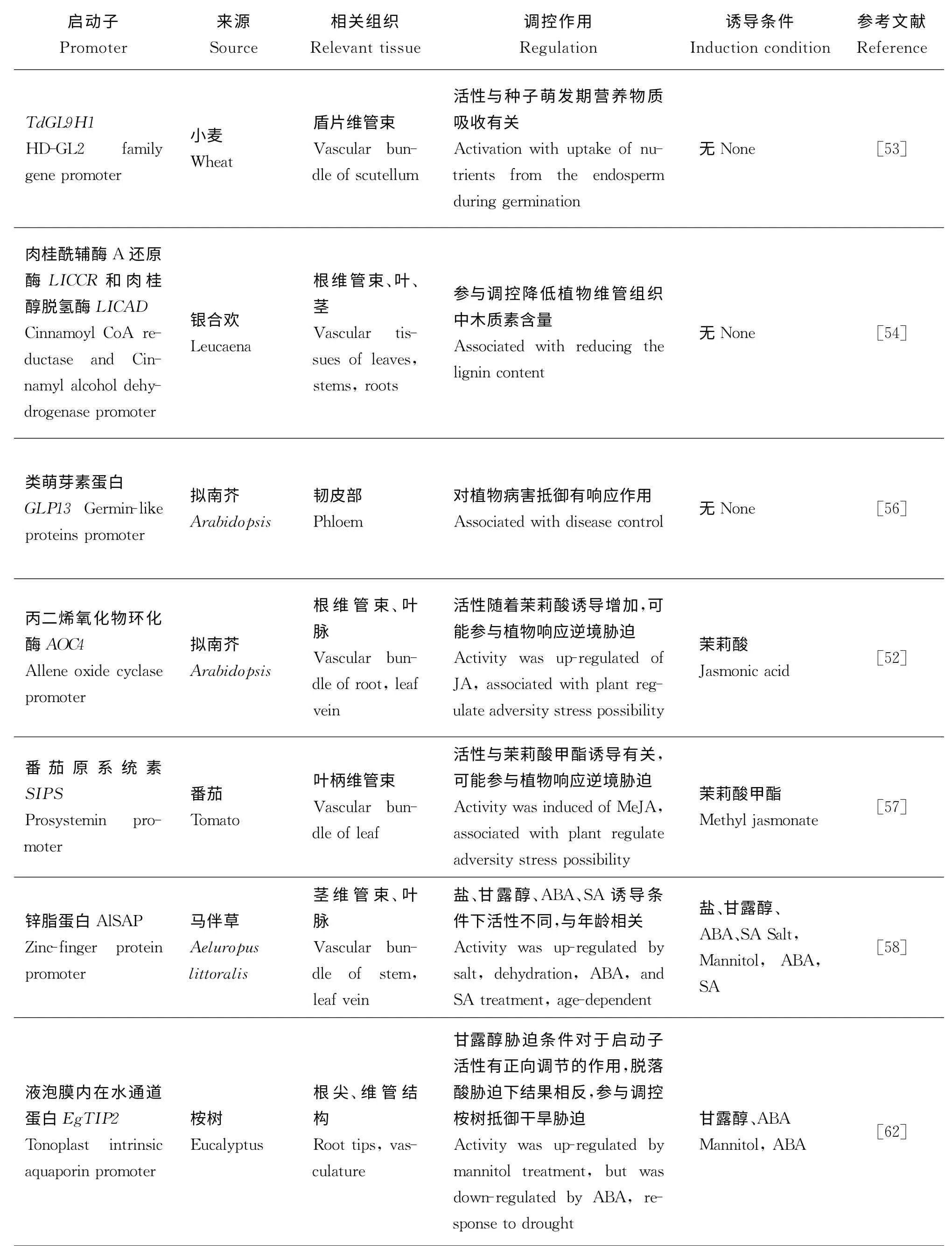
续表2(1)

续表2(2)

续表2(3)
3 展望
组织特异性启动子在植物生长、营养物质吸收、逆境响应和病虫害抵御等方面发挥着极其重要的作用,成为学术界研究的热点之一。大多数组织特异性启动子的研究只局限于克隆阶段,其调控机制尚有待深入研究,基于目前的研究现状,今后的研究可以从以下几个方面展开:1)从不同类型的植物中,选择具有代表性的植物,发掘更多特异性强、活性高的组织特异性启动子。2)在模式植物拟南芥和水稻中进一步分析其特异性及其活性强弱的调控机制。3)利用生物信息学方法优化启动子的鉴定过程,提前对组织特异性启动子特征有更清楚的了解。4)通过分子生物学技术和基因工程等手段,插入所需结构元件,以期得到特异性更强、活性更高的启动子,再将其与优良目的基因构建表达载体,实现启动子对外源基因的人工调控,更好地服务于生产。
致谢:该论文是第二届全国草业生物技术大会评选出的优秀论文,并得到中国草业生物技术专业委员会提供的版面费支持。
[1] 糜赛男,曹明富.植物组织特异性启动子的研究进展[J].生物学教学,2010(7):2-4.
[2] 贺红霞,陈亮,林春晶,柳青.组织特异性启动子在作物基因工程中的研究进展[J].中国农学通报,2014,30(9):225-231.
[3] Porto M S,Pinheiro M P N,Batista V G L,dos Santos R C,de Albuquerque M F P,de Li ma L M.Plant pro moters:An appr oach of str ucture and f unction[J].Molecular Biotechnology,2014,56(1):38-49.
[4] 朱玉贤,李毅,郑晓峰.现在分子生物学[M].第3版.北京:高等教育出版社,2007:68-77.
[5] Ye R,Zhou F,Lin Y.Two novel positive cis-regulatory elements involved in green tissue-specific promoter activity in rice(Or yza sativa L ssp.)[J].Plant Cell Reports,2012,31(7):1159-1172.
[6] Ku mar D,Patro S,Ghosh J,Das A,Maiti I B,Dey N.Develop ment of a salicylic acid inducible mini mal sub-geno mic transcript pro moter fro m Fig wort mosaic vir us with enhanced r oot-and leaf-activity using TGACG motif rearrangement[J].Gene,2012,503(1):36-47.
[7] Abe M,Takahashi T,Ko meda Y.Identification of a cis-regulator y element f or L1 layer-specific gene expression,which is targeted by an L1-specific homeodomain protein[J].The Plant Journal,2001,26(5):487-494.
[8] Keller B,Bau mgartner C.Vascular-specific expression of t he bean GRP1.8 gene is negatively regulated[J].The Plant Cell,1991,3(10):1051-1061.
[9] 刘昱辉,王志兴.拟南芥prof ilin2 启动子5′端缺失对维管束特异表达的影响[J].科学通报,2001,46(10):835-838.
[10] Freitas R L,Carvalho C M,Fietto L G,Loureiro M E,Al meida A M,Fontes E P.Distinct repressing modules on the distal region of the SBP2 promoter contribute to its vascular tissue-specific expression in different vegetative organs[J].Plant Molecular Biology,2007,65(5):603-614.
[11] Hatton D,Sablowski R,Yung M H,Smith C,Schuch W,Bevan M.Two classes of cis sequences contribute to tissue-specific expression of a PAL2 pr omoter in transgenic tobacco[J].The Plant Jour nal,1995,7(6):859-876.
[12] 张海利,吕淑霞,田颖川.韧皮部特异性启动子研究概述[J].中国生物工程杂志,2003,23(11):11-15.
[13] Hehn A,Rohde W.Characterization of cis-acting elements affecting strengt h and phloem specificity of the coconut f oliar decay virus promoter[J].Journal of General Virology,1998,79(6):1495-1499.
[14] Yin Y,Chen L,Beachy R.Pro moter elements required f or phloem-specific gene expression fr om the RTBV pro moter in rice[J].The Plant Jour nal,1997,12(5):1179-1188.
[15] Medberry S L,Olszewski N E.Identification of cis elements involved in Commelina yellow mottle vir us pr omoter activity[J].The Plant Journal,1993,3(4):619-626.
[16] Nilsson O,Little C A,Sandberg G,Olsson O.Expression of t wo heterologous pro moters,Agrobacteriu m r hizogenes r ol C and cauliflower mosaic virus 35S,in the stem of transgenic hybrid aspen plants during the annual cycle of growth and dor mancy[J].Plant Molecular Biology,1996,31(4):887-895.
[17] Brears T,Walker E L,Cor uzzi G M.A pr o moter sequence involved in cell-specific expression of t he pea gluta mine synthetase GS3A gene in organs of transgenic tobacco and alfalfa[J].The Plant Journal,1991,1(2):235-244.
[18] 袁正强,贾燕涛,吴家和.三个韧皮部特异性启动子在转基因烟草中表达的比较研究[J].农业生物技术学报,2002,10(1):6-9.
[19] 赵红玉,徐磊,魏溪涓,邓敏娟,王芳,易可可.一个新水稻根尖特异表达启动子的分离与鉴定[J].中国水稻科学,2014,28(4):351-357.
[20] 李志邈,杨悦俭,杨飞,叶青静,王荣青,阮美颖,姚祝平.番茄根特异表达基因Le GRP2 启动子的克隆及其在拟南芥的表达分析[J].中国农业科学,2010,43(9):1877-1882.
[21] Zhang T,Zhao X,Wang W,Huang L,Liu X,Zong Y,Li Z.Deep transcripto me sequencing of r hizo me and aerial-shoot in Sor ghu m pr opinquu m[J].Plant Molecular Biology,2014,84(3):315-327.
[22] Ki m D W,Lee S H,Choi S B,Won S K,Heo Y K,Cho M,Cho H T.Functional conservation of a root hair cell-specific cis-element in angiosper ms with different root hair distribution patterns[J].The Plant Cell,2006,18(11):2958-2970.
[23] Zhu Y,Wen F,Zhao X,Hawes M C.Isolation of the pro moter of a root cap expressed pectin met hylesterase gene fro m Pisu m sativum L.(rcp me1)and its use in the study of gene activity[J].Plant and Soil,2004,265(1-2):47-59.
[24] 张树珍,杨本鹏,刘飞虎.花特异表达启动子Pchs A 的克隆及其序列分析[J].农业生物技术学报,2002,10(2):116-119.
[25] Sablowski R W,Moyano E,Culianez-Macia F A,Schuch W,Martin C,Bevan M.A flower-specific Myb pr otein activates transcription of phenylpropanoid biosynthetic genes[J].The EMBO Journal,1994,13(1):128.
[26] Uimari A,Strommer J.Myb26:A MYB-like protein of pea flowers with affinity for promoters of phenylpropanoid genes[J].The Plant Jour nal,1997,12(6):1273-1284.
[27] Twell D,Yamaguchi J,Wing R A,Ushiba J,Mc Cor mick S.Promoter analysis of genes that are coordinately expressed during pollen develop ment reveals pollen-specific enhancer sequences and shared regulatory elements[J].Genes &Develop ment,1991,5(3):496-507.
[28] 陈泠.Tritor deu m 花粉特异性启动子的克隆与研究[D].武汉:华中科技大学硕士论文,2005.
[29] Rogers H J,Bate N,Co mbe J,Sullivan J Sweet man J,Swan C,Twell D.Functional analysis of cis-regulator y elements within the pro moter of the tobacco late pollen gene g10[J].Plant Molecular Biology,2001,45(5):577-585.
[30] 尹涛,张上隆,刘敬梅,陈大明.果实特异性启动子研究现状及其应用[J].农业生物技术学报,2009(2):355-360.
[31] Yamagata H,Yonesu K,Hirata A,Aizono Y.TGTCACA motif is a novel cis-regulatory enhancer element involved in fruit-specific expression of thecucumisin gene[J].Journal of Biological Chemistry,2002,277(13):11582-11590.
[32] 尹涛.西瓜AGPL1 启动子果实特异调控机理的研究及在番茄遗传转化中的应用[D].杭州:浙江大学博士论文,2008.
[33] Dickinson C D,Evans R P,Nielsen N C.RY repeats are conserved in the 5′-flanking regions of legume seed-protein genes[J].Nucleic Acids Research,1988,16(1):371-371.
[34] Chen Z L,Schuler M A,Beachy R N.Functional analysis of regulatory elements in a plant embryo-specific gene[J].Proceedings of the National Academy of Sciences,1986,83(22):8560-8564.
[35] Vincentz M,Leite A,Neshich G,Vriend G,Mattar C,Barros L,Gander E S.ACGT and vicilin core sequences in a promoter do main required for seed-specific expression of a 2Sstorage protein gene are recognized by the opaque-2 regulator y protein[J].Plant Molecular Biology,1997,34(6):879-889.
[36] Josefsson L G,Len man M,Ericson M L,Rask L.Str ucture of a gene encoding the 1.7S storage protein,napin,fro m Br assica napus[J].Jour nal of Biological Chemistr y,1987,262(25):12196-12201.
[37] Kawagoe Y,Murai N.A novel basic region/helix-loop-helix protein binds to a G-box motif CACGTG of the bean seed storage proteinβ-phaseolin gene[J].Plant Science,1996,116(1):47-57.
[38] Premachandra G S,Saneoka H,Fujita K,Ogata S.Leaf water relations,osmotic adjust ment,cell membrane stability,epicuticular wax load and growth as affected by increasing water deficits in Sor ghu m[J].Jour nal of Experi mental Botany,1992,43(257):1569-1576.
[39] Sessions A,Weigel D,Yanofsky M F.The Arabidopsis thaliana MERISTEM LAYER 1 promoter specifies epider mal expression in meristems and young primordia[J].The Plant Journal,1999,20(2):259-263.
[40] Xu X M,Wang J,Xuan Z,Goldsh midt A,Borrill PG,Hariharan N,Jackson D.Chaperonins facilitate KNOTTED1 cell-tocell trafficking and stem cell f unction[J].Science,2011,333:1141-1144.
[41] Hooker T S,Millar A A,Kunst L.Significance of the expression of the CER6 condensing enzy me f or cuticular wax production in Ar abidopsis[J].Plant Physiology,2002,129(4):1568-1580.
[42] Jiang Q Z,Zhang J Y,Guo X I,Maria J M,Wang Z Y.Physiological characterization of transgenic alfalfa(Medicago sativa)plants for i mproved drought tolerance[J].Inter national Jour nal of Plant Sciences,2009,170(8):969-978.
[43] Peterson A G,Oliver D J.Leaf-targeted phytochelatin synthase in Ar abidopsis thaliana[J].Plant Physiology and Biochemistry,2006,44(11):885-892.
[44] Clemens S,Kim E J,Neumann D,Schroeder J I.Tolerance to toxic metals by a gene family of Phytochelatin synthases fr om plants and yeast[J].The EMBO Jour nal,1999,18(12):3325-3333.
[45] Mitra A,Choi H K,An G.Structural and f unctional analyses of Arabidopsis thaliana chlorophyll a/b-binding protein(cab)pro moters[J].Plant Molecular Biology,1989,12(2):169-179.
[46] Brandalise M,Severino F E,Maluf M P,Maia I G.The pro moter of a gene encoding an isoflavone reductase-like pr otein in coffee(Cof f ea ar abica)drives a stress-responsive expression in leaves[J].Plant Cell Reports,2009,28(11):1699-1708.
[47] Marraccini P,Courjault C,Caillet V,Lepage B,Rogers W J,Tessereau S,Deshayes A.Rubisco s mall subunit of Coffea arabica:c DNA sequence,gene cloning and pro moter analysis in transgenic tobacco plants[J].Plant Physiology and Biochemistry,2003,41(1):17-25.
[48] Song G Q,Honda H,Yamaguchi K I.Expression of a rice chlorophyll a/b binding protein promoter in sweetpotato[J].Jour nal of the American Society f or Horticultural Science,2007,132(4):551-556.
[49] Duguay J,Jamal S,Liu Z,Wang T W,Thompson J E.Leaf-specific suppression of deoxyhypusine synthase in Arabidopsis thaliana enhances growth without negative pleiotropic effects[J].Journal of Plant Physiology,2007,164(4):408-420.
[50] Battelli M G.Cytotoxicity and toxicity to ani mals and hu mans of riboso me-inactivating proteins[J].Mini Reviews in Medicinal Chemistry,2004,4(5):513-521.
[51] Qin X,Zheng X,Shao C,Gao J,Jiang L,Zhu X,Chen F.Stress-induced curcin-L pro moter in leaves of Jatropha curcas L.and characterization in transgenic tobacco[J].Planta,2009,230(2):387-395.
[52] Stenzel I,Otto M,Delker C,Kir mse N,Sch midt D,Miersch O,Waster nack C.ALLENE OXI DE CYCLASE(AOC)gene family members of Ar abidopsis thaliana:Tissue-and organ-specific pro moter activities and in vivo hetero merization[J].Jour nal of Experi mental Botany,2012,63(17):6125-6138.
[53] Kovalchuk N,Wu W,Eini O,Bazanova N,Pallotta M,Shirley N,Lopato S.The scutellar vascular bundle-specific pr o moter of the wheat HD-Zip IV transcription factor shows si milar spatial and temporal activity in transgenic wheat,barley and rice[J].Plant Biotechnology Journal,2012,10(1):43-53.
[54] Prashant S,Sunita M S L,Sirisha V L,Bhaskar V V,Rao A M,Narasu M L,Kishor P K.Isolation of cinnamoyl Co A reductase and cinnamyl alcohol dehydrogenase gene promoters from Leucaena leucocephal a,a legu minous tree species,and characterization of tissue-specific activity in transgenic tobacco[J].Plant Cell,Tissue and Organ Culture(PCTOC),2012,108(3):421-436.
[55] Beneteau J,Renard D,MarchéL,Douville E,Lavenant L,RahbéY,Dinant S.Binding properties of the N-acetylglucosamine and high-mannose N-glycan PP2-A1 phloem lectin in Arabidopsis[J].Plant Physiology,2010,153(3):1345-1361.
[56] Yang L,Li T,Zhang S C,Gao G L,Yang C W.Characterization of the GLP13 gene pro moter in Ar abidopsis thaliana[J].Biologia Plantar u m,2013,57(2):231-237.
[57] Avilés-Ar naut H,Délano-Frier J P.Characterization of the tomato prosystemin pro moter:Organ-specific expression,hormone specificity and methyl jas monate responsiveness by deletion analysis in transgenic tobacco plants[J].Jour nal of Integrative Plant Biology,2012,54(1):15-32.
[58] Saad R B,Ro mdhan W B,Zouari N,Azaza J,Mieulet D,Ver deil J L,Hassairi A.Pro moter of the Al SAP gene fro m the halophyte grass Ael uropus littoralis directs develop mental-regulated,stress-inducible,and organ-specific gene expression in transgenic tobacco[J].Transgenic Research,2011,20(5):1003-1018.
[59] Zhang L,Yang T,Li X,Hao H,Xu S,Cheng W,Sun Y,Wang C.Cloning and characterization of a novel Athspr promoter specifically active in vascular tissue[J].Plant Physiology Biochem,2014,78(5):88-96.
[60] 王春燕,王孝坤,李巧玲,谢成建,杨星勇.根特异性启动子的种类和功能[J].生物技术通报,2013,1(5):15-21.
[61] Maurel C,Verdoucq L,Luu D T,Santoni V.Plant aquaporins:Membrane channels with multiple integrated f unctions[J].Annual Review of Plant Biology,2008,59:595-624.
[62] Rodrigues M I,Bravo J P,Sassaki F T,Severino F E,Maia I G.The tonoplast intrinsic aquaporin(TIP)subfamily of Eucal yptus gr andis:Characterization of Eg TIP2,a r oot-specific and osmotic stress-responsive gene[J].Plant Science,2013,213:106-113.
[63] Fan X,Jia L,Li Y,Smith S J,Miller A J,Shen Q.Co mparing nitrate storage and remobilization in t wo rice cultivars t hat differ in their nitr ogen use efficiency[J].Jour nal of Experi mental Botany,2007,58(7):1729-1740.
[64] Crawf ord N M,Glass A D.Molecular and physiological aspects of nitrate uptake in plants[J].Trends in Plant Science,1998,3(10):389-395.
[65] Kong K,Makabe S,Ntui V O,Khan R S,Nakamura I.Synt hetic chitinase gene driven by root-specific Lj NRT2 and At-NRT2.1 promoters confers resistance to Fusarium oxyspor um in transgenic tobacco and tomato[J].Plant Biotechnology Reports,2014,8(2):151-159.
[66] Kong K,Ntui V O,Makabe S,Khan R S,Mii M,Nakamura I.Transgenic tobacco and to mato plants expressing Wasabi defensin genes driven by root-specific Lj NRT2 and At NRT2.1 pro moters confer resistance against Fusarium oxyspor u m[J].Plant Biotechnology,2014,31(2):89-96.
[67] Koehorst-van Putten H J,Wolters A M A,Pereira-Bertram I M,van den Berg H H,van der Krol A R,Visser R G.Cloning and characterization of a tuberous root-specific pro moter fro m cassava(Manihot esculenta Crantz)[J].Planta,2012,236(6):1955-1965.
[68] Ramlov K B,Laursen N B,Stougaard J.Site-directed mutagenesis of the organ-specific element in the soybean leghemoglobin Ibc3 gene pr omoter[J].The Plant Jour nal,1993,4(3):577-580.
[69] Bender K W,Dobney S,Oqunrinde A,Chiasson D,Mullen R T,Teresinski H J,Singh P,Munro K,Smith S P,Snedden W A.The cal modulin-like protein CML43 f unctions as a salicylic-acid-inducible root-specific Ca2+sensor in Arabidopsis[J].Biochemical Jour nal,2014,457:127-136.
[70] Li Y Y,Liu S J,Yu Z M,Liu Y,Wu P.Isolation and characterization of t wo novel root-specific promoters in rice(Or yza sativa L.)[J].Plant Science,2013,207:37-44.
[71] Santana R H.Isolamento e caracterização de pro motoresórgão-específicos de plantas de soja(Gl ycine max)[D].Dissertação Brasilia-DF:Universidade de Brasília,2012.
[72] 杨丽.百合查尔酮合成酶基因(CHS)及其启动子的克隆与分析[D].杨凌:西北农林科技大学硕士论文,2006.
[73] Tanaka Y,Katsu moto Y,Br ugliera F,Mason J.Genetic engineering in floriculture[J].Plant Cell,Tissue and Organ Culture,2005,80(1):1-24.
[74] Koes R E,Spelt C E,Mol J N.The chalcone synthase multigene family of Petunia hybrida(V30):Differential,light-regulated expression during flower develop ment and UV light induction[J].Plant Molecular Biology,1989,12(2):213-225.
[75] Liu Y,Lou Q,Xu W,Xin Y,Bassett C,Wang Y.Characterization of a chalcone synthase(CHS)flower-specific pro moter from Lilium orential‘Sorbonne’[J].Plant Cell Reports,2011,30(12):2187-2194.
[76] Li X Y,Zheng S Y,Yu R C,Fan Y P.Promoters of Hc TPS1 and Hc TPS2 genes from Hedychium coronarium direct floral-specific,develop mental-regulated and stress-inducible gene expression in transgenic tobacco[J].Plant Molecular Biology Reporter,2014:1-17.
[77] Shiu S H,Bleecker A B.Receptor-like kinases fro m Ar abidopsis for m a monophyletic gene family related to ani mal receptor kinases[J].Proceedings of the National Academy of Sciences,2001,98(19):10763-10768.
[78] Ki m W B,Yi S Y,Oh S K,Li m C J,Ki m H A,Jang H A,Kwon S Y.Identification of a pollen-specific gene,Sl CRK1(RFK2)in to mato[J].Genes &Genomics,2014,36(3):303-311.
[79] Chung P,Hsiao H H,Chen H J,Chang C W,Wang S J.Influence of temperat ure on the expression of the rice sucrose transporter 4 gene,OsSUT4,in ger minating embr yos and maturing pollen[J].Acta Physiologiae Plantar u m,2014,36(1):217-229.
[80] Du L,Lou Q,Zhang X,Jiao S,Liu Y,Wang Y.Construction of flower-specific chimeric promoters and analysis of their activities in transgenic torenia[J].Plant Molecular Biology Reporter,2014,32(1):234-245.
[81] Li m S H,Kim J K,Lee J Y,Kim Y M,Sohn S H,Kim D H,Ha S H.Petal-specific activity of the promoter of an anthocyanidin synthase gene of tobacco(Nicotiana tabacum L.)[J].Plant Cell,Tissue and Organ Culture(PCTOC),2013,114(3):373-383.
[82] Cook M,Thil mony R.The OsGEX2 gene promoter confers sper m cell expression in transgenic rice[J].Plant Molecular Biology Reporter,2012,30(5):1138-1148.
[83] Cross J M,Clancy M,Shaw J R,Greene T W,Schmidt R R,Okita T W,Hannah L C.Both subunits of ADP-glucose pyrophosphor ylase are regulatory[J].Plant Physiology,2004,135(1):137-144.
[84] Chen X,Wang Z,Wang J,Wang M,Zhao L,Wang G.Isolation and characterization of Brittle2 pro moter fro m Zea mays and its co mparison with Ze19 pro moter in transgenic tobacco plants[J].Plant Cell,Tissue and Organ Culture,2007,88(1):11-20.
[85] Quattrocchio F,Tolk M A,Coraggio I,Mol J N,Viotti A,Koes R E.The maize zein gene z E19 contains t wo distinct promoters which are independently activated in endosper m and anthers of transgenic Petunia plants[J].Plant Molecular Biology,1990,15(1):81-93.
[86] Cobbett C,Goldsbrough P.Phytochelatins and metallothioneins:Roles in heavy metal detoxification and ho meostasis[J].Annual Review of Plant Biology,2002,53(1):159-182.
[87] Kamaladini H,Nor Ak mar Abdullah S,Aziz M A,Ismail I B,Haddadi F.Breaking-off tissue specific activity of the oil pal m metallothionein-like gene promoter in T1 seedlings of tomato exposed to metal ions[J].Journal of Plant Physiology,2013,170(3):346-354.
[88] Esfandiari E,Jin Z,Abdeen A,Griffit hs J S,Wester n T L,Haughn G W.Identification and analysis of an outer-seed-coatspecific pro moter fr om Ar abidopsis thaliana[J].Plant Molecular Biology,2013,81(1-2):93-104.
[89] Bernardo A E N,Garcia R N,Adachi M,Angeles J G C,Kaga A,Ishimoto M,Tecson-Mendoza EM.8Sglobulin of mungbean[Vigna r adiata(L.)Wilczek]:Cloning and characterization of its c DNA isof or ms,expression in Escherichia coli,purification,and crystallization of the major reco mbinant 8S isofor m[J].Jour nal of Agricultural and Food Chemistry,2004,52(9):2552-2560.
[90] Chen M X,Yang Y N,Zheng S X,Xu C,Wang Y,Liu J S,Li H Y.A vigna radiata 8S globulinα′pro moter drives efficient expression of GUS in Arabidopsis cotyledonary embryos[J].Journal of Agricultural and Food Chemistry,2013,61(26):6423-6429.
[91] Sunkara S,Bhatnagar-Mathur P,Shar ma K K.Isolation and f unctional characterization of a novel seed-specific pro moter region fro m peanut[J].Applied Biochemistr y and Biotechnology,2014,172(1):325-339.
[92] Saed Taha R,Ismail I,Zainal Z,Abdullah S N A.The stearoyl-acyl-carrier-protein desaturase promoter(Des)from oil pal m confers fruit-specific GUS expression in transgenic tomato[J].Journal of Plant Physiology,2012,169(13):1290-1300.
[93] Montgomery J,Gold man S,Deik man J,Margossian L,Fischer R L.Identification of an ethylene-responsive region in the pro moter of a fr uit ripening gene[J].Proceedings of the National Academy of Sciences,1993,90(13):5939-5943.
[94] Deik man J,Xu R,Kneissl M L,Ciardi JA,Ki m K N,Pelah D.Separation of cis elements responsive to ethylene,fr uit develop ment,and ripening in the 5′-flanking region of the ripening-related E8 gene[J].Plant Molecular Biology,1998,37(6):1001-1011.
[95] Eini O,Yang N,Pyvovarenko T,Pill man K,Bazanova N,Tikhomirov N,Lopato S.Complex regulation by Apetala2 domain-containing transcription factors revealed t hrough analysis of the stress-responsive Td Cor410b pro moter fro m dur u m wheat[J].PloS One,2013,8(3):e58713.
[96] Joo J,Choi H J,Lee Y H,Ki m Y K,Song S I.A transcriptional repressor of the ERF family confers drought tolerance to rice and regulates genes preferentially located on chromosome 11[J].Planta,2013,238(1):155-170.
[97] Song Y,Lin Y,Tong S,Hou H.Molecular cloning,promoter analysis,and expression profile of Vv ERF 3b gene in Vitis vinif er a[J].Biologia Plantar u m,2012,56(1):31-36.
