PEG 引发对燕麦老化种子萌发与幼苗生长的影响
2015-04-08夏方山闫慧芳毛培胜王明亚郑慧敏陈泉竹
夏方山,闫慧芳,毛培胜,王明亚,郑慧敏,陈泉竹
(中国农业大学动物科技学院,草业科学北京市重点实验室,北京100193)
种子萌发及幼苗建成是植物生命周期的关键时期,尤以幼苗建成对外界环境因子反应最为敏感[1]。然而,贮藏过程中种子老化总是或快或慢的发生,这不仅会降低种子活力,还会延缓其幼苗生长[2]。PEG用于渗透调节处理是目前种子生物学研究的热点,并被证明可以修复老化损伤,已在紫苏(Perilla f r utescens)[3]、向日葵(Helianthus annuus)[4]、毛地黄(Digitalis pur purea)[5]、小麦(Triticum aestivum)[6]、大豆(Glycine max)[7]、穿 心 莲(Andrographis paniculata)[8]、茎 瘤 芥(Br assica j unceavar)[9]、蔓 性 千 斤 拔(Moghania philippinensis)[10]及 油 菜(Brassica campestris)[11]等植物老化种子中有报道,但对这些老化种子萌发及幼苗生长的研究主要集中在发芽率、发芽势、发芽指数及幼苗活力指数等方面,而PEG 引发对老化种子幼苗根和芽生长的影响研究却很少,尤其针对PEG引发对超干种子老化后的影响研究仍然空白。然而,超干贮藏以其经济、便捷的优点成为保护植物种质资源、维持物种遗传稳定性的有效方法,并越来越受到研究者的重视[12]。因此,研究PEG 引发对超干种子老化后幼苗生长的影响具有重要的理论和实践意义。
燕麦(Avena sativa)具有耐瘠薄、耐盐碱、抗旱、耐寒等优良特性,是一种低碳环保的传统粮食和优质饲料。燕麦籽实富含对人类健康至关重要的均衡蛋白质、可溶性膳食纤维β-葡聚糖、不饱和脂肪酸、维生素及矿物质等[13]。因此,试验以超干燕麦种子为材料,研究不同PEG 渗透势及引发时间对老化种子幼苗根和芽生长的影响,以期为PEG 引发应用于农业生产提供理论基础。
1 材料与方法
1.1 材料来源
供试材料由中国农业大学牧草种子实验室提供,2009年收集于河北省张家口市沽源牧场,试验于2014年进行。燕麦种子自然含水量为9.8%,发芽试验显示,正常种苗数为89%,不正常种苗数为5%,死种子数为6%。
1.2 含水量的测定
准确称取4.5 g燕麦种子,放入样品盒中称重(精确到0.001 g),设两次重复。称取后保持样品盒开启,放入130~133 ℃烘箱内烘干1 h,烘干后取出,盖好盒盖,放入干燥器里冷却30 min,按公式计算含水量:
种子含水量=(M2-M3)/(M2-M1)×100%.式中,M1,样品盒和盖的重量(g);M2,样品盒、盖及样品的烘前重量(g);M3,样品盒、盖及样品的烘后重量(g)。
1.3 超干处理
称量种子初始重量,并将其放置于装有变色硅胶的干燥器内,反复称重,当种子达到所需重量时(即种子含水量为4%,鲜重),立即密封于12 c m×17 c m 的锡箔袋中,每袋大约20 g燕麦种子,然后放入4 ℃冰箱备用。
1.4 老化及PEG 引发处理
将装有种子的锡箔袋(即调整好含水量的燕麦种子)放于45 ℃恒温水浴箱控制劣变48 d,每个处理重复4 次。将老化种子用不同渗透势的PEG-6000(0、-0.3、-0.6、-0.9和-1.2 MPa对应的浓度分别为0、14.9%、22.3%、27.9%和32.6%)分别处理0(CK)、3、6 和12 h,蒸馏水冲洗两次,用滤纸吸干表层水分,然后25 ℃室内风干。
1.5 发芽试验及指标测定
参照国际种子检验协会(ISTA)的种子检验规程(2013)[14]规定的发芽条件。选取均匀饱满的种子100粒放入发芽盘(11.5×11.5 c m2)中,设4次重复,在20℃恒温条件下培养。培养到第5天初次计数,第10天末次计数,最终统计正常种苗数,并用直尺测量所有正常种苗的根和芽长度,以其平均值作为根长和芽长。然后分别用滤纸吸干全部根和芽表面的水分,并迅速用分析天平称量其鲜重,作为根鲜重和芽鲜重。
1.6 数据处理与统计分析
试验数据通过Excel 2010和SAS 8.0 统计分析软件处理,多重比较采用Duncans法进行,结果以平均值±标准误表示。
2 结果与分析
2.1 PEG 引发对燕麦老化种子发芽率的影响
引发3 h后燕麦老化种子发芽率随着PEG 渗透势降低呈先降后升的趋势(表1),在渗透势为-0.3 MPa时显著小于其他PEG 渗透势下的发芽率(P<0.05),在渗透势为-0.9和-1.2 MPa时达到最大值;引发6 h后其发芽率不断升高,在渗透势为-1.2 MPa时显著高于0、-0.3和-0.6 MPa;引发12 h后其发芽率呈先降后升的趋势,在渗透势为0、-0.3和-0.6 MPa时发芽率显著小于-1.2 MPa渗透势下的。PEG 渗透势为0时,引发6 h后发芽率显著小于CK;渗透势为-0.3 MPa时,引发3 h后发芽率显著小于CK;渗透势为-0.6、-0.9和-1.2 MPa时,各引发时间间发芽率差异不显著(P>0.05)。双因素方差分析结果表明(表2),引发时间对燕麦老化种子发芽率的影响差异显著(P<0.05),PEG渗透势及其与引发时间的交互作用对燕麦老化种子发芽率的影响极显著(P<0.01)。

表1 PEG 引发下燕麦老化种子发芽率的变化Table 1 Changes of ger mination percentage in aged oat seeds pri ming with PEG %
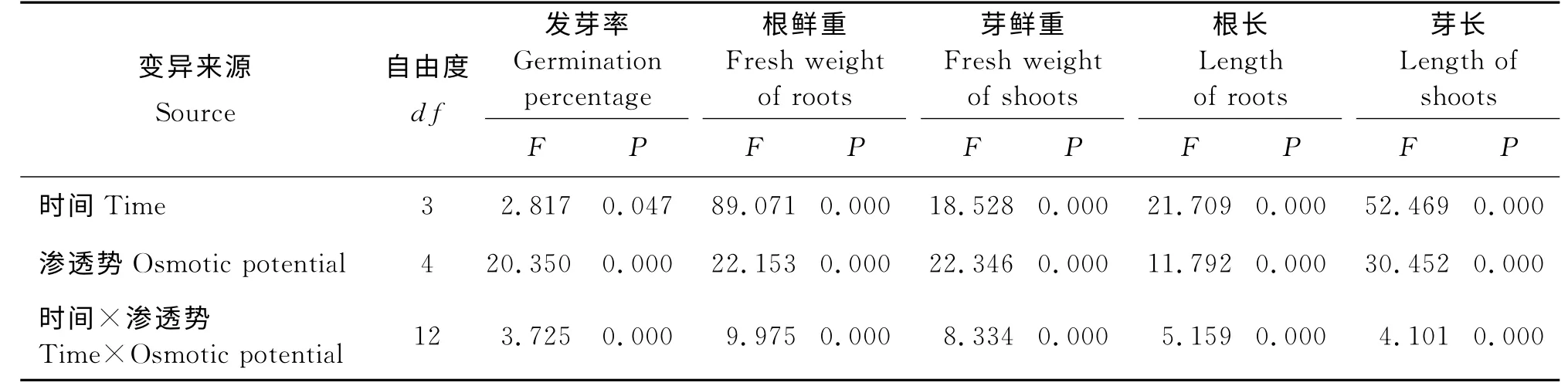
表2 PEG 引发时间和渗透势对燕麦老化种子发芽及幼苗生长影响的双因素方差分析Table 2 Variance analysis of PEG osmotic potential and pri ming ti me on aged oat seed ger mination and seedlings growth
2.2 PEG 引发对燕麦老化种子幼苗根鲜重的影响
引发3和12 h后燕麦老化种子幼苗根鲜重随着PEG 渗透势降低呈先减后增的趋势(表3),引发3 h后,在渗透势为0、-0.3、-0.6和-0.9 MPa之间差异不显著(P>0.05),而渗透势为-1.2 MPa时显著大于渗透势为-0.3~-0.9 MPa时(P<0.05);引发6 h 后其幼苗根鲜重呈先增后减的趋势,在渗透势为-0.9 MPa时显著大于其他渗透势引发下的根鲜重,而渗透势为0时显著小于其他渗透势引发下的根鲜重;引发12 h后渗透势为-1.2 MPa时显著大于其他渗透势引发的。PEG 渗透势为0时,随着引发时间的延长,幼苗根鲜重呈先减后增的趋势,在引发6 h时显著小于其他引发时间,而CK 则显著大于其他引发时间;渗透势为-0.3和-0.6 MPa时,引发3~12 h之间幼苗根鲜重差异不显著,但均显著小于CK;渗透势为-1.2 MPa时,随引发时间延长幼苗根鲜重呈先减后增的趋势,渗透势在-0.9和-1.2 MPa时,引发12 h时与CK间差异不显著(P>0.05)。双因素方差分析结果表明(表2),PEG 渗透势、引发时间以及两者之间的交互作用对燕麦老化种子幼苗根鲜重的影响极显著(P<0.01)。
2.3 PEG 引发对燕麦老化种子幼苗芽鲜重的影响
引发3 h后燕麦老化种子幼苗芽鲜重在渗透势为-0.3~-1.2 MPa时均显著高于0时(表4);引发6 h后其幼苗芽鲜重则呈先增后减的趋势,在渗透势为0时显著小于其他渗透势引发下的芽鲜重(P<0.05),而在渗透势为-0.9 MPa显著大于其他渗透势下的;引发12 h 后其幼苗芽鲜重不断增加,在渗透势为-1.2 MPa时显著大于其他渗透势下的芽鲜重,但渗透势为0、-0.3和-0.6 MPa之间差异不显著(P>0.05)。PEG 渗透势为0和-0.6 MPa时,引发3~12 h 后幼苗芽鲜重均显著小于CK(P<0.05);渗透势为-0.3 MPa时幼苗芽鲜重呈下降趋势,CK 显著大于引发3~12 h(P<0.05),而引发12 h则显著小于其他引发时间(P<0.05);渗透势为-0.9 MPa时幼苗芽鲜重随引发时间延长呈先增后减的趋势,引发6 h显著大于CK,而引发12 h显著小于CK;渗透势为-1.2 MPa时幼苗芽鲜重呈先减后增的趋势,引发12 h显著大于引发3和6 h,但与CK 间差异不显著。双因素方差分析结果表明(表2),PEG 渗透势、引发时间以及两者之间的交互作用对燕麦老化种子幼苗芽鲜重的影响极显著(P<0.01)。
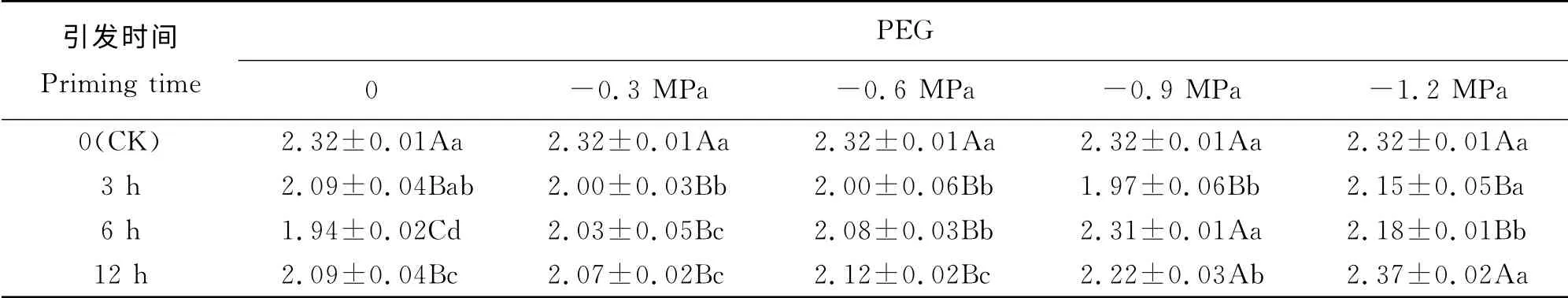
表3 PEG 引发下燕麦老化种子幼苗根鲜重的变化Table 3 Changes in fresh weight of roots for aged oat seeds priming with PEG g
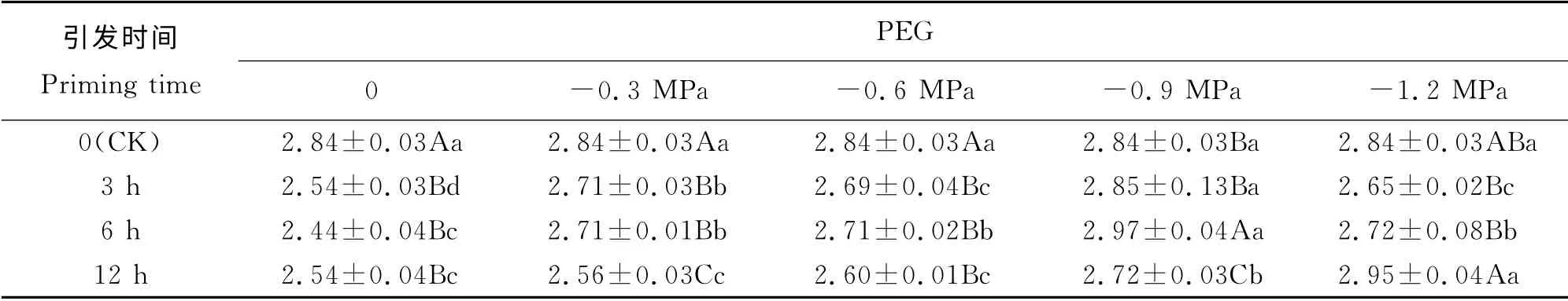
表4 PEG 引发下燕麦种子老化幼苗芽鲜重的变化Table 4 Changes in fresh weight of shoots for aged oat seeds priming with PEG g
2.4 PEG 引发对燕麦老化种子幼苗根长的影响
引发3 h后燕麦老化种子幼苗根长随着PEG渗透势降低呈先增后减的趋势(表5),在渗透势为-0.3、-0.6和-0.9 Mpa下的根长差异不显著(P>0.05),但-0.6 和-0.9 MPa(P<0.05)时显著大于0和-1.2 Mpa时的幼苗根长;引发6 h后也呈先增后减的趋势,在渗透势为-0.3 MPa时显著大于其他渗透势下的根长,而在渗透势为-1.2 MPa时显著小于-0.3~-0.9 Mpa下的根长;引发12 h后幼苗根长呈下降趋势,在渗透势为-1.2 MPa时显著小于其他渗透势下的根长。PEG 渗透势为0时幼苗根长随引发时间延长而增加,CK 显著小于其他引发时间,引发12 h时显著大于其他引发时间;渗透势为-0.3 MPa时幼苗根长呈先增后减的趋势,CK 显著小于其他引发时间,但引发6和12 h幼苗根相对较长,且差异不显著;渗透势为-0.6、-0.9和-1.2 MPa时幼苗根长也呈先增后减的趋势,并均在引发3 h时显著大于其他引发时间。双因素方差分析结果表明(表2),PEG 渗透势、引发时间以及两者之间的交互作用对燕麦老化种子幼苗根长的影响极显著(P<0.01)。
2.5 PEG 引发对燕麦老化种子幼苗芽长的影响
随着PEG 渗透势降低,引发3~12 h后燕麦老化种子幼苗芽长均呈先增后减的趋势(表6)。渗透势为0时,引发3 h后幼苗芽长显著小于其他渗透势引发下的芽长(P<0.05),而在渗透势为-0.3、-0.6和-0.9 MPa时显著大于-1.2 Mpa下的芽长;引发6 h后幼苗芽长在渗透势为-0.3 MPa时显著大于其他渗透势引发下的芽长,而在渗透势为0和-1.2 MPa时显著小于其他渗透势下的芽长;引发12 h 后幼苗芽长在渗透势为-0.3和-0.6 MPa时显著大于其他渗透势,在渗透势为0时显著小于其他引发渗透势下的。PEG 渗透势为0 和-1.2 MPa时幼苗芽长随引发时间延长而减小,CK 显著大于PEG 引发,引发12 h后显著小于其他引发时间;渗透势为-0.3 MPa时幼苗芽长随引发时间延长呈先增后减的趋势,引发6 h后幼苗芽长显著大于其他引发时间,而引发12 h后则显著小于其他引发时间;渗透势为-0.6和-0.9 MPa时幼苗芽长呈下降趋势,引发0(CK)~6 h时幼苗芽长差异不显著(P>0.05),但均显著大于引发12 h。双因素方差分析结果表明(表2),PEG 渗透势、引发时间以及两者之间的交互作用对燕麦老化种子幼苗芽长的影响极显著(P<0.01)。

表5 PEG 引发下燕麦老化种子幼苗根长的变化Table 5 Changes in length of roots for aged oat seeds pri ming with PEG c m
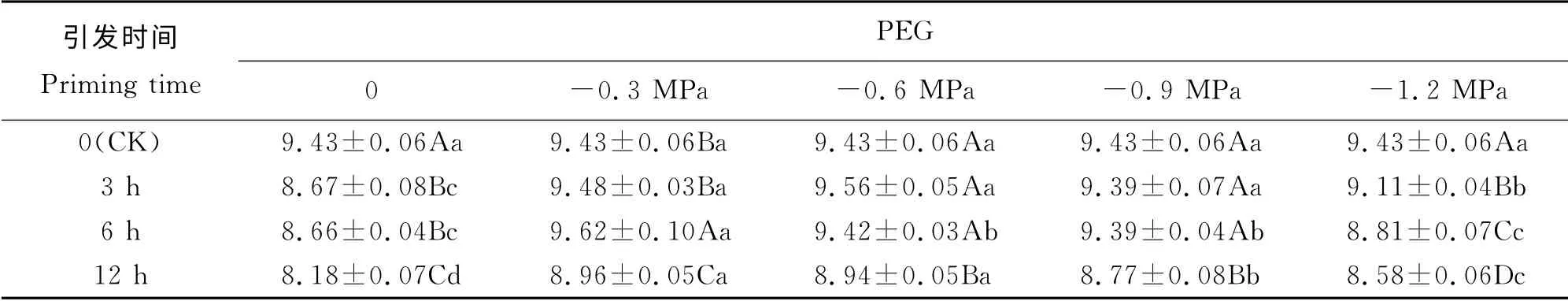
表6 PEG 引发下燕麦老化种子幼苗芽长的变化Table 6 Changes in length of shoots for aged oat seeds pri ming with PEG c m
3 讨论
发芽率和幼苗生长能力下降是种子老化的必然结果,而PEG 引发是提高种子萌发能力及幼苗抗逆性最常用的方法之一,而且植物苗期根和芽的生长能力对其后期生长及产量具有重要影响。因此,研究PEG 引发对老化种子幼苗根和芽的影响,不仅为植物种子活力提供重要的田间幼苗表现,还为幼苗后期生长提供强有力的基础。
PEG 引发能有效提高老化种子的发芽率,这已在小麦(41 ℃和95% RH 条 件)[6]、大 豆(45 ℃和100% RH 条 件)[7]、穿 心 莲(室 温 干 藏)[8]、茎 瘤 芥(贮藏2年)[9]、蔓性千斤拔(常温布袋贮藏)[10]及紫苏(常规保存)[3]等植物的老化种子中得到验证。然而,本研究发现,PEG 渗透势为0~-0.6 MPa时引发3~12 h后,燕麦老化种子的发芽率均小于引发时间为0时的,而渗透势为-0.9和-1.2 MPa的PEG 引发6和12 h后,燕麦老化种子的发芽率均略高于引发时间为0时的,这说明高渗透势PEG 引发抑制了超干燕麦老化种子的萌发,而低渗透势PEG引发则促进燕麦老化种子的萌发。这与目前报道的研究结果[3,6-10]不完全相同,而这种差异可能主 要 是种子含水量不同导致的,所以,种子含水量高低是影响引发成败的重要因素,这与Mc Donald[15]的观点一致。目前的报道主要以常规贮藏或人工加速老化的植物种子为材料,而本研究以超干燕麦种子(含水量为4%)为材料。在高渗透势PEG 条件下,引发溶液水势远远高于超干燕麦种子细胞内水势,所以,水分可以快速进入种子细胞,致使超干种子快速吸胀,加剧了老化过程膜完整性的损失,从而对种胚细胞造成不可逆的伤害,即形成吸胀损伤,导致细胞死亡,表现为种子活力下降[16-17]。在常规贮藏或人工加速老化的种子含水量普遍较高,与引发溶液之间的水势差较小,水分进入种胚细胞的速度也相对较慢,所以一般不会引起吸胀损伤。同样,低渗透势PEG 减小了引发溶液与超干燕麦种胚细胞之间的水势差,降低了水分进入种胚细胞的速度。因此,适当渗透势的PEG 引发可以启动老化种子体内的保护机制,降低种子吸胀过程膜系统的损伤,增强膜系统的修复,从而提高种子萌发能力[18]。
根长是评价植物根系吸收功能最常用的指标,较长的根系可以确保植物吸收足够维持生长所需的水分[19]。马巧利等[20]研究紫花苜蓿(Medicago sativa)幼苗生长发现,PEG 引发导致紫花苜蓿幼苗的胚根细而长。本研究发现,除渗透势为-1.2 MPa的PEG 引发6 h和12 h及渗透势为-0.9 MPa的PEG 引发12 h 外,超干燕麦老化种子幼苗根长均显著高于CK(P<0.05),说明PEG 引发促进了超干燕麦老化种子幼苗根的增长,这与前人的研究结果[6,21]相 一 致。然 而,除 渗 透 势 为-1.2 MPa 的PEG 引发12 h 外,超干燕麦老化种子的幼苗根鲜重均小于CK,这说明PEG 引发抑制了其根的增重,这与前人的研究结果不同[6,21]。另外,本研究中,除PEG 渗透势为-0.9 MPa 引发3 和6 h,-1.2 MPa引发12 h 外,其他渗透势及引发时间下,燕麦老化种子幼苗芽鲜重均显著小于CK(P<0.05);而芽长则除渗透势为-0.3、-0.6和-0.9 MPa引发3 和6 h 外,其他均显著低于CK(P<0.05),说明PEG 引发会抑制超干燕麦老化种子幼苗芽的生长,这也与前人的研究结果[6,21]不同。李媛媛等[21]研究老化(常规贮藏3或4年)潍县萝卜(Raphanus sativus)种子幼苗生长发现,浓度为50、100、200和300 mg·L-1的PEG 引发12 h后,其根长、芽长和鲜重均显著高于CK。张自阳等[6]研究人工老化(41 ℃和95% RH 条件下老化4 d)小麦种子幼苗生长也发现,PEG(浓度为0.2、0.4、0.6和0.8 g·L-1)引发24 h后,小麦种子苗和根的生长量均高于CK(蒸馏水),根生长量的变化尤为明显,根重、根毛的数量和根粗均显著高于CK(蒸馏水)。本研究结果与前人的研究[6,21]并不完全相同,其主要原因可能还是由于含水量不同所致,超干燕麦老化种子水势较低,如果PEG 渗透势太高或引发时间不当,则会引起吸胀损伤,从而抑制其幼苗的生长。
PEG 引发对燕麦老化种子幼苗根鲜重、芽鲜重、根长和芽长的影响与其渗透势、引发时间及两者之间的互作效应差异极显著(P<0.01),说明PEG引发对超干燕麦种子幼苗根和芽生长的影响与其渗透势及引发时间有关。另外,燕麦老化种子幼苗根长、芽长在引发3和6 h后随PEG 渗透势降低呈现先增后减的趋势,这与前人的研究结果相似。张凤银 等[19]研 究PEG 引 发24 h 后 宿 根 天 人 菊(Gaill ar dia aristata)的幼苗生长发现,其主根长在1%~10%范围随PEG 浓度增加而增加,而10%~25%范围随PEG 浓度增加而减少。王慧超等[9]研究PEG 引发12 h后老化茎瘤芥种子幼苗的生长也发现,在5%~30%浓度范围内,其幼苗根干重、苗干重和根长随PEG 浓度增加而增加,而在浓度为30%~35%时降低。然而,本研究发现,PEG 引发12 h后超干燕麦老化种子根长随PEG 渗透势降低而降低,而且其根鲜重均随PEG 渗透势降低而增大,但引发3 h后其根鲜重仅在渗透势为-1.2 MPa时大于渗透势为0,且两者差异不显著(P>0.05),引发6 h后其根鲜重在PEG渗透势-0.3、-0.6、-0.9和-1.2 MPa时均显著大于渗透势为0 时(P<0.05),引发12 h后其根鲜重在PEG 渗透势为-0.9和-1.2 MPa时显著大于渗透势为0时(P<0.05);渗透势为-0.3、-0.6、-0.9和-1.2 MPa的PEG引发3、6和12 h后,超干燕麦老化种子芽鲜重均高于渗透势为0,而且除渗透势为-0.3和-0.6 MPa时引发12 h外,均达到显著水平(P<0.05)。潘春柳等[8]研究PEG引发24 h后老化(室温干藏12、18和24个月)穿心莲种子幼苗生长也发现,PEG 引发不能显著提高穿心莲幼苗的鲜重。与安全含水量或高含水量的植物老化种子相比,超干种子的水势较低,如果PEG引发不当,易产生吸胀损伤,从而降低其发芽率,并抑制其幼苗生长。因此,如果PEG 引发要应用农业生产,尚需进一步研究其对幼苗生长的影响。
4 结论
PEG 引发对超干燕麦老化种子的作用效果与其渗透势、引发时间及两者之间交互作用关系密切。高渗透势PEG 引发降低了超干燕麦老化种子的发芽率,而低渗透势PEG 引发则提高了其发芽率。另外,PEG 引发还促进了超干燕麦老化种子幼苗根的伸长,但抑制了其幼苗芽的伸长,以及根和芽的增重。
[1] 夏方山,毛培胜,闫慧芳,王明亚.水杨酸对植物种子及幼苗抗逆性的影响[J].草业科学,2014,31(7):1367-1373.
[2] Par khey S,Naithani S C,Keshavkant S.ROS production and lipid catabolism in desiccating Shorea r obusta seeds during aging[J].Plant Physiology and Biochemistry,2012,57(1):261-267.
[3] 张春平,何平,杜丹丹,喻泽莉,胡世俊.ZnSO4和PEG 引发对老化紫苏种子萌发及幼苗抗氧化酶活性的影响[J].中国中药杂志,2010,35(18):2372-2377.
[4] Bailly C,Benamar A,Cor bineau F,Côme D.Free radical scavenging as affected by accelerated ageing and subsequent pri ming in sunflower seeds[J].Physiologia Plantar u m,1998,104(4):646-652.
[5] Butler L H,Hay F R,Ellis R H,Smith R D,Murray T B.Pri ming and re-drying i mpr ove the survival of mature seeds of Digitalis pur purea during storage[J].Annals of Botany,2009,103(8):1261-1270.
[6] 张自阳,姜小苓,卢春瑞,程媛,刘明久.PEG 引发处理对人工老化小麦种子活力及幼苗生长的影响[J].河南科技学院学报,2013,41(1):1-5.
[7] 王炜,史雨刚,王曙光.PEG 引发对老化大豆种子发芽及活力的影响[J].山西农业科学,2011,39(7):650-654.
[8] 潘春柳,黄燕芬,邓志军,林伟.PEG处理对新鲜和老化穿心莲种子萌发及幼苗生长的影响[J].种子,2013,32(12):30-34.
[9] 王慧超,赵昌琼,郑美娜,徐亚丽.聚乙二醇(PEG)浸种对茎瘤芥老化种子活力及其幼苗生长的影响[J].植物生理学通讯,2010,46(2):131-134.
[10] 冯世鑫,马小军,李小勇,凌征柱,柯芳,施力军.PEG 浸种对老化的蔓性千斤拔种子萌发及活力的影响[J].作物杂志,2013(1):136-139.
[11] 张海旺,芦翠乔,吴丁,徐本美.聚乙二醇(PEG)渗透处理对老化油菜种子过氧化及细胞膜透性的影响[J].华北农学报,1989,4(2):56-62.
[12] 程红焱.种子超干贮藏技术研究的背景和现状[J].云南植物研究,2005,27(2):113-124.
[13] Shewry P R,Piironen V,Lampi A M,Nystrom L,Li L,Rakszegi M,Fras A,Boros D,Gebruers K,Courtin C M,Delcour J A,Andersson A A M,Di mberg L,Bedo Z,Ward J L.Phytochemical and fiber components in oat varieties in the HEALTHGRAIN Diversity Screen[J].Journal of Agricultural and Food Chemistry,2008,56(21):9777-9784.
[14] ISTA.Inter national Rules for Seed Testing[M].Bassersdorf:Zurich,2013.
[15] Mc Donald M B.Seed deterioration:Physiology,repair and assessment[J].Seed Science and Technolgy,1999,27(1):177-237.
[16] Bewley J D,Bradfor d K J,Hilhorst H W M,Nonogaki H.Seeds:Physiology of Develop ment,Ger mination and Dor mancy[M].3r d.New Yor k:Springer Press,2013:143-147.
[17] 宋松泉,程红焱,姜孝成.种子生物学[M].北京:科学出版社,2008:163.
[18] 许耀照,曾秀存,王勤礼,卢精林,王治江,张克多.PEG 模拟干旱胁迫对不同黄瓜品种种子萌发的影响[J].中国蔬菜,2010(14):54-59.
[19] 张凤银,陈禅友,胡志辉.PEG-6000胁迫对宿根天人菊种子萌发及幼苗生理特性的影响[J].西北农林科技大学学报(自然科学版),2014,42(1):132-136.
[20] 马巧利,孙彦,杨青川,熊军波.NaCl和等渗PEG-4000胁迫对紫花苜蓿种子发芽及生理活性的影响[J].草地学报,2012,20(3):547-552.
[21] 李媛媛,孙海燕,刘华,王冰林.PEG 浸种对潍县萝卜陈种子活力及幼苗抗逆性的影响[J].种子,2011,30(1):45-48.
