围封对当雄县高寒草原土壤微生物和酶活性的影响
2015-04-08斯贵才袁艳丽王光鹏雷天柱张更新
斯贵才,袁艳丽,王 建,3,王光鹏,雷天柱,张更新
(1.甘肃省油气资源研究重点实验室,中国科学院油气资源研究重点实验室,中国科学院地质与地球物理研究所兰州油气资源研究中心,甘肃 兰州730000;2.中国科学院青藏高原研究所,高寒生态学与生物多样性实验室,北京100101;3.中国科学院大学,北京100049)
土壤微生物在有机质分解、能量转换以及元素循环过程中起着决定性作用[1]。土壤微生物尽管只占土壤有机质含量的一小部分,但在土壤生态系统中起着关键性作用。主要体现在:1)土壤微生物能够分解土壤有机质和促进腐殖质形成[2];2)土壤微生物与植物共生促进植物生长[3];3)土壤微生物能够吸收、固定并释放养分,对土壤营养状况的改善和调节具有重要的作用[4]。
土壤酶是土壤中一切生物化学过程的主要参与者,是生态系统物质循环和能量流动过程中最活跃的生物活性物质之一[5],主要来自于微生物以及其他有机组织[6]。土壤酶在有机物分解和合成、营养循环以及降解外源物质过程中起着重要作用,土壤酶活性还与土壤理学特征、微生物群落结构、植被类型和生物扰动等具有密切关系。
放牧是草地利用的最主要方式。放牧家畜践踏不仅对草地植被与土壤产生影响,还会影响土壤养分的循环和土壤微生物的活动。过度放牧会加速草地退化,影响土壤生态功能。近年来,国内外关于放牧强度对土壤微生物和酶活性的影响已有不少研究[7-8],结果表明,不同放牧强度对微生物各类群数量和种类组成产生不同影响,围栏禁牧和轻度放牧可以提高土壤中各类群微生物的生物量,重度放牧明显降低微生物生物量和酶活性。本研究在西藏当雄县高寒草原过度放牧区设立围栏禁牧,研究不同围封年限对草原化草甸土壤微生物和酶活性的影响,探讨草原化草甸生态系统中土壤微生物和酶活性对禁牧年限的响应,以期为研究高寒草原恢复利用提供土壤微生物学方面的试验依据。
1 研究区概况与研究方法
1.1 研究区概况
研究区位于青藏高原当雄县,草地类型属于草原化草甸生态系统范畴。土壤为高原草甸土,表层是根系盘结致密紧实的毡状草皮层,草皮层以下通常含有较多砾石[9]。根据当雄县气象观测站1980 -2010 年的气象观测数据,研究区年均温、最高月均温(7 月)以及最低月均温(1 月)分别是1.8、10.9和-9.1 ℃。年均降水量为479 mm,年均蒸发量为1 726 mm。
1.2 样品采集
本试验在当雄县草原观测站(30°29'44.18″ N,91°04'13. 41″ E)开展相关研究。分别在2006、2008、2011 年进行围栏禁牧试验,试验小区为3 m×3 m,共设置4 个平行小区。2012 年8 月分别采集围栏1 年、4 年和6 年内土壤样品,并采集放牧土壤样品作为对照,每个样点用土钻通过蛇形采集0 ―15 cm 土壤混合在一起,4 个重复。
1.3 分析方法
1.3.1 土壤理化性质分析 土壤基本理化性质采用常规分析法[10]测定。称取5 g 土壤在105 ℃烘12 h 测含水量。水土比1/2.5 测土壤pH。土壤粒径采用粒度分析仪测量。土壤有机碳采用日本TOC-TN 分析仪测量。土壤总氮采用凯氏定氮仪测量。土壤总磷采用紫外分光光度计测量。
土壤水溶性物质根据Jones 的方法[11]测定。2.5 g 湿土加入25 mL 去离子水在200 r·min-1下搅拌15 min,然后2 500 r·min-1离心10 min 取得上清液。水溶性有机碳和水溶性有机氮采用日本TOC-TN 分析仪测定。硝酸根离子、铵根离子和硫酸根离子采用离子色谱测量。
1.3.2 土壤酶分析 土壤酶活性根据关松荫[12]的方法测定。酚氧化酶和过氧化物酶活性采用分光光度法测量:1 g 湿土加入10 mL 1%浓度的焦培酸作为底物在30 ℃条件下混合10 min。β-葡萄糖苷酶活性测定:以Para-nitrophenyl-β-D-glucopyran-oside(PNPG)为底物,1 g 湿土加入4 mL 0.05 mol·L-1缓冲液以及1 mL 5 mmol·L-1的PNPG 在37 ℃条件下水浴1 h。L-天冬酰胺酶活性测定:采用5 g 土置于50 mL 三角瓶中,用0.5 mL 甲苯处理15 min后加10 mL 的3%天冬酰胺和10 mL(pH 6.7)磷酸盐缓冲液于37 ℃恒温箱中培养24 h。蔗糖酶活性测定:采用1 g 湿土壤加入15 mL 的2 mol·L-1醋酸缓冲溶液,以及15 mL 的1.2%蔗糖底物在50 ℃条件下培养3 h。脲酶活性测定:用0.5 g 湿土加入2.5 mL 的80 mmol · L-1脲 素 和20 mL 的75 mmol·L-1硼酸盐缓冲溶液在37 ℃条件下反应2 h。蛋白酶活性测定:1 g 湿土壤加入5 mL 的酪蛋白溶液和5 mL 的三异丙基乙磺酰缓冲溶液在50 ℃条件下培养2 h。酸性磷酸酶活性测定:用苯基磷酸盐作基质,以酚的释放量表示磷酸酶活性。
1.3.3 磷脂脂肪酸提取和分离 磷脂脂肪酸抽提方法通过修正过的BD 方法[13],将5 g 冷冻干燥以后的样品加入单一相的氯仿、甲醇和磷酸盐缓冲溶液的混合溶剂(1∶ 2∶ 0.8,体积比,pH =7.4)抽提2 h,离心得到上清液,在上清液中加入等比例的水和氯仿,静置分层吸取下层有机相。此过程重复抽提两次,两次抽提得到的有机相混合在一起,通过硅酸层析柱分别采用氯仿、丙酮和甲醇冲洗得到中性脂、糖脂和磷脂。磷脂部分再通过37 ℃水浴15 min在碱性条件下水解为磷脂脂肪酸甲酯。在上机分析之前都在-20 ℃条件下保存。磷脂脂肪酸采用美国Agilent 6890A 型气象色谱仪,包括全自动进样装置、石英毛细管柱及氢火焰检测器。鉴定采用美国MIDI 公司(MIDI,Newark,Delaware,USA)开发的基于细菌细胞磷脂脂肪酸成分鉴定的Sherlock MIS 4.5 系统(Sherlock Microbial Identification System)。
1.4 统计分析
放牧与不同围栏年限变量之间的显著性分析采用单因素方差分析和多重比较分析,土壤因子和微生物群落与土壤酶活性之间的相关性采用Pearson相关分析法分析。所有的分析都采用SPSS 18.0 完成,并且都在0.05 的水平上进行。
2 结果与分析
2.1 不同围栏年限土壤理化性质的变化
不同围栏年限土壤理化性质相对于放牧土壤有明显改变,主要表现在土壤水、pH、水溶性有机碳和水溶性有机氮方面(表1)。土壤含水量随着围栏年限的增加而增加,放牧土壤水含量为25.38%,当围栏时间达到6 年,土壤水含量为28.46%,围栏内土壤含水量与放牧相比显著增加(P <0.05)。相反,围栏内外土壤都为酸性土壤,土壤pH 值却随着围栏时间的增加而减小,从放牧的6.22 显著减小到围栏6 年的6.01。土壤水溶性有机碳和水溶性有机氮都随着围栏年限的增加而增加,分别从放牧的179.95 和17.79 mg·kg-1显著增加到围栏6 年的251. 97 和23. 82 mg·kg-1。土壤碳氮比先升高后降低,围封4 年比值最高(18.64),但变化均没有达到显著水平(P >0.05)并且都小于20,属于低碳氮比土壤。此外,随着围栏年限的增加,土壤粒径也产生了明显变化,主要表现在沙土和粉土含量都是围栏6 年土壤与放牧土壤相比变化显著。其中沙土含量围栏6 年时与放牧相比,显著减少,粉土含量围栏6 年时与放牧相比,显著增加。
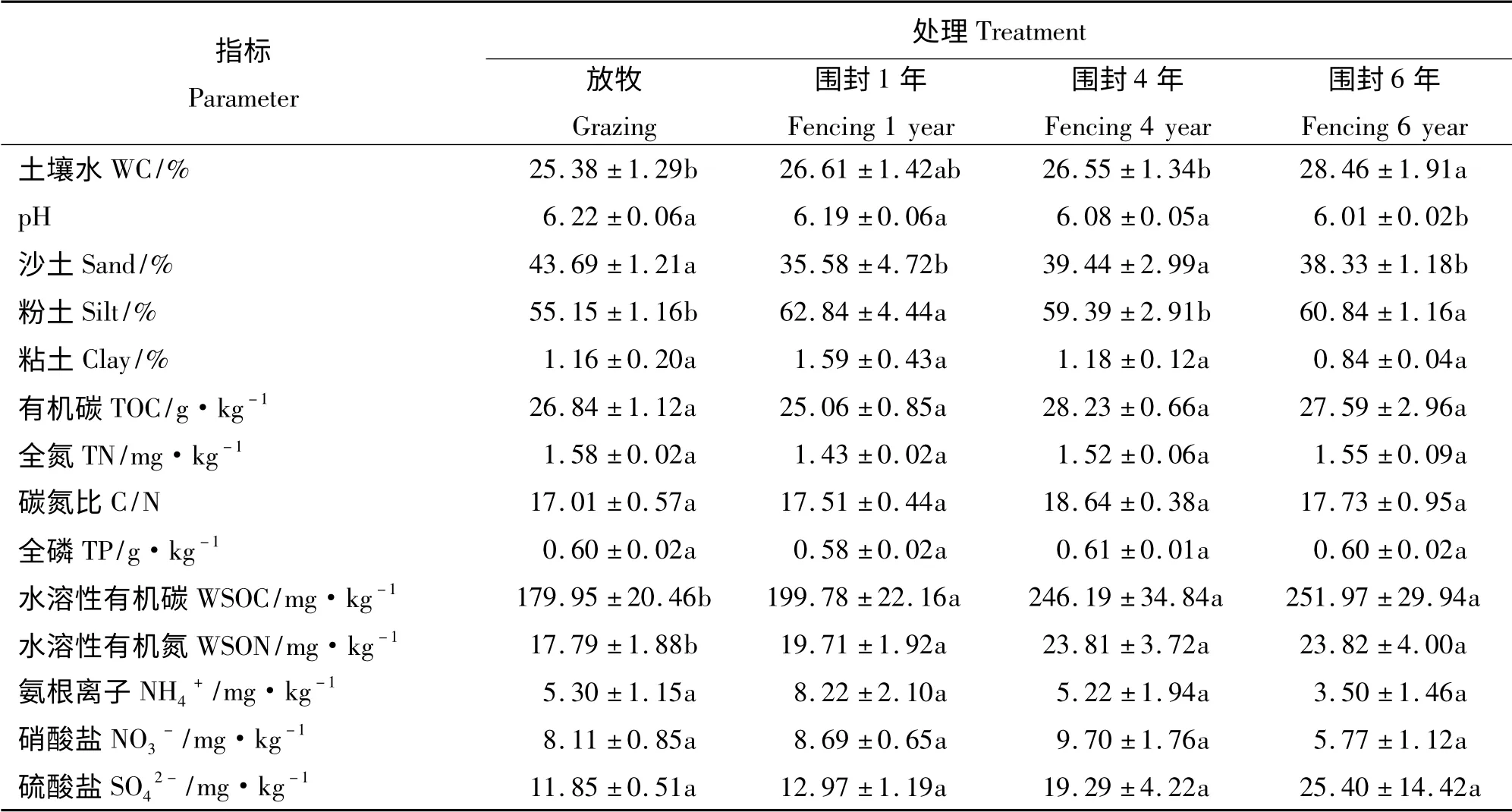
表1 围栏内外土壤理化特征Table 1 Physical and chemical character of sampling sites
2.2 不同围栏年限土壤酶活性的变化
放牧和不同围封年限围栏内的8 种土壤酶活性结果表明,蔗糖酶活性和L-天冬酰胺酶活性表现出随着围栏年限的增加而增加,至围栏4 年时达最大,之后略有降低(图1)。围封1 年后,蔗糖酶活性从放牧的0.93 增加到1.06 μg·g-1·h-1,L-天冬酰胺酶活性从放牧的0. 18 显著增加到0. 34 μg·g-1·h-1(P <0.05),到围栏6 年时分别增加到1.42 和0.37 μg·g-1·h-1。而β-葡萄糖苷酶、蛋白酶、酚氧化酶和酸性磷酸酶活性随着围栏时间的延长均未有显著变化(P >0.05)。过氧化物酶活性表现出围封低于放牧,并且随着围栏时间的增加有减小的趋势,从放牧的1 211.69 μg·g-1·h-1显著下降到围封6 年时的920.67 μg·g-1·h-1。
2.3 不同围封年限土壤微生物群落结构的变化特征
采用总磷脂脂肪酸(PLFA)含量表示总的微生物量。结果表明,细菌(i14:0,i15:0,a15:0,C15:1,i16:0,16:1w9c,16:w7c,16:1w5c,16:1w3c,i17:0,a17:0,C17:1 cy17:0,C18:1,i19:0,cy19:0[14-16])生物量(图2),真菌(C18:2,18:1 w9c[14])生 物 量,放 线 菌(10Me16:0,10Me 17:0,10Me18:0[17-18])生 物 量,革 兰 氏 阳 性 菌(i14:0,i15:0,a15:0,i16:0,i17:0,a17:0,i19:0,10Me16:0,10Me 17:0,10Me18:0[19])生物量和革兰氏 阴 性 菌(cy17:0,cy19:0,15:1,16:1w9,16:1w7,16:1w5,18:1w7,19:1[20])生物量都是围封1 年和围封4 年相对于放牧生物量变化不明显,而围封6 年内土壤微生物量相对放牧土壤生物量增加,尤其是细菌、放线菌和革兰氏阳性菌,围封6年内各生物量都显著高于放牧(P <0.05)。其中,细菌从放牧的23.84 显著增加到围封6 年的32.75 nmol·g-1,放线菌从放牧的5.08 nmol·g-1显著增加到围封6 年的6.66 nmol·g-1,而革兰氏阳性菌从放牧的8.72 nmol·g-1显著增加到围封6年的13.43 nmol·g-1。
微生物群落结构也随着围栏年限的增加呈现出规律性的变化。真菌与细菌的比值常用于评价微生物群落的结构指标。革兰氏阳性菌与革兰氏阴性菌的比值以及环状脂肪酸和前体脂肪酸的比值常被用于指示微生物群落结构的环境压力[21],本研究中这两个比值围封6 年土壤相对于放牧土壤都发生了显著改变(P <0.05),说明围封年限引起了土壤微生物群落结构的显著改变。
2.4 土壤理化性质与土壤酶活性和微生物群落结构的相关性分析

图2 围封与放牧对土壤微生物群落变化的影响Fig.2 Effects of grazing and fencing on soil microbial communities
不同的土壤酶活性与不同的土壤物理化学性质存在相关性(表2)。蔗糖酶活性与水溶性有机碳显著相关(P <0.05),β-葡萄糖苷酶活性主要与土壤有机碳和全氮显著正相关,酚氧化酶活性与硫酸盐呈显著负相关,过氧化物酶活性与土壤水呈显著负相关,蛋白酶活性与有机碳和水溶性有机氮呈显著正相关,与土壤水呈极显著正相关(P <0.01),L-天冬酰胺酶活性与有机碳和碳氮比呈显著正相关,与土壤水和水溶性有机碳呈极显著正相关。脲酶活性与测试的土壤理化性质均没有显著的相关关系(P>0.05)。酸性磷酸酶与土壤pH 呈显著负相关,与有机碳、全氮和土壤水都呈极显著正相关。
土壤微生物量与土壤理化性质呈现出一定的相关性。主要表现在土壤有机碳、全氮和土壤水均与细菌、真菌(与土壤水无显著相关)、放线菌、革兰氏阳性菌以及革兰氏阴性菌含量有显著或极显著的正相关关系(P <0.05)(表3)。此外,真菌与细菌的比值与土壤碳氮比值呈显著正相关关系,革兰氏阳性菌与革兰氏阴性菌含量比值与pH 和粘土含量呈显著负相关,与有机碳、水溶性有机碳和水溶性有机氮呈显著正相关,与土壤水有极显著正相关关系,环状脂肪酸与前体脂肪酸的比值与沙土含量呈显著正相关关系,与粉土含量呈显著负相关关系。
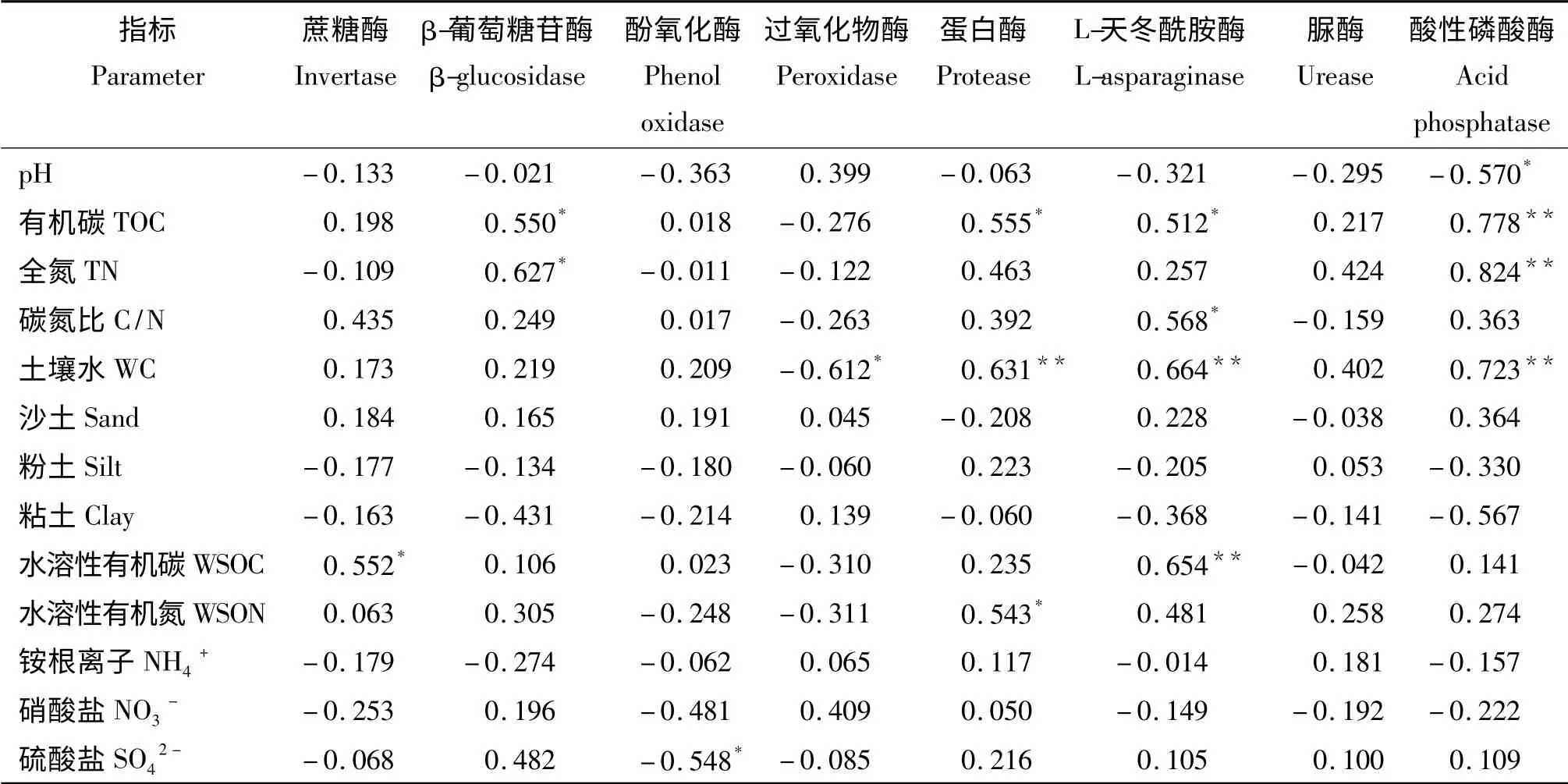
表2 土壤理化性与土壤酶活性之间的相关性Table 2 Correlation coeffients between soil physical and chemical character and enzyme activities
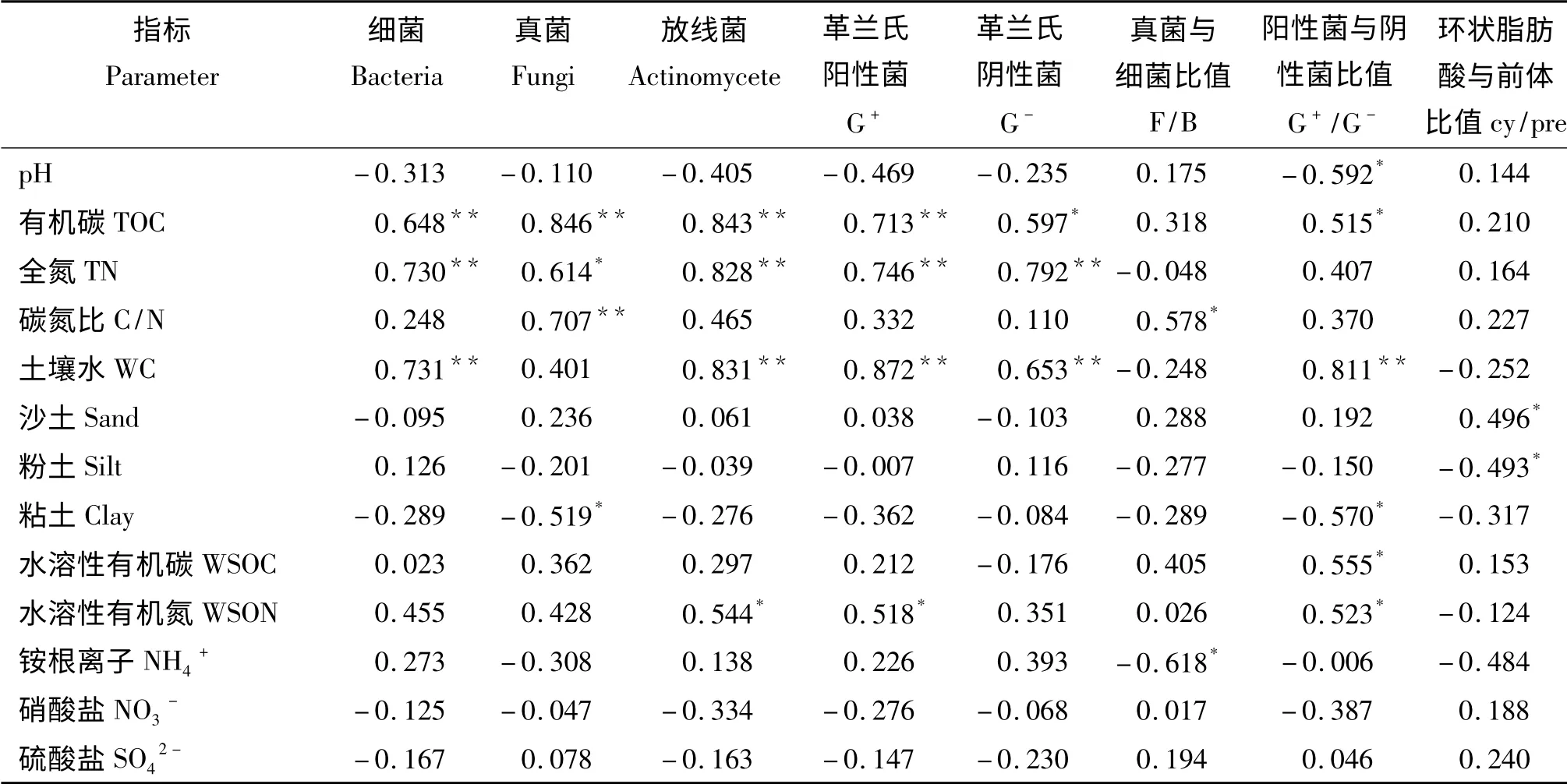
表3 土壤理化性与土壤微生物群落结构之间的相关性Table 3 Correlation coeffients between soil physical and chemical character and soil microbial communities
3 讨论
本研究分析围封对当雄县退化草地草甸土壤微生物群落结构和土壤酶活性的影响发现,围封6年内土壤含水量和pH 值相对于放牧土壤有显著改变(P <0.05),围封1、4 和6 年内土壤水溶性有机碳和水溶性有机氮含量相对于放牧土壤有显著增加;土壤蔗糖酶和L-天冬酰胺酶活性都随着围封年限的增加而增加;细菌、放线菌和革兰氏阳性菌含量都是围封6 年相对于放牧土壤显著增加。说明在当雄县围封禁牧不仅有利于土壤物理化学指标的恢复,而且土壤酶活性与土壤微生物量都会得到相应恢复,有利于改善土壤生态环境。赵帅等[22]在研究内蒙古草原土壤微生物时也发现围封内土壤生物量显著高于放牧土壤生物量。熊好琴等[23]在研究围封禁牧对土壤理化特征的影响时发现围封5 年显著增加了0 -5 cm 土壤有机碳,围封16 年能显著增加土壤粘土含量和有机碳、全氮含量。说明长期禁牧可以逐渐改善土壤质地和提高土壤肥力,并逐渐恢复被破坏的土壤生态功能。本研究中,不同围封年限及放牧土壤均以细菌占绝对优势,放线菌次之,真菌数量最少,可能由于细菌类群组成具有多样性或该土壤环境更适合的细菌生存[24],所以有利于细菌生长繁殖。围封6年土壤的细菌和放线菌生物量显著大于放牧土壤,这与宋俊峰等[25]、赵吉等[26]得出重度放牧减少了土壤微生物的数量,而围封禁牧和轻度放牧有利于土壤微生物的生长繁殖研究结果相一致。因此,围封禁牧或者合理的放牧对于维持土壤生态系统的健康平衡和草地的可持续发展具有重要的意义。
土壤养分的多少及动态变化是评价土壤肥力高低的主要指标。有机质是土壤的主要养料,尤其是碳、氮、磷。土壤可溶性养分的动态变化反映了土壤现实供肥能力,其质量分数与土壤含水量、湿度以及土壤微生物活动关系密切[27]。本研究中土壤水溶性有机碳和水溶性有机氮含量围封与放牧显著不同(P <0.05)。说明过度放牧破坏土壤结构及养分以后,通过围栏禁牧是可以恢复的。此外,在放牧情况下,地表的裸露程度增大,地表蒸发随之增大,土壤水分不易保持,呈逐渐下降的趋势,而土壤的干燥抑制了土壤微生物的生命活动及酶的活性,因此土壤水溶性有机碳、水溶性有机氮、土壤含水量与土壤微生物群落和土壤酶活性一定的相关关系(表2,3)。
土壤酶是土壤中的生物催化剂,直接参与土壤营养元素的有效化过程,对维持土壤生态系统的稳定起着重要的作用[12]。放牧引起的土壤结构破坏,会导致影响土壤酶活性的环境因素发生改变,比如酶作用底物的供给水平等。β-葡萄糖苷酶、蔗糖酶、酚氧化酶和过氧化物酶是与碳循环密切相关的土壤酶;L-天冬酰胺酶、蛋白酶和脲酶是与氮循环密切相关的土壤酶;碱性磷酸酶是与磷循环密切相关的土壤酶。测试的土壤酶活性中,蔗糖酶活性和L-天冬酰胺酶活性围封相对放牧土壤均有明显增加(P <0.05)。蔗糖酶与L-天冬酰胺酶都是水解酶,并且分别与碳循环和氮循环密切相关,这和围封土壤水溶性有机碳和水溶性有机氮含量相对放牧增加密切相关。Kandeler 等[28]认为,土壤酶的功能多样性与土壤功能的多样性紧密相关,土壤生态系统退化都伴随着不同土壤酶活性的下降。本试验中部分土壤酶活性随着围封年限增加与放牧土壤无显著差异(P >0.05),但蔗糖酶与L-天冬酰胺酶的活性增加显著,这说明:1)短期的禁牧并不会使所有土壤酶活性发生显著的恢复,但是长年的禁牧有利于部分与土壤碳循环与氮循环相关的土壤酶活性的恢复;2)放牧已使土壤的物理结构受损(土壤沙土和粉土含量有显著改变),营养物质过分损耗,生态系统的稳定性遭到了破坏,造成土壤环境的严重退化,但在禁牧4 到6 年后土壤酶活性和土壤微生物量都有显著提高。王启兰等[5]研究指出,随着放牧强度的增大,土壤纤维素分解酶、多酚氧化酶、脲酶、蛋白酶、蔗糖酶和碱性磷酸酶活性都显著下降。孙秀英等[29]研究指出土壤酶活性随着放牧压力的增大,呈现先增大后减小的趋势,说明土壤酶功能对放牧压力非常敏感,很容易受到放牧的影响,并且一旦严重破坏之后在很长年限内都难以恢复。
土壤微生物是草地生态系统的重要组成部分,其含量和活性与植被类型、放牧干扰强度、土壤肥力等因素密切相关[30]。本研究中,土壤细菌、放线菌和革兰氏阳性菌含量在围封6 年土壤中相对于放牧土壤都显著增加(P <0.05),对比土壤理化性质和土壤酶活性,说明在当雄县围栏禁牧首先能恢复土壤理化性质及土壤酶活性,随着禁牧时间增加会继续恢复土壤微生物量以及改变土壤微生物群落结构,主要会显著增加土壤细菌、放线菌和革兰氏阳性菌的含量。也就是说,围栏禁牧6年可以部分恢复土壤生态系统的健康,首先恢复的是土壤营养物质,随着土壤营养物质的增加,土壤微生物方面的生态功能也逐渐恢复,主要与放线菌、革兰氏阳性菌有关的生态功能。由于土壤微生物是土壤有机质与土壤养分转化和循环的动力,并且结合各微生物类群都与土壤有机碳、全氮、土壤水有显著正相关关系,因此推测随着围栏禁牧年限的增加,土壤生态系统的健康和功能会得到更进一步的恢复。
4 结论
过度放牧会严重破坏土壤生态系统,造成土壤环境的退化,一旦破坏以后,短期的围栏禁牧很难恢复。围封土壤含水量、水溶性有机碳含量、水溶性有机氮含量、L-天冬酰胺酶活性、细菌含量、放线菌含量和革兰氏阳性菌含量相对于放牧土壤均有显著增加(P <0.05)。说明长期的围栏禁牧有利于土壤生态功能的恢复,对于维持土壤生态系统的健康平衡和草地的可持续发展具有重要的意义。
[1] Angeloni N L,Jankowski K J,Tuchman N C,Tuchman J K.Effects of an invasive cattail species (Typha×glauca)on sediment nitrogen and microbial community composition in a freshwater wetland[J].FEMS Microbiology Letters,2006,263(1):86-92.
[2] Vossbrinck C R,Coleman D C,Woolley T A.Abiotic and biotic factors in litter decomposition in a semiarid grassland[J].Ecology,1979,60(2):265-271.
[3] Vincent J M.Nitrogen Fixation in Legumes[M].Utah:Academic Press,National Library of Australia Cataloguing in Publication Data,1982.
[4] Roy S,Singh J S.Consequences of habitat heterogeneity for availability of nutrients in a dry tropical forest[J].Journal of Ecology,1994,82(3):503-509.
[5] 王启兰,曹广民,王长庭.放牧对小嵩草草甸土壤酶活性及土壤环境因素的影响[J].植物营养与肥料学报,2007,13(5):856-864.
[6] Aon M A,Colanerl A C.Temporal and spatial evolution of enzymatic activities and physicochemical properties in an agricultural soil[J].Applied Soil Ecology,2001,18(3):255-270.
[7] 赵吉.不同放牧率对冷蒿小禾草草原土壤微生物数量和生物量的影响[J].草地学报,1999,7(3):223-227.
[8] 文都日乐,张静妮,李刚,易津,张永生,杨殿林.放牧干扰对贝加尔针茅草原土壤微生物与土壤酶活性的影响[J].草地学报,2010,18(4):517-522.
[9] 李文华,周兴民.青藏高原生态系统及优化利用模式[M].广州:广东科技出版社,1998.
[10] 鲍士旦.土壤农化分析[M].北京:农业出版社,1987.
[11] Jones D L,Willett V B.Experimental evaluation of methods to quantify dissolved organic nitrogen (DON)and dissolved organic carbon (DOC)in soil[J].Soil Biology and Biochemistry,2006,38(5):991-999.
[12] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1986.
[13] White D,Davis W,Nickels J,King J,Bobbie R.Determination of the sedimentary microbial biomass by extractible lipid phosphate[J].Oecologia,1979,40(1):51-62.
[14] Federle T W,Dobbins D C,Thorntonmanning J R,Jones D D.Microbial biomass,activity,and community structure in subsurface soils[J].Ground Water,1986,24(3):365-374.
[15] Frostegard A,Baath E,Tunlid A.Shifts in the structure of soil microbial communities in limed forests as revealed by phospholipid fatty-acid analysis[J].Soil Biology and Biochemistry,1993,25(6):723-730.
[16] Frostegard A,Tunlid A,Baath E.Phospholipid fatty-acid composition,biomass,and activity of microbial communities from 2 soil types experimentally exposed to different heavy-metals[J]. Applied and Environmental Microbiology,1993,59(11):3605-3617.
[17] Kroppenstedt R.Fatty acid and menaquinone analysis of actinomycetes and related organisms[A].Goodfellow M,Minnikin D E.Chemical Methods in Bacterial Systematics[M].Utah:Academic Press,1985.
[18] Zelles L,Bai Q Y,Ma R X,Rackwitz R,Winter K,Beese F.Microbial biomass,metabolic activity and nutritional-status determined from fatty-acid patterns and poly-hydroxybutyrate in agriculturally-managed soils[J]. Soil Biology and Biochemistry,1994,26(4):439-446.
[19] Zogg G P,Zak D R,Ringelberg D B,MacDonald N W,Pregitzer K S,White D C.Compositional and functional shifts in microbial communities due to soil warming[J].Soil Science Society of America Journal,1997,61(2):475-481.
[20] Mutabaruka R,Hairiah K,Cadisch G.Microbial degradation of hydrolysable and condensed tannin polyphenol-protein complexes in soils from different land-use histories[J].Soil Biology and Biochemistry,2007,39(7):1479-1492.
[21] Kieft T L,Wilch E,Oconnor K,Ringelberg D B,White D C.Survival and phospholipid fatty acid profiles of surface and subsurface bacteria in natural sediment microcosms[J].Applied and Environmental Microbiology,1997,63(4):1531-1542.
[22] 赵帅,张静妮,赖欣,杨殿林,赵建宁,李刚,邹雨坤.放牧与围栏内蒙古针茅草原土壤微生物生物量碳、氮变化及微生物群落结构PLFA 分析[J].农业环境科学学报,2011,30(6):1126-1134.
[23] 熊好琴,段金跃,张新时.围栏禁牧对毛乌素沙地土壤理化特征的影响[J].干旱区资源与环境,2012,26(3):152-157.
[24] 陈珊,张常钟,刘东波,张镇瑗,杨靖春,王志霞.东北羊草草原土壤微生物生物量的季节变化及其与土壤生境的关系[J].生态学报,1995,15(1):91-94.
[25] 宋俊峰,韩国栋,张功,武春燕.放牧强度对草甸草原土壤微生物数量和微生物生物量的影响[J].内蒙古师范大学学报(自然科学汉文版),2008,37(2):237-240.
[26] 赵吉,廖仰南,张桂枝,邵玉琴.草原生态系统的土壤微生物生态[J].中国草地,1999(3):57-67.
[27] 张伟华,关世英,李跃进.不同牧压强度对草原土壤水分、养分及其地上生物量的影响[J].干旱区资源与环境,2000,14(4):61-64.
[28] Kandeler E,Luxhoi J,Tscherko M,Magid J.Xylanase,invertase and protease at the soil litter interface of a loamy sand[J].Soil Biology and Biochemistry,1999,31(8):1171-1179.
[29] 孙秀英,王政军,孙镇涛,贾树海.放牧压力对草原砂质栗钙土土壤酶活性影响的研究[J].辽宁农业科学,2009(4):27-29.
[30] Su Y Z,Li Y L,Cui J Y,Zhao W Z.Influences of continuous grazing and livestock exclusion on soil properties in a degraded early grassland,Inner Mongolia,northern China[J].Catena,2005,59(3):267-278.
