KPNA2基因沉默和过表达对人膀胱癌细胞株5637增殖能力的影响
2015-04-07史本涛苏博兴李学松周利群
史本涛,苏博兴,方 冬,何 群,李学松,周利群*
(北京大学:1.第一医院泌尿外科,2.泌尿外科研究所,3.第一医院泌尿病理科,北京 100034)
·基础研究·
KPNA2基因沉默和过表达对人膀胱癌细胞株5637增殖能力的影响
史本涛1,2,苏博兴1,2,方 冬1,2,何 群2,3,李学松1,2,周利群1,2*
(北京大学:1.第一医院泌尿外科,2.泌尿外科研究所,3.第一医院泌尿病理科,北京 100034)
目的 观察KPNA2(karyopherin a2)基因沉默和过表达对人膀胱癌细胞株5637增殖能力的影响。方法 将KPNA2 siRNA干扰质粒和过表达质粒pcDNA3.1(+)-KPNA2用LipofectaminTM2000方法瞬时转染膀胱癌细胞株5637,转染后48 h,应用蛋白质印迹法检测转染细胞中KPNA2蛋白表达,CCK-8(cell counting kit-8)法检测细胞增殖活性,通过生长曲线检测KPNA2基因沉默和过表达后细胞增殖能力的改变。结果 与阴性对照组比较,KPNA2 siRNA干扰质粒转染5637细胞后,转染组细胞KPNA2蛋白表达水平显著下降,细胞增殖能力明显受到抑制,pcDNA3.1(+)-KPNA2过表达质粒转染5637细胞后,转染组细胞KPNA2蛋白表达水平显著升高,细胞增殖能力明显增强(P<0.05)。结论 KPNA2基因沉默和过表达可以调节人膀胱癌细胞株5637的增殖能力,为膀胱癌的临床治疗提供了新方向。
膀胱癌;KPNA2;RNA干扰;过表达;增殖
核转运蛋白基因2(karyopherin a2,KPNA2)是一种具有核定位信号区域的接头蛋白,作为核孔靶向复合物的组成部分,与核定位信号结合,运输蛋白质进入核内发挥作用,调节效应基因的表达,与细胞的恶性转化密切相关[1]。目前关于KPNA2基因与膀胱癌的关系研究较少,确切分子机制尚不清楚。RNA干扰(RNA interference, RNAi)是一种常用的基因沉默技术,是外源或内源双链RNA在生物体内诱导的特异性基因沉默现象。本研究探讨了KPNA2基因干扰和过表达对人膀胱癌5637细胞株增殖能力的影响,为深入研究KPNA2基因在肿瘤中异常表达的分子机制提供新思路。
1 材料与方法
1.1 主要材料和试剂人膀胱癌细胞株5637、EJ、J82由北京大学泌尿外科研究所提供。SV-HUC-3细胞株购自美国ATCC公司。Ham’s F-12培养基和DMEM 培养基购自北京中杉金桥生物技术有限公司。RPMI1640培养基和胎牛血清购自美国Hyclone公司。脂质体LipofectamineTM2000 转染试剂盒购自美国Invitrogen 公司。兔抗人多克隆抗体KPNA2购自英国Abcam公司,兔抗人多克隆抗体GAPDH 购自美国Santa Cruz 公司。pcDNA3.1(+)-KPNA2过表达质粒购自上海吉玛制药技术有限公司。CCK-8(cell counting kit-8)试剂盒购自日本Dojindo公司。BCA蛋白定量检测试剂盒购自美国Thermo公司。免疫组织化学检测试剂盒购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 靶向KPNA2干扰质粒的设计和合成 根据GenBank提供的人KPNA2基因序列(序列号:NM_002266),按照小干扰RNA(small interfering RNA,siRNA)设计原则,由上海吉玛制药技术有限公司化学合成2对siRNA序列,通过GenBank数据库中的BLAST序列比对,确定所选序列与其他基因无同源性,为特异性序列。同时合成1对阴性对照序列,5′端标记荧光素FAM,即siRNA-NC-FAM,评价siRNA转染的效率。序列见表1。
表1 KPNA2 siRNA序列
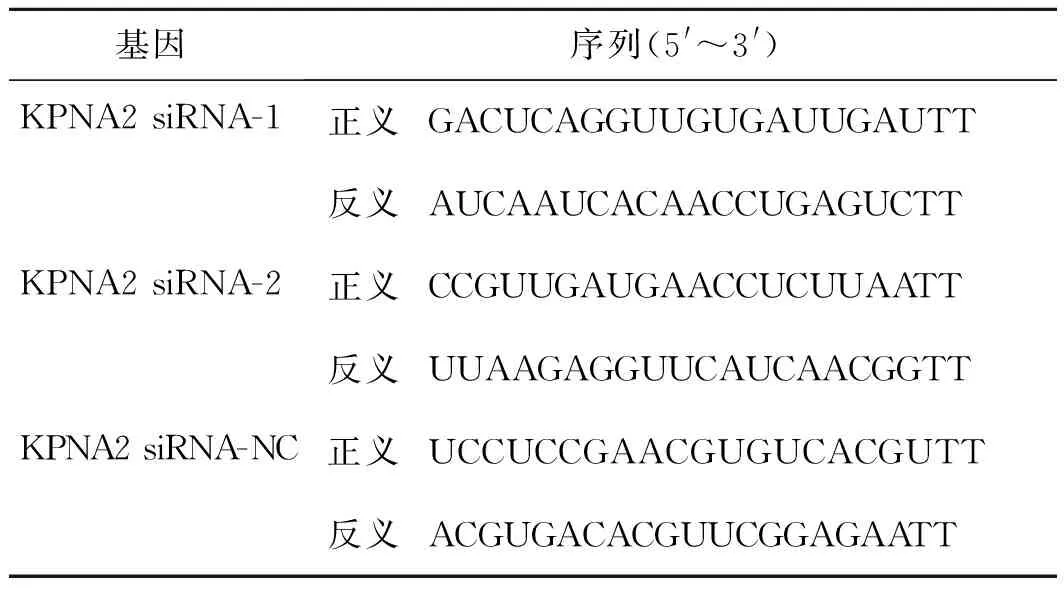
基因序列(5'~3')KPNA2siRNA-1正义GACUCAGGUUGUGAUUGAUTT反义AUCAAUCACAACCUGAGUCTTKPNA2siRNA-2正义CCGUUGAUGAACCUCUUAATT反义UUAAGAGGUUCAUCAACGGTTKPNA2siRNA-NC正义UCCUCCGAACGUGUCACGUTT反义ACGUGACACGUUCGGAGAATT
1.2.2 细胞培养和转染 将冷冻保存于液氮中的膀胱癌细胞株5637、J82、EJ和正常尿路上皮细胞株SV-HUC-3复苏后,分别接种于含10%(体积分数)胎牛血清的RPMI1640、DMEM和Ham’s F-12培养基中,加入终浓度各为100 U/mL的青霉素和100 μg/mL的链霉素,在37℃、5%CO2细胞培养箱内生长,胰酶消化细胞传代。取对数生长期细胞进行实验,调整细胞浓度,接种至6孔培养板,每孔约1×106个细胞,细胞生长至80%~90%融合时,采用脂质体LipofectamineTM2000方法进行转染,整个转染步骤严格按照说明书进行。实验设2个组: 质粒转染组[采用KPNA2 siRNA干扰质粒或pcDNA3.1(+)-KPNA2过表达质粒转染]、阴性对照组(采用无关序列RNA 转染),每组设置3个复孔。转染前后、倒置显微镜下观察细胞形态。
1.2.3 蛋白质印迹法检测不同细胞株中KPNA2蛋白表达 取对数生长期的各组细胞,加入RIPA裂解缓冲液提取细胞总蛋白,BCA 法进行蛋白质定量,取等量总蛋白用10%(体积分数) SDS聚丙烯酰胺凝胶电泳分离,PVDF膜进行转膜,5%(体积分数)脱脂牛奶-TBST封闭液室温反应1 h后,分别加入1∶1 000稀释的兔抗人多克隆抗体KPNA2、兔抗人多克隆抗体GAPDH(内参照)。4℃ 反应过夜。TBST 洗膜3次,将洗涤后的一抗反应膜放入二抗工作液中作用1 h。暗室中ECL 试剂盒显色,拍照,采用美国 UVP 分析仪器,对胶片进行扫描,比较各组灰度变化。实验重复 2 次。
1.2.4 蛋白质印迹法检测5637细胞干扰前后KPNA2蛋白表达 收集转染后48 h的5637细胞,加入RIPA裂解缓冲液提取细胞总蛋白,BCA 法测定蛋白质浓度,取等量总蛋白用10% SDS聚丙烯酰胺凝胶电泳分离,PVDF膜进行转膜,5%脱脂牛奶-TBST封闭液室温反应1 h后,分别加入1∶1 000稀释的兔抗人多克隆抗体KPNA2、兔抗人多克隆抗体GAPDH(内参照)。余实验步骤同1.2.3。
1.2.5 CCK-8法检测5637细胞干扰前后细胞增殖活性 取对数生长期的5637细胞,2 000个/孔细胞的密度接种于96孔细胞培养板中,用不含抗生素的细胞培养液进行培养;次日,当5637细胞融合度达30% ~50% 时,采用脂质体LipofectamineTM2000方法进行转染,每组取4个重复孔。分别在转染后24、48、72、96 h,按 CCK-8 试剂盒说明书提供的方法检测细胞增殖活性,于各时间点检测前更换培养液,加入100 μL/孔培养液和10 μL/孔CCK-8试剂,细胞继续培养2 h。在酶联免疫检测仪上检测450 nm波长处各孔的吸光度(A)值。
2 结 果
2.1 KPNA2在不同膀胱癌细胞株中的蛋白表达如图1所示,在正常尿路上皮细胞株SV-HUC-3中KPNA2蛋白表达水平较低,在各组膀胱癌细胞株(EJ、5637、 J82)中,KPNA2蛋白表达均不同程度升高。

图1 不同膀胱癌细胞株中KPNA2蛋白表达
2.2 转染siRNA和过表达质粒对膀胱癌5637细胞KPNA2蛋白水平的影响选取KPNA2高表达的膀胱癌5637细胞株为研究对象,将KPNA2 siRNA干扰质粒和pcDNA3.1(+)-KPNA2过表达质粒转染膀胱癌5637细胞。48 h后,分别提取转染组和阴性对照组的蛋白质进行蛋白印迹法检测。
与阴性对照组比较,KPNA2 siRNA干扰质粒转染5637细胞后,转染组KPNA2蛋白表达水平显著下降(图2A、2B),pcDNA3.1(+)-KPNA2过表达质粒转染5637细胞后,转染组KPNA2蛋白表达水平明显升高(图2C、2D),差异有统计学意义(P<0.05)。
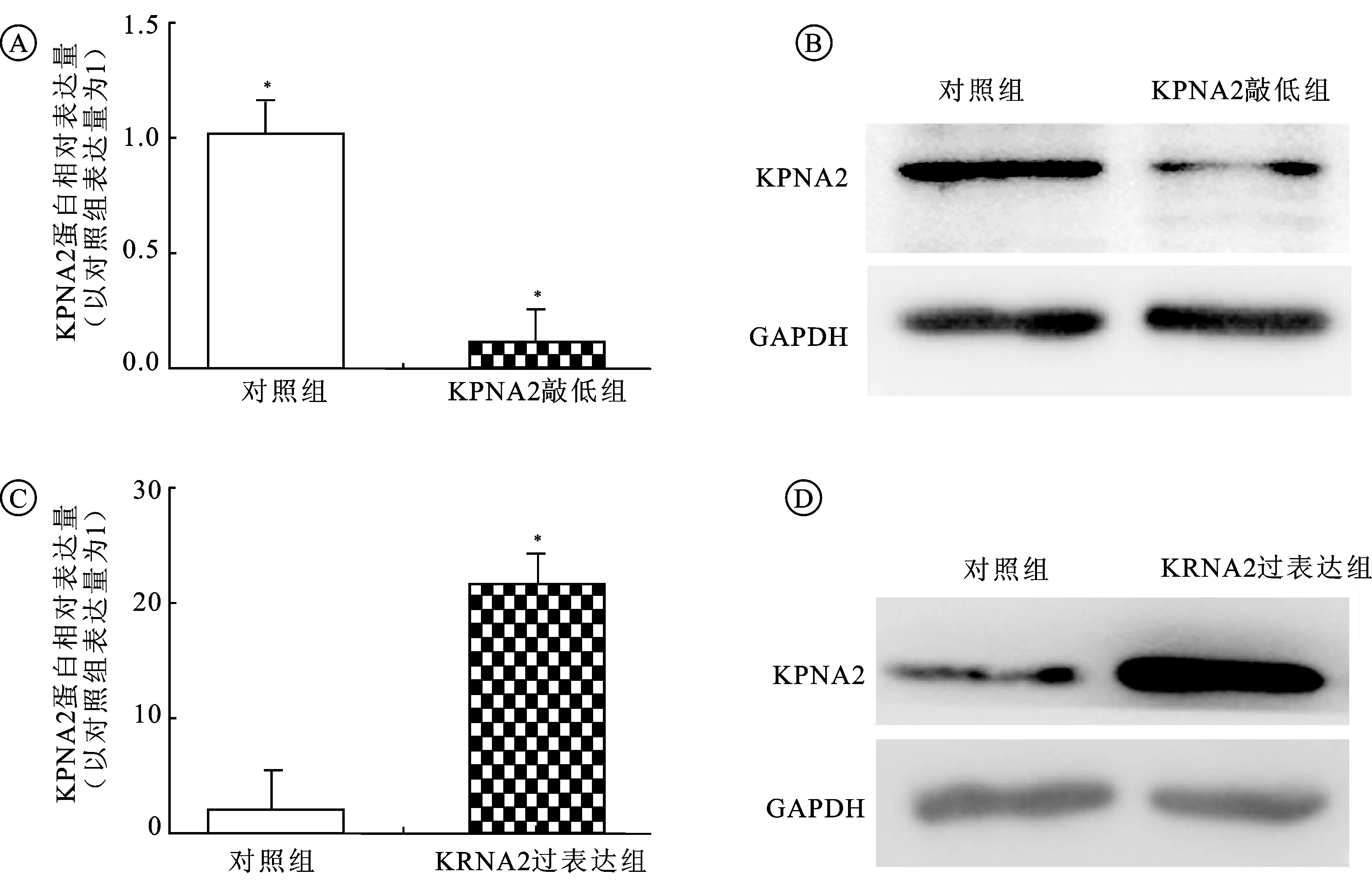
图2 蛋白印迹法检测膀胱癌5637细胞KPNA2蛋白表达
A,B: KPNA2在敲低组及对照组灰度定量和蛋白表达;C,D :KPNA2在过表达组及对照组灰度定量和蛋白表达。
2.3 转染siRNA和过表达质粒对膀胱癌5637细胞增殖能力的影响取转染后对数期生长期的各组细胞,检测细胞的增殖能力。结果发现,KPNA2 siRNA干扰质粒转染5637细胞后,转染组细胞增殖活性明显受到抑制(图3A)。pcDNA3.1(+)-KPNA2过表达质粒转染5637细胞后,转染组细胞增殖活性明显增强(图3B),差异有统计学意义(P<0.05)。
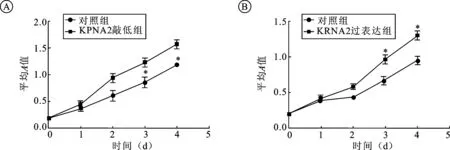
图3 沉默和过表达KPNA2对膀胱癌5637细胞增殖能力的影响
A:KPNA2在敲低组及对照组细胞增殖能力变化;B:KPNA2在过表达组及对照组细胞增殖能力变化。
3 讨 论
膀胱癌在我国泌尿系统肿瘤中发病率和死亡率均居首位,随着社会老龄化程度加剧,其发病率、死亡率呈逐年上升趋势[2]。90%以上膀胱癌源自于移行上皮,具有易复发和进展的特点。在首诊的膀胱癌患者中肌层浸润性膀胱癌约占30%,其中33%的患者在接受首次治疗时已发生远处转移,25%的患者在根治性膀胱切除术过程中发现有淋巴浸润,术后约50%的患者在2年内发生远处转移,5年生存率不到40%[3-4]。因此,早期诊断和阻止膀胱癌的进展和转移是当前研究的热点之一。
随着分子生物学研究的进展,尤其是cDNA技术的应用,目前己经明确多种与膀胱癌发生和发展相关的分子标志物。核转运蛋白基因2(karyopherin a2,KPNA2)就是本实验室早期利用cDNA芯片技术,结合文献挖掘的生物信息学方法,筛选出的一个与膀胱癌进展密切相关的新基因,并在膀胱癌中对相关基因进行深入研究[5-6]。
KPNA2基因位于染色体17q23-q24,mRNA全长1 981 bp,其编码产物是含529个氨基酸的蛋白质。Karyopherin a2蛋白是karyopherin a/importin a输入蛋白家族一员,是一种进化上保守的核转运蛋白[1]。已知大多数细胞内信号传导通路的最后的主要步骤之一是核浆通讯,即细胞质中的一些蛋白质(如转录因子)进入细胞核并在核内调节效应基因或其他信号分子的表达。细胞质内的分子要想穿过核膜进入细胞核,必须通过核孔复合物。小分子例如离子和分子量小于20~40 ku的蛋白,能通过扩散作用直接穿过核孔复合物;而分子量大于40 ku的蛋白,必须借助一些核转运蛋白的帮助才能通过核孔。目前已经发现了很多核转运蛋白,例如karyopherin a2(KPNA2)、Ran/TC4、importin β等[7]。
由于KPNA2基因是新近发现的一个候选癌基因,目前关于该基因在肿瘤中的研究主要集中在乳腺癌、食管癌、卵巢癌[8-10],而且主要是有关临床病理特征或预后关系的研究。关于KPNA2基因在肿瘤中的确切分子机制目前尚不清楚,对于其表达调控的机制研究较少。有研究发现,KPNA2与c-Jun、E2F1、Rac1、OCT4等基因的异常表达或失活有关[11-12],可能参与肿瘤细胞的增殖和侵袭[13]。
在前期研究中,我们采用基因芯片技术筛选非肌层浸润性膀胱癌和肌层浸润性膀胱癌的差异表达基因,筛选到KPNA2基因在膀胱癌中高表达。在正在进行的上尿路移行细胞癌的肿瘤标记物的研究中,我们使用组织芯片技术同样检测到了该基因在肾盂癌和输尿管癌中存在差异表达,并且与上尿路肿瘤的不良预后以及术后继发膀胱癌有关。JENSEN等[14]研究也发现膀胱癌中KPNA2差异表达与非肌层浸润性膀胱癌的进展和行根治性膀胱切除术的肌层浸润性膀胱癌患者的不良预后有关,提示该基因可能与移行细胞癌的发生、发展过程有关。本研究选用适度表达KPNA2的人膀胱癌5637细胞系作为细胞模型进行相关功能研究。设计并合成靶向KPNA2的siRNA干扰质粒和过表达质粒,通过脂质体转染方法转染5637细胞,结果发现,与阴性对照组比较,KPNA2 siRNA干扰质粒转染5637细胞后,转染组细胞KPNA2和PCNA蛋白表达水平显著下降,细胞增殖活性明显受到抑制。pcDNA3.1(+)-KPNA2过表达质粒转染5637细胞后,转染组细胞KPNA2蛋白表达水平显著升高,细胞增殖能力明显增强。
综合上述,KPNA2基因的表达水平与膀胱癌5637细胞异常的增殖能力有关。以KPNA2作为抑制膀胱癌生长和转移的期望靶点,通过RNAi技术沉默KPNA2基因表达,阻止肿瘤生长,可能是肿瘤基因治疗的途径之一。
[1] GOUSIAS K, BECKER AJ, SIMON M, et al. Nuclear karyopherin a2: a novel biomarker for infiltrative astrocytomas [J]. J Neurooncol, 2012, 109(3):545-553.
[2] 韩苏军,张思维,陈万青,等.中国膀胱癌发病现状及流行趋势分析[J].癌症进展,2013,11(1):89-95.
[3] WITJES JA, COMPERAT E, COWAN NC, et al.Guidelines on muscle-invasive and metastatic bladder cancer [J]. Eur Urol, 2014, 65(4): 778-792.
[4] GSCHWEND JE, DAHM P, FAIR WR.Disease specific survival as endpoint of outcome for bladder cancer patients following radical cystectomy [J]. Eur Urol, 2002, 41(4):440-448.
[5] 史本涛,周亮,王盛兴,等.人膀胱浅表性移行细胞癌基因表达变化的基因芯片研究[J]. 现代泌尿外科杂志,2008,13(4):275-278.
[6] 周梁,史本涛,王盛兴,等.表浅性与浸润性膀胱癌基因表达谱的比较[J].中华医学杂志,2008,7(12):798-801.
[7] PAULINE J, VAN DW, ELLEN N, et al. Overexpression of Kpnβ1 and Kpnα2 importin proteins in cancer derive from deregulated E2F activity [J]. PLoS One, 2011, 6(11):1-9.
[8] NOETAEL E, ROSE M, BORNEMANN J, et al. Nuclear transport receptor karyopherin-α2 promotes malignant breast cancer phenotypes in vitro [J]. Oncogene, 2012, 31(16):2101-2014.
[9] MA S, ZHAO X. KPNA2 is a promising biomarker candidate for esophageal squamous cell carcinoma and correlates with cell proliferation [J]. Oncol Rep, 2014, 4:100-107.
[10] HE L, DING H, WANG JH, et al.Over expression of karyopherin 2 in human ovarian malignant germ cell tumor correlates with poor prognosis [J]. PLoS One, 2012, 7(9):e42992.
[11] WANG CI, CHIEN KY, WANG CL, et al. Quantitative proteomics reveals regulation of KPNA2 and its potential novel cargo proteins in non-small cell lung cancer [J]. Mol Cell Proteomics, 2012, 11(11):1105-1122.
[12] SANDROCK K, BIELEK H, SCHRADI K, et al. The nuclear import of the small GTPase Rac1 is mediated by the direct interaction with karyopherin alpha2 [J]. Traffic, 2010, 11(2):198-209.
[13] WANG CI, WANG CL,WANG.CW,et al.Importin subunit alpha-2 is identified as a potential biomarker for non-small cell lung cancer by integration of the cancer cellsecretome and tissue transcriptome [J]. Int J Cancer, 2011, 128(10):2364-2372.
[14] JENSEN JB, MUNKSGAARD PP, SØRENSEN CM,et al. High expression of karyopherin-α2 defines poor prognosis in non-muscle-invasive bladdercancer and inpatients with invasive bladder cancer undergoing radicalcystectomy [J]. Eur Urol, 2011, 59(5):841-848.
(编辑 何宏灵)
Effect of KPNA2 gene silence and overexpression on proliferation of human bladder cancer cell lines 5637
SHI Ben-tao1,2, SU Bo-xing1,2, FANG Dong1,2, HE Qun1,2, LI Xue-song1,2, ZHOU Li-qun1,2
(1. Department of Urology, the First Hospital of Peking University, 2. Institute of Urology, Peking University, 3. Department of Urological Pathology, the First Hospital of Peking University, Beijing 100034, China)
Objective To observe the effect of KPNA2 gene silence and overexpression on the proliferation of bladder cancer cell lines 5637. Methods KPNA2 siRNA interfering plasmid and pcDNA3.1 (+)-KPNA2 overexpression plasmid were transiently transfected in vitro into human bladder cancer cell lines 5637 using LipofectamineTM2000. The expression of KPNA2 protein was detected with Western blot assay 48 hours after transfection. The proliferation of bladder cancer cell lines 5637 was evaluated with CCK-8 method in vitro. The variation of cell proliferation after KPNA2 gene silencing and overexpression was assessed with cell growth curve. Results Compared with the negative control group, in the siRNA transfected group, the expression of KPNA2 protein was significantly decreased, and the proliferation of cells was markedly suppressed (P<0.05). However, in the pcDNA3.1(+)-KPNA2 transfected group, the expression of KPNA2 protein was significantly increased, and the proliferation of cells was obviously enhanced (P<0.05). Conclusion The silence and overexpression of KPNA2 gene can modulate the proliferation of human bladder cancer cell lines 5 637, which provides a new therapeutic target for the clinical treatment of bladder cancer.
bladder cancer; KPNA2; RNA interference; overexpression; proliferation
2014-10-09
2014-11-26
国家自然科学基金(No:81372746);北京自然科学基金(No:7122183);广东省医学科研基金(No:A2014653);深圳市科技计划项目(No:201302052)
周利群,教授,医学博士.E-mail:zhoulqmail@china.com
史本涛(1977-),男(汉族),医学博士,主要从事泌尿系统肿瘤的临床研究工作.E-mail:shibentaopku@126.com.
Q737.14
A
10.3969/j.issn.1009-8291.2015-03-015
