子宫内膜癌中TβRⅠ和TβRⅡ基因甲基化状态
2015-04-04闫香庭刘盼蔺会兰
闫香庭 刘盼 蔺会兰
在世界范围内,子宫内膜癌在女性肿瘤中排第七位,此病患者数量呈持续性增长,其中包括年轻女性。虽然许多子宫内膜癌表现为雌激素依赖性增殖,但是其致癌机制尚不清楚或尚未完全阐明。多种基因及信号转导通路的改变在恶性肿瘤的发生、发展和转移中发挥了重要的作用,转化生长因子 β(transforming growth factor-β,TGF-β)信号传导途径便是其中之一。TGF-β调控多种基因的表达,在细胞分化、增殖和凋亡中发挥着重要作用,其受体Ⅰ、Ⅱ(TβRⅠ、Ⅱ)在多种恶性肿瘤组织中表达下降或缺失。导致基因失活的机制主要包括基因突变和表观遗传学修饰,其中表观遗传学修饰中的启动子区高甲基化已被认为是与遗传性缺陷同等重要的分子生物学机制。本研究应用改进的甲基化特异性聚合酶链式反应(MSP),对子宫内膜癌组织中TβRⅠ、Ⅱ两基因启动子甲基化状态进行检测,并对两基因甲基化状态与临床指标之间的关系进行探讨。
1 资料与方法
1.1 一般资料 收集2012年8月至2014年3月在我院手术切除的子宫内膜癌组织标本60例和癌旁正常组织60例。所取标本均在液氮中冷冻保存。患者年龄36~69岁,平均年龄51.4岁。所取子宫内膜癌标本经病理确认均为子宫内膜样腺癌。按FIGO(2000年)标准进行手术-病理分期,Ⅰ、Ⅱ期37例,Ⅲ、Ⅳ期23例;有淋巴结转移24例,无淋巴结转移36例;高、中分化49例,低分化11例。所有患者术前均未做放化疗。
1.2 主要试剂 Wizard DNA纯化试剂盒购于Promega公司,亚硫酸氢盐和对苯二酚(氢醌)购于Sigmaaldrich公司,PCR引物购于上海捷瑞生物技术有限公司。
1.3 方法
1.3.1 TβRⅠ、TβRⅡ基因甲基化状态的检测:采用酚/氯仿抽提法提取子宫内膜癌组织及癌旁正常组织中的DNA,将提取的DNA进行亚硫酸盐处理,DNA单链中未甲基化的胞嘧啶(C)在亚硫酸盐的作用下脱去氨基转变成尿嘧啶(U),而发生甲基化的胞嘧啶在甲基的保护下未发生任何改变。然后用Wizard DNA纯化试剂盒对处理过的DNA进行纯化。
1.3.2 用甲基化特异性引物(M)和非甲基化特异性引物(U)[1,2]对所有标本的纯化 DNA 进行扩增:TβRⅠ的非甲基化引物(5’-3’)为:CAACCCTCCAAAACTAACAACTAAACAA TGTTGGTTTTTGGTTATGTTTTATGTTTTTT,PCR反应体系为95℃预变性12 min,95℃45 s,55℃ 45 s,72℃ 1 min,40 个循环,最后 72℃延伸10 min。TβRⅠ的甲基化引物(5’-3’)为:ACCCTCCGAAACTAACGACTAAACGA CGGTTTTTGGTTACGTTTTACGTTTTT,PCR反应体系为95℃预变性12 min,95℃45 s,47℃ 45 s,72℃ 1 min,40 个循环,最后72℃延伸10 min。TβRⅡ的非甲基化引物(5’-3’)为:TTGAAAGTTGGTTAAAGTTTTTGGA AAACAAAACCTCTCTCCACCCA,PCR反应体系为95℃预变性12 min,95℃ 45 s,50℃ 45 s,72℃ 1 min,40 个循环,最后72℃延伸 10 min。TβRⅡ的甲基化引物(5’-3’)为:GAAAGTCGGTTAAAGTTTTCGGA ACAAAACCTCTC TCCGCCCG,PCR反应体系为95℃预变性12 min,95℃45 s,48℃ 45 s,72℃ 1 min,40 个循环,最后72℃延伸10 min。反应的产物均进行琼脂糖凝胶电泳。甲基化的阳性对照为甲基化酶处理后的正常人外周血DNA,非甲基化的阳性对照为正常人外周血DNA,阴性对照为双蒸水。见图1。
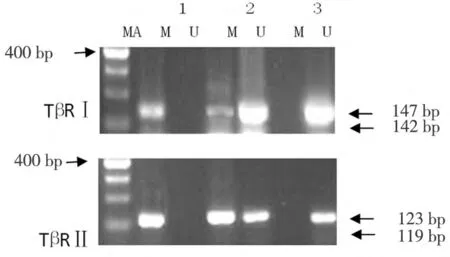
图1 TβRⅠ、Ⅱ基因甲基化结果
1.4 统计学分析 应用SPSS 17.0统计软件,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 子宫内膜癌及癌旁正常组织中TβRⅠ、TβRⅡ基因甲基化状态比较 TβRⅠ在子宫内膜癌组织和癌旁正常组织的甲基化率分别为75.0%(45/60)和45.0%(27/60),子宫内膜癌组织的甲基化率显著高于癌旁正常组织(χ2=11.250,P=0.001)。TβRⅡ在子宫内膜癌组织和癌旁正常组织的甲基化率分别为68.3%(41/60)和36.7%(22/60),子宫内膜癌组织的甲基化率显著高于癌旁正常组织(χ2=12.063,P=0.000)。见表1。

表1 子宫内膜癌及癌旁正常组织中TβRⅠ、TβRⅡ基因甲基化状态比较 n=60,例(%)
2.2 TβRⅠ、TβRⅡ基因甲基化与临床指标之间的关系 子宫内膜癌组织TβRⅠ基因甲基化与临床分期、病理分级和有无淋巴结转移等因素差异无统计学意义(P>0.05)。子宫内膜癌组织TβRⅡ基因甲基化与临床分期、病理分级和有无淋巴结转移等因素差异无统计学意义(P>0.05)。见表2。

表2 子宫内膜癌中TβRⅠ、TβRⅡ基因甲基化与临床指标间的关系例
3 讨论
随着人们生活方式的改变和环境因素的影响,子宫内膜癌的发病人数逐年增长,严重威胁着广大女性的健康。恶性肿瘤的发生发展是一个复杂的过程,其中涉及到基因的异常和表观遗传学改变,表观遗传学修饰最大的特点是它是可逆的,可以通过改变其修饰状态来改变基因的表达。表观遗传修饰主要包括DNA甲基化、组蛋白修饰和基因印迹,其中基因启动子区CpG岛甲基化是导致肿瘤发生过程中抑癌基因失活的重要机制。DNA甲基化是指S-腺苷甲硫氨酸(SAM)中的甲基在甲基化转移酶的作用下被转移到胞嘧啶第5位碳原子上,进而使胞嘧啶变成5-甲基胞嘧啶。甲基化的胞嘧啶通常发生在富含CpG二联核苷的CpG岛上。通常情况下CpG岛位于基因的启动子区域。正常状态下,启动子区域CpG岛是不发生甲基化的,但是在某些因素作用下发生甲基化后,其下游的基因便会发生转录沉寂。现已发现,许多种基因的甲基化都与子宫内膜癌的发生发展有关系[3-5],而关于TGF-β受体Ⅰ、Ⅱ甲基化与子宫内膜癌发生发展之间的关系笔者还鲜见有报道。
TGF-β是一种重要的多功能细胞因子,通过自分泌和旁分泌的方式调控细胞的增殖、分化和凋亡,而这些重要作用的发挥必须通过与其细胞表面的受体结合才能实现。TGF-β作为配体首先与受体Ⅱ(TβRⅡ)相结合,结合后形成的复合物使TGF-β发生构象的改变,因而被受体Ⅰ(TβRⅠ)所识别,进而形成TGF-β-TβRⅡ-TβRⅠ复合体,活化的TβRⅡ可发挥丝氨酸/苏氨酸磷酸转移酶的作用激活TβRⅠ,活化的TβRⅠ可以将信号向细胞内传递,从而发挥生物学效应。
TGF-β信号传导通路的异常在多种肿瘤的发生过程中起到了关键性作用,TGF-β本身就是一种抵抗细胞增殖的因素,但是在一些肿瘤组织中其抑制作用显得尤其微弱,这与肿瘤细胞上的TGF-β受体表达量减少或缺失有很大关系。有研究指出,与癌旁正常组织相比,食管鳞状细胞癌中TβRⅠ、TβRⅡ两基因的mRNA表达均明显降低,说明其表达下降与肿瘤的发生有密切关系[6]。袁明等[7]用免疫组化的方法对正常胃黏膜、肠化生、不典型增生及胃癌中TβRⅠ、Ⅱ基因表达进行了检测,发现两基因的表达呈递减趋势。Borczuk等[8]研究发现,TβRⅡ表达抑制是肺腺癌进展的重要原因,缺失此基因的肺腺癌小鼠淋巴结高度转移,其存活率也明显下降。
研究证明,TβRⅠ、Ⅱ在肿瘤组织中表现为表达下调或缺失[9,10],这可能与基因启动子区甲基化有关。Guo等[11]研究发现,TβRⅠ、TβRⅡ两基因在贲门腺癌中的甲基化率明显高于相应的正常组织,而且其高甲基化率与mRNA和蛋白的表达下降或缺失有关。Dong等[12]对食管鳞状细胞癌的研究也发现,TβRⅠ、TβRⅡ基因高甲基化与其mRNA和蛋白的表达减少相关。Chen等[13]发现,B 细胞淋巴瘤中的 TβRⅡ基因表达缺失可以用5-氮杂胞苷逆转,这表明启动子区甲基化可能是引起基因沉默的原因。另外,也有研究显示,在高度微卫星不稳定性结直肠癌中TβRⅡ的基因突变与CpG岛高甲基化表型有直接关系[14]。
以上研究结果与我们的实验结果相似。本研究发现TβRⅠ在子宫内膜癌组和癌旁正常组的甲基化率分别为75.0%(45/60)和 45.0%(27/60),子宫内膜癌组的甲基化率显著高于癌旁正常组;TβRⅡ在子宫内膜癌组和癌旁正常组的甲基化率分别为68.3%(41/60)和36.7%(22/60),子宫内膜癌组的甲基化率亦显著高于癌旁正常组,以上结果提示这两种基因的甲基化与子宫内膜癌的发生有关。但是我们对子宫内膜癌按病理分级,临床分期和有无淋巴结转移进行分组比较后,发现这两种基因的甲基化与这些指标并无相关性,这提示TβRⅠ、TβRⅡ基因甲基化可能不是导致子宫内膜癌发展转移的因素。
此外,尚存在一些结果不同的研究。Hinshelwood等[15]对乳腺癌细胞株研究后发现,TβRⅠ、TβRⅡ基因启动子区CpG岛甲基化不是导致其表达受到抑制的原因。Yamashita等[16]研究指出,在鼠前列腺癌细胞株中存在TβRⅡ启动子区高甲基化,而在人前列腺癌组织中不存在此基因启动子的甲基化。还有研究对非小细胞肺癌进行了分析,发现TβRⅠ在31.4%的肺癌组织中表达降低或缺失,推测此现象是导致肿瘤发生的原因之一。但是在此基因的启动子区未发现基因甲基化,这提示TβRⅠ的表达缺失或降低可能与启动子甲基化无关[17]。
我们分析导致其结果有差异的原因主要与肿瘤异质性有关,各种类型的肿瘤其发生甲基化的基因及甲基化状态都是存在差异的。另外,各研究所选的甲基化位点有差异,这也是造成结论不同的原因之一。
分析基因的甲基化状态在肿瘤的早期诊断方面有极其重要的意义,一些基因的甲基化表现为肿瘤特异性,同时一些肿瘤拥有特异的甲基化基因。有研究已经证明可以从结直肠癌患者的粪便中,肺癌患者的痰液中,肾癌、膀胱癌患者的尿液中检测出基因的甲基化状态[14]。同样,可以取子宫内膜癌患者的分泌物进行甲基化分析,对脱落细胞的检测可以对实体肿瘤的早期诊断做到无创处理,与传统的诊断性刮宫相比,很大程度地降低了医源性创伤。另外,检测血液中基因的甲基化状态也是未来的发展方向之一。基因甲基化先于细胞的恶性增生,因此对甲基化的检测可以早期预测肿瘤的发生,并进行有效的干预。基因的甲基化状态是一种可逆的表观遗传学改变,5-氮杂胞苷作为一种甲基化转移酶抑制剂,可以逆转基因CpG岛的甲基化状态,从而恢复基因的表达活性。应用甲基化转移酶抑制剂重新激活抑癌基因的活性,可能会成为晚期肿瘤患者的潜在治疗选择。
我们对子宫内膜癌中TβRⅠ、TβRⅡ基因启动子区的高甲基化状态进行的研究,可以提供新的基因靶向治疗位点,并为子宫内膜癌的早期诊断治疗提供一种分子指标。随着对表观遗传学的深入研究,不久的将来,肿瘤的表观遗传学治疗将成为肿瘤综合治疗的主要组成部分,并且会在降低肿瘤复发和转移方面发挥重要的作用。
1 Zhang HT,Chen XF,Wang JC,et al.Defective expression of transforming growth factor beta receptor type II is associated with CpG methylated promoter in primary non-small cell lung cancer.Clin Cancer Res,2004,10:2359-2367.
2 Zhang Q,Rubenstein JN,Jang TL,et al.Insensitivity to transforming growth factor-beta results from promoter methylation of cognate receptors in human prostate cancer cells(LNCaP).Mol Endocrinol,2005,19:2390-2399.
3 Muraki Y,Banno K,Yanokura M,et al.Epigenetic DNA hypermethylation:clinical applications in endometrial cancer(Review).Oncol Rep,2009,22:967-972.
4 Banno K,Kisu I,Yanokura M,et al.Epigenetics and genetics in endometrial cancer:new carcinogenic mechanisms and relationship with clinical practice.Epigenomics,2012,4:147-162.
5 Banno K,Yanokura M,Iida M,et al.Carcinogenic mechanisms of endometrial cancer:involvement of genetics and epigenetics.J Obstet Gynaecol Res.2014,40:1957-1967.
6 刘盼,董稚明,董玉然,等.食管癌 TβRⅠ和 TβRⅡ基因甲基化及mRNA表达的相关性研究.中华肿瘤防治杂志,2010,48:1199-1202.
7 袁明,胡元龙.Ⅰ型、Ⅱ型和Ⅲ型TGF-β受体在胃癌及癌前病变中的表达.石河子大学学报,2004,22:7-10.
8 Borczuk AC,Sole M,Lu P,et al.Progression of human bronchioloalveolar carcinoma to invasive adenocarcinoma is modeled in a transgenic mouse model of k-ras-induced lung cancer by loss of the TGF-beta type II receptor.Cancer Research,2011,71:6665-6675.
9 Tian MZ,Jason JR,Schiemann WP.Transforming growth factor-β and the hallmarks of cancer.Cell Signal,2011,23:951-962.
10 Sakaquchi J,Kyo S,Kanaya T,et al.Aberrant expression and mutations of TGF-beta receptor type II gene in endometrial cancer.Gynecol Oncol,2005,98:427-433.
11 Guo W,Dong Z,Guo Y,et al.Concordant repression and aberrant methylation of transforming growth factor-beta signaling pathway genes occurs early in gastric cardia adenocarcinoma.Mol Biol Rep,2012,39:9453-9462.
12 Dong Z,Guo W,Guo Y,et al.Concordant promoter methylation of transforming growth factor-beta receptor types I and II occurs early in esophageal squamous cell carcinoma.Am J Med Sci,2012,343:375-381.
13 Chen G,Ghosh P,Osawa H,et al.Resistance to TGF-β1 correlates with aberrant expression of TGF-β receptor II in human B-cell lymphoma cell lines.Blood,2007,109:5301-5307.
14 Oqino S,Kawasaki T,Oqawa A,et al.TGFBR2 mutation is correlated with CpG island methylator phenotype in microsatellite instability-high colorectal cancer.Hum Pathol,2007,38:614-620.
15 Hinshelwood RA,Huschtscha LI,Melki J,et al.Concordant epigenetic silencing of transforming growth factor-β signaling pathway genes occurs early in breast carcinogenesis.Cancer Res,2007,67:11517-11527.
16 Yamashita S,Takahashi S,McDonell N,et al.Methylation silencing of transforming growth factor-beta receptor type II in rat prostate cancers.Cancer Res,2008 ,68:2112-2121.
17 Zhao J,Liu Z,Li W,et al.Infrequently methylated event at sites-362 to-142 in the promoter of TGF beta R1 gene in non-small cell lung cancer.J Cancer Res Clin Oncol,2008,134:919-925.
