多发性骨髓瘤患者 DAPK的表达及启动子区甲基化状态的研究
2015-04-02游崇登何勤刘琳朱鸿斌汤宏宇张利娟贺振新
游崇登 何勤 刘琳 朱鸿斌 汤宏宇 张利娟 贺振新
多发性骨髓瘤(multiple myeloma,MM)是浆细胞的恶性肿瘤。是多发于老年患者的一种血液系统恶性疾病,其自然病程具有高度异质性,中位生存期为3~4年。随着硼替佐米等蛋白酶体抑制剂及沙利度胺、雷利度胺等免疫调节剂的临床应用,MM的完全缓解率(complete remission,CR)及总生存期(overall survival,OS)有了显著提高,但复发、难治仍是临床面临的巨大难题,至今MM仍是一种无法治愈的疾病。DNA甲基化是血液肿瘤抑癌基因失活的常见机制。死亡相关蛋白激酶(death-associated protein kinase,DAPK)是Deiss等[1]在功能性基因克隆中首先发现的一种抑癌基因,其位于人类第9号染色体的q34.1,编码序列全长4 293 bp,广泛参与多种途径介导的细胞凋亡。DAPK具有参与细胞凋亡、抑制细胞迁移等生物学功能。DAPK基因启动子区甲基化对疾病的进展及预后影响不一。本文采用实时荧光定量聚合酶链反应(RT-PCR)及甲基化特异性聚合酶链反应(MSP)技术,从DNA甲基化和基因表达的方面研究MM患者及对照组的骨髓单个核细胞中DAPK基因启动子区甲基化阳性率及其mRNA的表达水平,探讨它们之间可能存在的关系及与临床特征的相关性,并研究DAPK基因在MM发生发展中的作用。
1 资料与方法
1.1 一般资料 选取2009年1月至2011年6月确诊的54例多发性骨髓瘤患者骨髓标本为实验组,标本来自昆明医科大学附属第一医院血液科和附属第二医院血液科,其中男35例,女19例;年龄38~79岁,平均年龄(63±9)岁,中位年龄64岁。包括初诊患者27例,复发患者27例。Druie-Salmon分期:Ⅰ期A组2例,Ⅱ期A组16例,Ⅱ期B组4例,Ⅲ期A组19例,Ⅲ期B组13例。分型:lgG型26例,lgA型14例,未分泌型9例,轻链型5例。所有病例诊断均符合标准[2]。对照组为非血液肿瘤患者骨髓标本(主要为营养不良性性贫血和免疫性血小板减少症患者)40例。
1.2 方法
1.2.1 主要试剂与仪器:DNA提取试剂盒,RNA提取试剂盒为杭州Axygen Bioscigens公司产品。EZ DNA Methylation-GoldTM Kit,Zymo Taq PreMix TM Kit为美国ZYMO Research公司产品。TRIzol Reagent抽提液,Platinum SYBR Green qPCR SuperMix-UDG Kit等购自美国Invitrogen公司。PCR扩增仪,qPCR扩增仪和全自动凝胶图像分析仪均为美国Bio-rad公司的产品。
引物设计目前通常选择“MethPrimer”程序,对目的基因转录起始位点上游2 000 bp内CpG岛位进行引物设计。“MethPrimer”设计程序默认的 CpG岛跨度至少为200 bp,GC含量>50%,CpG出现频率>0.6。因此,符合这些参数的区域都默认为 CpG岛。我们可以根据任意1个CpG岛设计引物进行扩增。本文的DAPK基因甲基化引物来自文献[3],由上海invitrogen公司合成引物,用去离子水溶解为25 μmol/L,-20℃保存备用。见表1。

表1 MSP引物信息
1.2.2 标本的收集及处理:采集实验组及对照组的骨髓标本,并进行骨髓单个核细胞(MNC)的分离,用PBS缓冲液稀释细胞数至1×108/ml,分别分装到去RNA酶的 Eppendorf管中,-80℃ 保存备用。
1.2.3 MSP法检测DAPK基因甲基化的状态:提取基因组DNA:基因组DNA的亚硫酸氢盐修饰操作步骤按试剂盒说明书进行。MSP扩增:DAPK甲基化上游引物:5'-GGATAGTCGGATCGAGTTAACGTC-3',下游引物:5'-CCCTCCCAAACGCCGA-3',扩增片段长度为98bp;非甲基化上游引物:5'-GGAGGATAGTTGGATTGAGTTAATGTT-3 ',下 游 引 物:5 '-CAAATCCCTCCCAAACACCAA-3’,扩增片段长度为106 bp。引物参考外文文献和引物设计软件分析设计。PCR扩增反应:琼脂糖凝胶电泳,经全自动凝胶图像分析仪在紫外灯下显影照相,根据特异性条带的有无,分别记为阳性和阴性。
1.2.4 RT-PCR检测 DAPK mRNA 的表达情况:①RT-qPCR反应体系。将提取的RNA用Easy Script First-Strand cDNA Synthesis SuperMix Kit将其逆转录为cDNA保存。取 cDNA 4 μl,加入上下游引物各1 μl,Platinum SYBR Green qPCR SuperMix-UDG 25 μl,加入 RNase-Free &DNase-Free ddH2O 19 μl,构成总体积50 μl的反应体系。在反应条件是50℃、95℃预变性各2 min,95℃变性15 s,60℃退火30 s,共40 个循环,65~95℃溶解曲线1 min下进行PCR反应。实验中以GAPDH作为内标基因,以标准化各个标本中DAPK基因相对表达量,以Hela及HEPG2为质控,以DAPK基因作为目的基因。②结果判定标准:反应的数据由Bio-Rad CFX软件进行收集及分析。通过目的基因和内参基因拷贝数的比值进行样本间相对定量的比较。所有数值以相对于GAPDH基因升高或减少的倍数(Fold)表示。所有标本的基因复制的数值均以阈值循环(Cycle threshold Ct)表达。具体如下:目的基因的表达量=2-△△Ct,△△Ct=(Ct目的基因 -Ct内标基因)实验组-(Ct目的基因 -Ct内标基因)对照组,表示的是实验组目的基因相对于对照组的变化倍数,使用这一方法可直接得到目的基因相对于内参基因组的定量。
1.3 统计学分析 应用SPSS 11.5统计软件,基因表达分析首先进行正态性检验,如果符合正态分布以±s表示,进行t检验;如果计量资料不符合正态分布,则以中位数±四分位数间距进行描述,采用秩和检验统计分析,P<0.05为差异有统计学意义。在进一步做组间的两两比较,为了减少I类误差,将原来的检验水准α=0.05调整为α=α/比较次数,即P≤α时差异有统计学意义。
2 结果
2.1 实验组及对照组DAPK甲基化的表达情况 实验中DAPK基因启动子区甲基化阳性率为18.52%(10/54);对照组DAPK基因启动子区甲基化阳性率为0(0/40)。采用校正χ2检验,差异有统计学意义(χ2=7.500,P<0.05)。见图1、2。
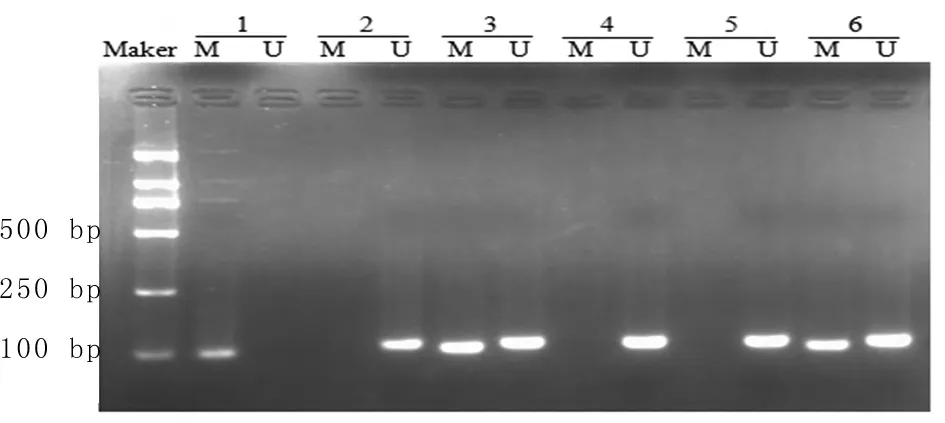
图1 部分实验组样本DAPK基因启动子区甲基化电泳图

图2 部分对照组样本DAPK基因启动子区甲基化电泳图
2.2 MM患者DAPK基因启动子区甲基化与部分临床特征的相关性 (1)性别:男性患者阳性率14.29%(5/35),女性患者阳性率 26.32%(5/19),χ2=0.518,P>0.05。(2)年龄:≥65 岁者阳性率23.08%(6/26),<65 岁者阳性率 14.29%(4/28),χ2=0.231,P>0.05。(3)分期:Ⅰ + Ⅱ期者阳性率31.82%(7/22),Ⅲ期者阳性率 9.38%(3/32),χ2=2.992,P>0.05。(4)分组:A 组者阳性率 21.62%(8/37),B 组者阳性率13.33%(2/15),χ2=0.089,P>0.05。(5)是否初治:初治组者阳性率18.52%(5/27),复发组阳性率18.52%(5/27),χ2=0.000,P>0.05。差异均无统计学意义(注:①~④校正χ2检验,⑤χ2检验)。
2.3 DAPK mRNA表达情况统计分析(目的与内参基因溶解曲线,溶解曲线为单一峰值,说明引物设计合理,可进行相对表达量的计算。见图3、4。
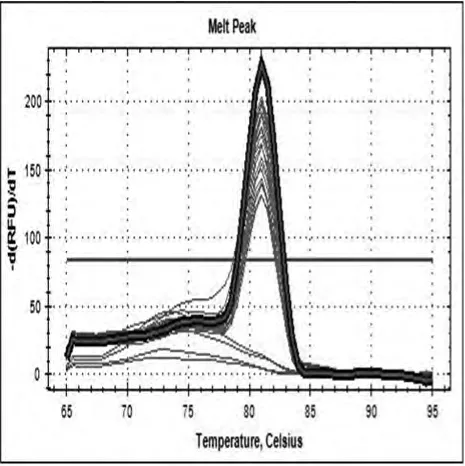
图3 DAPK mRNA溶解曲线
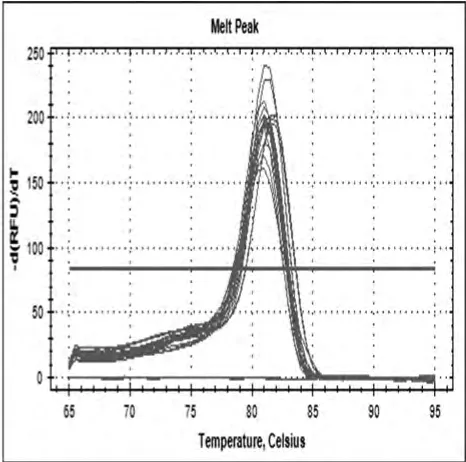
图4 GADPH mRNA溶解曲线
2.3.1 M组和对照组DAPK基因mRNA比较:在MM组为(1.09 ±1.35)Fold,对照组为(1.26 ±1.38)Fold,采用 Wilcoxon 两样本比较法,Z= -1.579,P>0.05。
2.3.2 甲基化组、非甲基化组、对照组3组间两两比较:①甲基化组与非甲基化组:(0.76±1.09)Fold VS(1.18 ±1.28)Fold,Z= -1.414,P>0.0167。②甲基化组与对照组:(0.76 ±1.09)Fold VS(1.26 ±1.38)Fold,Z= -2.292,P>0.0167。③非甲基化组与对照组:(1.18 ±1.28)Fold VS(1.26 ±1.38)Fold,Z=-1.003,P>0.0167。
2.3.3 初诊组、复发组、对照组3组间两两比较:①初诊组与复发组:(0.98 ±1.19)Fold VS(1.17 ±1.72)Fold,Z= -0.978,P>0.0167。②初诊组与对照组(0.98 ± 1.19)Fold VS(1.26 ± 1.38)Fold,Z=-2.045,P>0.0167。③复发组与对照组:(1.17 ±1.72)FoldVS(1.26 ± 1.38)Fold,Z= - 0.588,P>0.0167。
2.4 DAPK基因启动子区甲基化阳性标本测序结果分析 将本实验表达DAPK基因启动子区甲基化阳性的标本送上海Invitrogen公司进行测序,测序结果运用DNAstar软件进行拼接,再用BIQ analyzer软件进行分析,如果甲基化扩增产物测序结果与非甲基化扩增产物测序结果对比见C→T,则证明该样本确实存在DAPK基因启动子区甲基化。经测序证实10例DAPK基因启动子区甲基化阳性标本确实存在甲基化。这两者比较从图中可见有10处基因位点从C→T,提示该标本确实存在DAPK基因启动子区的甲基化。见图5。

图5 1例送检MM样本中DAPK基因甲基化扩增产物(橙色标记)与非甲基化扩增产物(紫色标记)序列对比图
2.5 DAPK基因mRNA在实验组和对照组中的表达情况 采用Wilcoxon两样本比较法,对所得的数据进行分析,得 Z值 -1.579,P=0.114;DAPK 基因 mRNA 在 MM 组为(1.09 ±1.35)Fold,对照组为(1.26 ±1.38)Fold,实验组与对照组之间比较,差异无统计学意义(P>0.05),表明DAPK基因mRNA的表达水平在MM组和对照组无差异。
54例MM患者中,根据DAPK基因启动子区甲基化情况,可分为甲基化组、非甲基化组。采用Kruskal-Wallis法对 3组数据进行分析得,χ2=0.859,P=0.088,P>0.05,表明3组之间 DAPK 基因 mRNA 表达水平差异无统计学意义。对这3组进行组间两两比较时,应调整检验水准(0.5/3≈0.0167),即P<0.0167时,差异有统计学意义,结果显示三者的P值均>0.0167,表明在甲基化组、非甲基化组及对照组中DAPK基因mRNA表达水平无差异。
54例MM患者中,根据是否接受治疗,可分为初诊组和复发组。采用Kruskal-Wallis法对3组数据进行分析得 χ2=3.764,P=0.152,表明 3 组之间 DAPK基因mRNA表达水平相比较,无显著性差异。对这3组进行组间两两比较时,应调整检验水准(0.5/3≈0.0167),即P<0.0167时,差异有统计学意义,结果显示三者的P值均>0.0167,即初诊组、复发组及对照组中DAPK基因mRNA表达水平无差异。
3 讨论
DAPK基因是一种钙离子与钙调素依赖的丝氨酸和苏氨酸蛋白激酶,是IFN-γ介导的正性细胞凋亡促进因子,广泛参与多种途径介导的细胞凋亡。近年来,DAPK基因启动子区甲基化与肿瘤的关系倍受关注,已在宫颈癌、结肠癌组、肝细胞癌等多种实体肿瘤组织中发现DAPK基因启动子区域CpG岛高频率甲基化。有研究发现,DAPK表达缺失的垂体腺瘤往往更具有侵袭性,乳腺癌中DAPK表达减少与患者的生存期成负相关,与肿瘤的复发成正相关[3]。DAPK启动子区高甲基化致DAPK缺失已证实在B细胞恶性肿瘤如滤泡性淋巴瘤、弥漫大B细胞淋巴瘤、伯基特淋巴瘤中为常见现象[4]。研究发现在MM中DAPK基因启动子区甲基化阳性率在 5.9% ~30%[5-7],本研究中MM患者DAPK基因启动子区甲基化的阳性率为18.52%(10/54),与报道的阳性率较接近;而40例对照组中甲基化阳性率为0(0/40),提示DAPK基因启动子区甲基化在MM的发病中具有一定的作用。
Eleftheria等[8]研究发现,DAPK基因在 MM 中甲基化的阳性率虽不高(4/68),但与预后不良的指标如高肌酐水平、高钙、分期为Ⅲ期等显著相关,总生存期明显低于阴性患者。本研究发现,DAPK基因启动子区在MM中的高甲基化与MM患者的某些临床特征存在一定的相关性:(1)与分期的关系:Ⅰ期和Ⅱ期的甲基化阳性率为31.82%(7/22)、Ⅲ期的甲基化阳性率为9.38%(3/32),Ⅰ期、Ⅱ期与Ⅲ期相比,DAPK基因启动子区甲基化阳性率差异无统计意义,提示DAPK基因启动子区甲基化可能是MM发病的早期事件,这与Ng等[9]的实验结果一致。(2)与分型的关系:IgG型MM的DAPK基因启动子区甲基化的阳性率明显高于对照组(P<0.01),这进一步表明DAPK基因启动子区甲基化参与了MM的发生发展。(3)与性别和年龄的关系:DAPK基因启动子区甲基化的阳性率与性别和年龄无关。(4)与治疗的关系:在初诊组和复发组中DAPK基因启动子区甲基化阳性率都为18.52%(5/27),两者差异无统计学意义,初步表明DAPK基因启动子区甲基化阳性状态与治疗无关,但亦可能是因为样本量较少、患者接受治疗的不均一性和传统治疗药物很少具有逆转甲基化作用等有关,应进一步扩大样本进行研究。
同时MM患者的DAPK基因mRNA表达量低于对照组,但差异无统计学意义(P>0.05),考虑与样本量不足有关;DAPK基因mRNA表达量甲基化组低于非甲基化组及对照组,与基因甲基化使基因表达沉默理论相符,但差异无统计学意义(P>0.0167),考虑其原因与样本较少有关。初诊组和复发组中DAPK基因启动子区甲基化阳性率相同,而初诊组的DAPK基因mRNA表达量低于复诊组和对照组,虽然差异也无统计学意义(P>0.01),但考虑到基因甲基化并非是基因表达沉默的唯一机制,国外Raveh等[10-12]研究也提示除启动子高度甲基化是DAPK基因在人类肿瘤中失活的主要机制外,可能还同时存在其他机制导致该基因表达沉默,如基因杂合缺失[10]、基因纯合缺失[11,12]。需进一步扩大样本量进行研究证实。
综上所述,DAPK基因作为与细胞周期调控有关的重要抑癌基因,其甲基化的异常在多发性骨髓瘤中确实存在,MSP方法灵敏性高,因此使用MSP方法检测DAPK基因的甲基化状态将有可能成为检测MM微小残留病的一个指标[13],去甲基化的药物可能是一种有效的治疗方法[14]。
1 Deiss LP,Feinstein E,Berissi H,et al.Identification of a novel serine/threonine kinase and a novel 15-kD protein as potential mediators of the gamma interferon-induced cell death.Genes Dev,1995,9:15-30.
2 张之南,沈悌主编.血液病诊断及疗效标准.第3版.北京:科学出版社,2007.232-235.
3 Dawson MA,Kouzarides T.Cancer epigenetics:from mechanism to therapy.Cell,2012,150:12-27.
4 Rossi D,Capello D,Gloghini A,et al.Aberrant promoter methylation of multiple genes throughout the clinico-pathologic spectrum of B-cell neoplasia.Haematologica,2004,89:154-164.
5 Braggio E,Maiolino A,Gouveia ME,et al.Methylation status of nine tumor suppressor genes in multiple myeloma.Int J Hematol,2010,91:87-96.
6 Yuregir OO,Yurtcu E,Kizilkilic E,et al.Detecting methylation patterns of p16,MGMT,DAPK and E-cadherin genes in multiple myeloma patients.Int J Lab Hematol,2010,32:142-149.
7 Martin P,Garcia-Cosio M,Santon A,et al.Aberrant gene promoter methylation in plasma cell dyscrasias.Exp Mol Pathol,2008,84:256-261.
8 Eleftheria H,Aggeliki D,Leonidas B,et al.Study of specific genetic and epigenetic variables in multiple myeloma.Leukemia Lymphoma,2010,51:2270-2274.
9 Ng MH,To KW,Lo KW,et al.Frequent death-associated protein kinase promoter hypermethylation in multiple myeloma.Clin Cancer Res,2001,7:1724-1729.
10 Raveh T,Kimchi A.DAP kinase-a proapoptotic gene that functions as a tumor suppressor.Exp Cell Res,2001,264:185-192.
11 Kawaguchi K,Oda Y,Saito T,et al.Death-associated protein kinase(DAP kinase)alteration in soft tissue leiomyosarcoma:Promoter methylation or homozygous deletion is associated with a loss of DAP kinase expression.Hum Pathol,2004,35:1266-1271.
13 Brian AW,Gareth JM.Could DNA methylation become a useful measure for multiple myeloma prognoses.Expert Rev Hematol,2011,4:125-127.
14 N Shenker,JM Flanagan.Intragenic DNA methylation:implications of this epigenetic mechanism for cancer research.Brit J of Cancer,2012,106:248-253.
