叶子花SSR-PCR体系的优化
2015-03-31鲁亚静李建友胡章立昝启杰陈涛
鲁亚静,陈 庭,李建友,胡章立,昝启杰,2,陈涛,*
(1.深圳大学生命科学学院,广东深圳 518060;2.深圳市野生动物救护中心,广东深圳 518040;3.深圳市中国科学院仙湖植物园,广东深圳 518004)
叶子花SSR-PCR体系的优化
鲁亚静1,2,3,陈 庭3,李建友3,胡章立1,昝启杰1,2,陈涛1,3*
(1.深圳大学生命科学学院,广东深圳 518060;2.深圳市野生动物救护中心,广东深圳 518040;3.深圳市中国科学院仙湖植物园,广东深圳 518004)
[目的]优化叶子花SSR-PCR体系。[方法] 以乔木叶子花为材料,通过Touchdown PCR扩增程序和正交试验,对影响叶子花SSR-PCR体系的引物浓度、TaqDNA聚合酶用量、Mg2+浓度和dNTPs浓度进行优化。[结果]叶子花20 μl SSR-PCR体系的最优条件为引物浓度0.4 mmol/L、TaqDNA聚合酶用量1.5 U、Mg2+浓度1.5 mmol/L、4种dNTPs浓度均为0.15 mmol/L,模板100 ng左右。[结论]该反应体系的扩增条带清晰、稳定、重复性好,可用于后续叶子花遗传多样性分析和种质资源鉴定等研究。
叶子花;正交试验;SSR;PCR体系优化
叶子花又名三角梅、簕杜鹃、宝巾、九重葛等,为紫茉莉科(Nyctaginaceae)叶子花属(BougainvilleaComm. ex Juss.)植物。叶子花原产南美洲,其栽培品种苞片、花、叶色彩艳丽,已在热带亚热带地区广泛栽种[1]。叶子花栽培品种有300多个,但名种多达500个以上。其形态特征随各地环境因子的差异变化很大,经典的园艺分类往往难于对栽培品种进行准确鉴定。随着分子生物学的快速发展,RAPD、ISSR、SRAP等分子标记技术被陆续用于叶子花的遗传多样性和亲缘关系研究,为栽培品种的鉴定提供了更准确可靠的手段[2-5]。
简单重复序列(Simple Sequence Repeat, SSR)也称微卫星DNA,是由1~6个核苷酸为重复单位组成的串联重复序列。SSR分子标记具有双亲共显性、单一位点高多态性、试验结果重复性好等优点,已广泛应用于植物遗传多样性分析、种质资源评价和分子鉴定[6-9]。笔者采用Touchdown PCR扩增程序和正交试验设计[10-11],对影响叶子花SSR-PCR的引物浓度、TaqDNA聚合酶浓度、Mg2+浓度和dNTPs浓度进行优化,为后续叶子花SSR分子标记引物开发和遗传多样性分析与种质资源鉴定奠定基础。
1 材料与方法
1.1 材料及处理 供试乔木叶子花(B.arborea)采自广东省深圳市仙湖植物园叶子花保育与研发基地。采集幼嫩叶片用硅胶进行干燥处理,取适量样品用磁珠在Fastprep-24组织破碎仪上打磨。采用经典的CTAB法提取总DNA[12],用1%琼脂糖凝胶检测DNA质量,用NanoDrop 2000超微量分光光度计检测DNA浓度。
1.2 主要试剂与仪器 主要试剂:DL500 DNA Maker、PCR扩增所用的TaqDNA聚合酶、Mg2+以及dNTPs均购自宝生物工程(大连)有限公司,SSR引物由生工生物工程(上海)有限公司合成。
主要仪器:SSR扩增反应在BIO-RAD T100TMThermal Cycler上进行;DYY-8C型垂直电泳仪购自北京六一仪器厂,Gene Genius Bio-imaging system凝胶成像仪购于美国。
1.3 叶子花SSR-PCR体系的优化
1.3.1 正交试验设计。正交试验所用引物为Bp3,体系验证引物为Bp1和Bp2,各引物序列见表1。选用L16(44)正交表,对叶子花SSR-PCR条件进行引物浓度、TaqDNA聚合酶浓度、Mg2+浓度和dNTPs浓度4因素4水平优化试验(表2)。

表1 不同的叶子花SSR引物
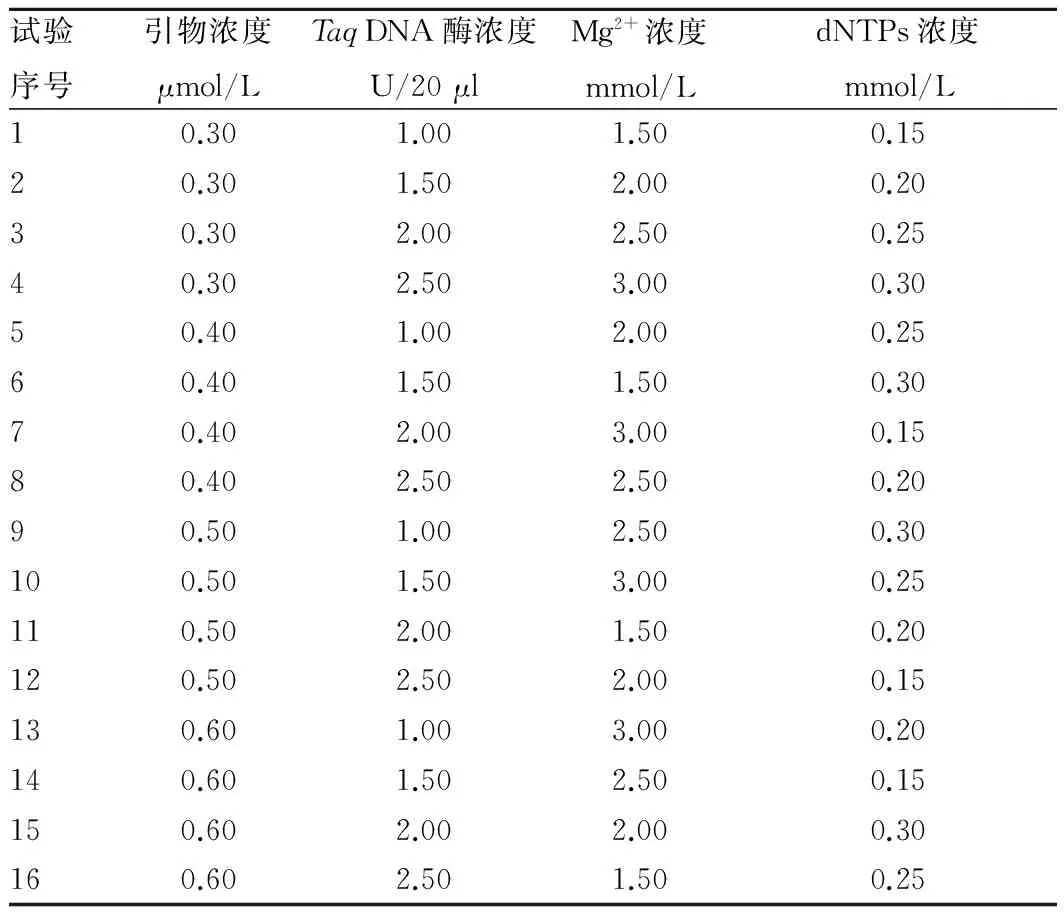
表2 叶子花SSR-PCR体系正交设计
1.3.2 单因素试验设计。利用正交试验中16组试验优化的结果,选出一组结果最佳的浓度组合,以此为基准进行PCR体系单因素试验。每个因素依照表2进行优化,从而得到叶子花SSR-PCR最优的反应体系。
1.3.3 Touchdown PCR扩增程序。94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火45 s,72 ℃延伸45 s,10个循环且每个循环降低0.5 ℃;之后94 ℃变性30 s,53 ℃退火45 s,72 ℃延伸45 s,24个循环;最后72 ℃延伸5 min。扩增产物用2%琼脂糖凝胶电泳检测,并拍照记录。
2 结果与分析
2.1 叶子花SSR-PCR体系的正交试验优化 以乔木叶子花DNA为模板和所参试的引物进行PCR扩增,实现对影响PCR扩增的引物浓度、TaqDNA聚合酶量、Mg2+浓度和dNTPs浓度的4水平正交优化。2次重复试验的PCR扩增产物用2%琼脂糖凝胶电泳检测(图1)。
结果显示,所参试的引物能成功扩增出预期长度范围的目标片段。泳道9所扩增出的2条带亮度相差大;泳道13和泳道15所扩增出的2条带清晰可见,稳定存在;经多次重复试验发现泳道13所扩增出的2条带亮度相当,清晰可见,稳定存在,而泳道15所扩增出的2条带亮度相差大,会出现1条带模糊甚至是消失,不能稳定存在。因此,正交试验的第13组为最佳的浓度组合,由表1可知,该组的引物浓度为0.60 μmol/L,TaqDNA聚合酶浓度为1.00 U/20 μl,Mg2+浓度为3.00 μmol/L以及dNTPs浓度为0.20 μmol/L。
2.2 叶子花SSR-PCR体系的单因素试验优化 以正交试验的第13组浓度组合为基准,对影响PCR扩增的引物浓度、TaqDNA聚合酶量、Mg2+浓度和dNTPs浓度进行单因素试验。图2为1次试验PCR扩增产物经1%琼脂糖凝胶电泳检测的结果。
2.2.1 引物浓度。由图2可知,随着正反引物浓度的升高,PCR扩增条带的亮度呈先上升后下降的趋势。当正反引物浓度为0.30 μmol/L时,目标条带不被特异性扩增;当正反引物浓度为0.40 μmol/L时,扩增效果最好;此后,随着正反引物浓度的升高,形成的二聚体增多,故引物浓度选用0.40 μmol/L。
2.2.2TaqDNA聚合酶量。由图2可知,随着TaqDNA聚合酶量的增加,PCR扩增条带的亮度呈上升趋势。当TaqDNA聚合酶量为1.00 U时,目标条带未被特异性扩增;当TaqDNA聚合酶量为2.00 U时,扩增效果最好,之后再增加酶量,扩增效果无太明显的变化。但从节约试剂和整体的扩增效果考虑,TaqDNA聚合酶量为1.50 U时也能达到预期的效果,因此,理想的TaqDNA聚合酶量为1.50 U。
2.2.3 Mg2+浓度。Mg2+为TaqDNA聚合酶发挥活性所必须的,Mg2+浓度过低或过高都会影响PCR扩增效率。由图2可知,随着Mg2+浓度的增加,PCR扩增条带的亮度呈下降趋势,故选用1.50 μmol/L Mg2+作为理想的Mg2+浓度。
2.2.4 dNTPs浓度。dNTPs浓度过高时,dNTPs会与Mg2+结合,降低体系中Mg2+浓度,影响TaqDNA聚合酶活性。另外,dNTPs浓度过高也会提升错误扩增几率,出现非特异性产物和拖尾现象。由图2可知,随着dNTPs浓度的升高,PCR扩增条带的亮度呈下降趋势,故dNTPs浓度选用0.15 μmol/L。
2.3 体系验证 应用上述所得体系,选用不同叶子花(表3)对所设计的SSR引物(表1)进行扩增,用 1%琼脂糖凝胶电泳检测产物,结果显示扩增条带清晰,重复性好(图3)。
综上所述,叶子花20 μl SSR-PCR体系的最优条件:引物浓度0.4 mmol/L,TaqDNA聚合酶用量1.5 U,Mg2+浓度1.5 mmol/L,4种dNTPs浓度均为0.15 mmol/L,可用于后续SSR引物筛选及分析。

表3 用于SSR-PCR反应体系验证的叶子花材料
3 结论与讨论
SSR分子标记技术基于特异引物PCR,任何影响PCR扩增效果的因子, 如引模板DNA、引物浓度、TaqDNA聚合酶浓度、Mg2+浓度、dNTPs浓度等,都将影响SSR-PCR体系的建立和优化。正交试验设计优化PCR反应条件比单因素逐个调整法的效率更高,试验设计更科学,得出的试验体系有效范围宽,稳定性好[11]。Touchdown PCR是一种简单快速的优化方法,能够增加扩增反应的特异性、敏感性和产物产量,避免了非特异性产物的出现以及对温度等长时间的优化或对引物的重新设计[10]。
引物浓度偏高会引起错配和非特异性扩增,且可增加引物之间形成二聚体的机会。TaqDNA聚合酶为Mg2+依赖性酶,Mg2+与dNTPs具有拮抗作用,Mg2+浓度过高会降低PCR扩增的特异性,浓度过低影响PCR扩增产量甚至导致PCR扩增失败。朱世杨等[13]在对水稻SSR-PCR体系进行优化时发现,随着引物浓度增加,PCR扩增中产生的引物二聚体量也呈增加趋势,尤其是高浓度下产生最多;Mg2+浓度过高反而抑制了Taq酶的活性,导致扩增产物降低,该研究也发现了类似的趋势。模板DNA浓度过低影响扩增产量,浓度过高导致扩增条带拖尾甚至无扩增条带,黄芳丽等[14]在对芒果SSR-PCR反应体系的优化中发现20 μl 体系中模板DNA浓度为60~100 ng时对扩增结果无显著影响,Yang等[15]在对人参SSR-PCR反应体系的优化中发现,模板DNA浓度为30~120 ng时对扩增结果无显著影响[15]。因此,该研究将模板DNA浓度控制在100 ng左右,在得到理想结果的合理范围内。
该研究最终确定叶子花20 μl SSR-PCR体系的最优条件为引物浓度0.4 mmol/L,TaqDNA聚合酶用量1.5 U,Mg2+浓度1.5 mmol/L,4种dNTPs浓度均为0.15 mmol/L,模板DNA 100 ng左右,可用于后续叶子花SSR分子标记引物开发和遗传多样性分析与种质资源鉴定研究。
[1] 陈涛.叶子花[M].北京:中国农业出版社,2008.
[2] CHATTERJEE J,MANDAL A K A,CHAKRABARTY D,et al.Use of RAPD analysis to determine genetic diversity and relationship amongBougainvilleacultivars at intra- and inter-specific levels[J].Horticulture,Environment and Biotechnology,2007,48(1):43-51.
[3] SRIVASTAVA R,SHUKLA S,SONI A,et al.RAPD-based genetic relationships in differentBougainvilleacultivars[J].Crop Breeding and Applied Biotechnology,2009,9:154-163.
[4] 李房英,黄彦晶,吴少华.三角梅种质资源的ISSR分析[J].热带作物学报,2011,32(9):1692-1696.
[5] 唐源江,武晓燕,曹雯静.基于SRAP的叶子花种质资源遗传多样性及遗传关系分析[J].热带亚热带植物学报,2014,22(2):147-154.
[6] FREEMAN S,WEST J,JAMES C,et al.Isolation and characterization of highly polymorphic microsatellite in tea (Camelliasinensis)[J].Molecular Ecology Notes,2004,4:324-326.
[7] GALLI Z,HALASZ G,KISS E,et al.Molecular identification of commercial apple cultivars with microsatellite markers[J].Hort Science,2005,40:1974-1977.
[8 ] ROUBOS K,MOUSTAKAS M,ARAVANOPOULOS F A.Molecular identification of Greek olive (Oleaeuropaea) cultivars based on microsatellite loci[J].Genet Mol Res,2010,9(3):1865-1876.
[9] 张红莲,李火根,胥猛,等.鹅掌楸属种及杂种的SSR分子鉴定[J].林业科学,2010,46(1):36-39.
[10] KORBIE D J,MATTICK J S.Touchdown PCR for increased specificity and sensitivity in PCR amplification[J].Nature Protocols,2008,3(9):1452-1456.
[11] 杨水云,李续娥,吴明宇,等.正交实验在PCR反应条件优化中的应用[J].生物数学学报,2005,20(2):202-206.
[12] DOYLE J J,DOYLE J L.A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J]. Phytochemical Bull,1987,19:11-15.
[13] 朱世杨,罗天宽,张小玲,等.水稻SSR-PCR体系的优化[J].安徽农业科学,2009,37(8):3441-3443,3447.
[14] 黄丽芳,雷新涛,姚金胜,等.芒果SSR-PCR反应体系的优化[J].热带作物学报,2010,31(3):410-415.
[15] YANG T,MU L,WANG J.Optimizing SSR-PCR system ofPanaxginsengby orthogonal design[J].Journal of Forestry Research,2007,18(1):31-34.
Optimization of SSR-PCR System forBougainvilleaarborea
LU Ya-jing1,2,3,CHEN Ting3,LI Jian-You3, CHEN Tao1,3*
(1.School of Life Sciences, Shenzhen University,Shenzhen , Guangdong 518060;2. Center for Wildlife Animal Rescure and Protection,Shenzhen, Guangdong 518040;3. Shenzhen Fairy Lake Botanical Garden,Shenzhen, Guangdong 518004)
[Objective] The aim was to optimize SSR-PCR system forBougainvilleaarboreaby orthogonal design.[Method] Based on orthogonal design, four levels of four factors (primer,TaqDNA polymerase, Mg2+, dNTPs) have been tested to optimize SSR-PCR reaction system usingBougainvilleaaboreagenomic DNA as template. The amplification was performed with a touchdown program. [Result]The optimized SSR-PCR reaction condition forBougainvilleaarboreawas obtained in a 20 μl system containing 0.4 mmol/L SSR primer, 1.5 UTaqDNA polymerase, 1.5 mmol/L Mg2+, 0.15 mmol/L dNTPs and around 100 ng DNA template. [Conclusion]With clear, stable and repeatable amplification bands, the reaction system can be used for the further studies on genetic diversity and germplasm identification.
Bougainvilleaarborea; Orthogonal design; SSR; PCR system optimization
深圳市科技研发资金项目(JCYJ20120615172425764);深圳市城管局科研项目(200901)。
鲁亚静(1989-),女,安徽合肥人,硕士研究生,研究方向:资源植物品质鉴别与安全应用。*通讯作者,研究员,博士,从事资源植物研究与开发。
2015-04-22
S 188
A
0517-6611(2015)17-047-03
