急性胰腺炎新分类相关术语和并发症及MCTSI评分
2015-03-29袁涛全冠民石伟任国利刘洋马晶晶
袁涛, 全冠民, 石伟, 任国利, 刘洋, 马晶晶
·图文讲座·
急性胰腺炎新分类相关术语和并发症及MCTSI评分
袁涛, 全冠民, 石伟, 任国利, 刘洋, 马晶晶
急性胰腺炎(AP)的发病逐年增多。近20年来,有关AP的发病机制、病变分类和术语规范化、严重程度评估、预后预测有较大进展,影像学技术的发展对AP病理解剖和病理生理的无创性评估的作用日益受到重视。本文阐述AP的新概念和术语、并发症、相关的CT征象及评估方面的进展。
胰腺炎,急性,坏死性; 预后; 体层摄影术,X线计算机
急性胰腺炎(acute pancreatitis,AP)是一种常见的急腹症,随着高脂血症、酗酒等危险因素增多,国内外AP发病率逐步增高。虽然AP治疗技术和治愈率均有很大提高,但急性重症胰腺炎(severe acute pancreatitis,SAP)预后仍然欠佳。病程早期进行AP分类及严重度评估对于正确选择治疗方法与评估预后具有重要价值,及时发现预后不良征象提示可进行积液处理、动脉区域灌注治疗、分子靶向治疗等积极措施。目前认为增强CT(contrast-enhanced CT,CECT)是评价AP严重程度的最佳技术,CECT有助于确定严重度及观察并发症,对胰腺坏死的敏感度达90%。可疑胰腺炎及重症胰腺炎者均应行CT检查,最佳评价时间是发病后72 h。CECT需行薄层扫描(3 mm)及注射对比剂后60~70 s扫描,若怀疑血管并发症,需增加动脉期扫描。若疑为结石及合并出血,则应包括平扫[1]。
近年来,有关AP的临床、病理学及影像学研究均有较多进展,尤其是更新了预后评估的分类和标准,这些对于AP的诊断、治疗、评估及学术交流影响较大,废弃了一些易于混淆和不恰当的方法、术语、分类。为此,笔者根据5年来1659例AP的影像学诊断经验,结合相关文献,就AP病因与发病机制及临床评分概况、与影像学相关的术语、并发症及CT评价进行阐述,以提高AP影像学评价的水平。
AP病因与发病机制及临床评分概况
AP发病率逐渐增高与其病因有关,最常见者为胆石症(30%~45%)及酗酒(30%~35%)、高脂血症,其他较少见原因包括肥胖、老龄化、高钙血症、病毒感染、胆系寄生虫病、某些药物(如咪唑巯嘌呤等)、Oddi括约肌功能障碍、肿瘤、创伤、手术、逆行胰胆管造影、胰腺及胆系先天性异常(如胰腺分裂、环状胰腺、胆管囊肿、十二指肠重复囊肿)[1-5]。
本病的发病机制尚不完全明确,但多认为与胰管阻塞、胰腺酶的释放与激活导致自身消化与坏死、各种致病因子直接造成胰腺腺泡损伤、胰腺微循环的紊乱及白细胞介导的炎症反应、胰腺实质缺血-再灌注等有关,局部炎症释放的细胞因子如肿瘤坏死因子引起瀑布样全身性炎症反应,最终可导致器官衰竭[5]。
目前临床上采用多种评分系统评价AP严重度及预后,如Ranson评分、AP床旁严重度指数(bedside index for severity in acute pancreatitis,BISAP)、APACHE Ⅱ(急性生理与慢性健康评估,即acute physiology and chronic headlthevaluation)、简化的急性生理学评分、CT严重度指数(CT severity index,CTSI)等。除了CTSI,其余评分系统均以各种临床与实验室参数为依据,虽能较好地反映患者病理生理学状态,但不同程度忽视了AP的局部病理解剖变化与局部并发症,其中BISAP的效果较好,有助于预测AP严重度、死亡,对器官衰竭的作用与APACHE-Ⅱ近似,优于Ranson、CTSI、C反应蛋白、红细胞比容、身体质量指数,而CTSI及改良的CTSI近年来逐渐引起重视[6-9]。
AP新分类、相关术语及CT特点
为规范AP的诊断与评价,1992年亚特兰大胰腺炎会议发布了亚特兰大分类(Atlanta classification,AC),其基础是AP的临床及生化指标,这是AP里程碑式的分类。20多年来AC的应用对AP研究和交流起到了重要推动作用,但也发现在AC解读方面存在一些分歧,仍有许多概念混淆,致使不同医师之间评价的一致性较低,且该分类未包括形态学变化,也没有考虑到近10年来一些新技术如影像学、微创、内镜技术及手术治疗的发展,因此,对AC的修订势在必行[2]。2012年发布了AC修订版,该分类将AP分为间质水肿型与坏死型两类[3]。相关术语及CT特点简述如下。
1.间质性或水肿性胰腺炎(interstitial or edematous pancreatitis,IEP)
病理特点为胰腺及其周围炎症性水肿,无肉眼可见的组织坏死[4]。CT特点[1,2,5]:胰腺弥漫性或局限性增大,平扫密度均匀,强化正常及均匀,胰周结构模糊及索条影,可伴胰周积液(约30%~50%,图1a、b)。大多数(70%~80%)AP为IEP,保守治疗48~72 h即可好转。
2.坏死性胰腺炎(necrotizing pancreatitis,NP)
NP是指胰腺炎症伴胰腺或其周围组织坏死[4],约占AP的20%~30%,坏死原因为动脉痉挛及微循环灌注下降,组织学特征包括弥漫性或局限性胰腺坏死、脂肪坏死、胰腺及其周围出血,其中40%~70%继发感染[1,5]。坏死区<2 cm者可液化及吸收,而>5 cm者很少完全消失[5]。CT特点(图2):胰腺实质内低密度灶及不强化、胰周脂肪密度不均匀增高、灌注成像为低灌注或灌注缺损,胰腺中央坏死者可见主胰管中断及与坏死腔相通[2,10]。一般认为,应在发病72 h时行CECT确定有无胰腺坏死,大部分胰腺坏死可在48 h时显示。CTP对于胰腺坏死显示的可靠性优于CECT,并有可能在发病48 h内预测坏死[11],早期提示坏死可启动抗凝、经脾动脉灌注血管扩张剂及蛋白酶抑制剂、抗生素治疗。预测胰腺坏死的CTP阈值为BF<27.29 mL/100mL/min及BV<8.96 mL/100mL[12]。
胰腺周围坏死不同于胰腺实质坏死,见下文叙述。
图1 男,42岁。IEP。a) 轴面CT平扫示胰腺轻度弥漫性增大(箭),胰周脂肪密度稍增高; b) 轴面脂肪抑制T2WI示胰腺弥漫性信号增高、轮廓模糊(箭),胰周少许索条影。 图2 女,29岁。NP。轴面CT增强扫描示胰腺体部较大范围不强化区(箭),胰头颈部及胰尾部(箭头)强化仍正常。小网膜囊较多水样密度影。 图3 男,41岁。APFC。轴面脂肪抑制T2WI示胰腺增粗及信号增高,胰周见高信号影(箭),小网膜囊为著。 图4 男,16岁。PP。轴面CECT示胰腺轮廓模糊,小网膜囊类圆形水样密度影(箭),壁薄而均匀。
图5 男,40岁。ANC。轴面CECT示胰头部腹侧一不规则低密度影(箭),内部密度不均匀。 图6 男,74岁。WOPN。轴面CECT示胰头前方混杂低密度影(箭),内见脂肪密度(*)。 图7 男,41岁。胰腺外坏死。轴面CECT示胰腺前方(箭)及左肾旁前间隙结节状、斑片状软组织密度及水样密度影。
除此之外,还有急性重症胰腺炎(severe acute pancreatitis,SAP)的称谓,符合以下1条即可诊断为SAP:①器官衰竭(血压<90 mmHg、PaCO260 mmHg、血浆肌酐>2 mg/dL、胃肠道出血>500 mL/d)。②局部并发症,如坏死、感染、脓肿、假囊肿。③Ranson评分≥3分时或APACHE Ⅱ评分≥8分[1]。
3.急性胰腺周围积液(acute peripancreatic fliud collection,APFC)
APFC是指胰腺周围积液,无坏死,见于IEP发病后4周内。约30%~50%出现于发病48 h内,最常见于小网膜囊,其他包括肾旁前间隙、横结肠旁、肠系膜根部、肝胃韧带、胃结肠韧带,APFC不与胰管相通[4,13]。CT特点(图2、3):上述间隙内均匀水样密度、无明确的壁,可为多发性,常见于小网膜囊与左肾旁前间隙,但范围较广者可延伸至盆腔及纵隔,增强扫描无强化。此种积液可在2~4周内吸收,也可继发感染及形成假囊肿,积液量大小与患者的预后无关[2,5]。
4.胰腺假囊肿(pancreatic pseuocyst,PP)
PP为胰腺外有炎性囊壁的包裹性积液,边缘清楚,见于IEP发病4周以后[4],组织学上囊壁为肉芽组织,囊内几乎无坏死成分。CT特点(图4):胰腺外边缘清楚的圆形或类圆形均匀密度水样影,壁薄(1~2 mm)而清楚,增强扫描囊壁可见强化。

图8 男,75岁。内脏静脉血栓。CECT示脾静脉内充盈缺损(箭),胰腺增大、轮廓模糊。 图9 女,50岁。内脏静脉血栓。CECT示右侧卵巢静脉充盈缺损(箭)。 图10 男,13岁。脾动脉假性动脉瘤。CECT示胰尾部结节状明显强化影(箭)。
图11 男,44岁。AP并发出血。CT平扫示胰腺增粗,胰体部块状稍高密度影(箭)。 图12 女,53岁。NP合并肝脏灌注异常。 a) CECT动脉期扫描示左半肝(箭)强化程度超过右半肝。小网膜囊积液; b) CECT门静脉期示左半肝密度与右半肝近似。 图13 男,45岁。SAP并发弥漫性肝损害。 a) 轴面CT平扫示肝脏弥漫性密度减低,左半肝为著(箭),CT值41 HU; b) 2周复查CT平扫示肝脏密度增加,CT值56 HU,左、右半肝密度差不明显。
但CT难以与坏死性积液鉴别,USG与MR可确定其内有无坏死物[5]。PP<4 cm时可自行吸收,而>10 cm者需引流。约10%病例继发感染,影像学特征为囊壁增厚及内部积气,其他并发症包括破裂、假性动脉瘤、内脏静脉受压等[2,13]。
5.急性坏死性积液(acute necrotic collection,ANC)
ANC为发病4周内的混杂性积液,是胰腺及其周围脂肪坏死与胰腺分泌物混合构成,位于胰腺内或其周围,可能为胰腺释出的胰腺酶激活所致的脂肪皂化与坏死,因此其成分从明显坏死到液化性物质,可含分房及分隔。CT特点(图5):不均匀密度(水样与非水样密度混杂)、无明确边界,多方位成像可见其与胰管相通[4,13],胰腺内外均可受累,无包膜或仅有部分包膜。CECT对于坏死灶内碎屑显示有一定限度,若见到积液内脂肪则有提示作用。但发病早期难以区分积液是否为坏死性,因此早期胰周急性坏死性积液可称为“未定性的胰腺周围积液”,1~2周之后CECT及MR可较好地显示积液的性质[2,14]。
6.胰腺有壁坏死(walled-off pancreatic necrosis,WOPN)
WOPN见于NP起病4周之后,病理学上为胰腺内包裹性积液或胰腺周围坏死、形成边缘清楚的囊壁胰腺坏死与邻近存活的脂肪组织之间形成厚壁包膜,边缘清楚,内部为积液与坏死碎屑[4],以往称为机化性坏死、坏死瘤、假性囊肿伴坏死,为坏死的终末期改变,胰腺实质及胰周均可受累。CT特点(图6):呈完全包裹的不均匀低密度,一般近地侧密度高于远地侧,增强扫描囊壁强化,囊内无明显强化。囊壁完整者为WOPN,藉此可与ANC鉴别。但有时CT难以将其与PP鉴别,PP仅用于IEP,而WOPN则见于NP。疑难病例可参考MR、USG,MR与超声可清楚显示积液内坏死物[5]。
7.胰腺外坏死(extra-pancreatic necrosis)
胰腺外坏死常(约70%)与胰腺实质坏死并存,但仅有胰腺周围脂肪坏死、不伴胰腺实质坏死的也不少见。胰腺外坏死的原因是胰腺表面炎症蔓延或小导管破裂造成胰液外溢所致。CT特点(图7):胰腺周围脂肪密度不均及出现水样及非水样密度病变,有时呈结节状软组织密度影,易见于腹膜后及肠系膜的腹膜下区。胰腺外坏死对于预后的影响介于IEP与NP之间,因此影像学检查时应单独指出。
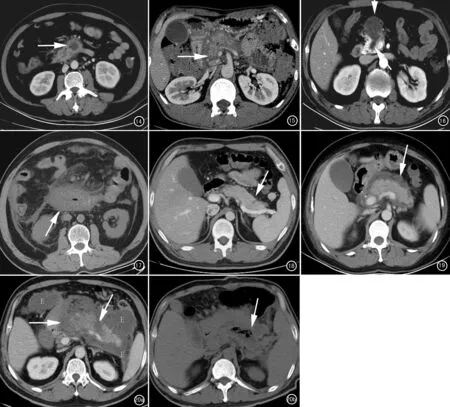
图14 女,48岁。NP合并感染。轴位CECT示胰头部低密度灶,内见少量气体密度影(箭)。胰尾也见类似病变(未列出)。 图15 男,39岁。NP合并胆管狭窄。胰腺不均匀强化降低,多发APFC,胆总管下段增厚及狭窄(箭),肝内胆管扩张(未列出)。 图16 男,40岁。NP合并坏死与胰管相通。CECT示胰头部坏死区(箭头)向后与胰管(箭)相连。
图17 男,52岁。SAP,合并胃肠道病变。CT平扫示十二指肠水平部及升部弥漫性增厚(箭),肠系膜脂肪密度增高、多发索条影,肾前后及侧锥筋膜增厚。 图18 男,24岁。酒后持续性腹痛,C反应蛋白24 mg/L,血淀粉酶736 U/L,BISAP评分1分。CECT示胰腺轻度增粗及胰周脂肪密度稍增高,MCTSI评分 2分。
图19 女,45岁。中上腹痛,向腰背部放射。C反应蛋白29.3 mg/L,血淀粉酶1033 U/L。BISAP评分1分。CECT示胰腺明显增粗、轮廓模糊,胰腺周围(箭)及小网膜囊、右侧肾旁前间隙、大网膜多处积液。MCTSI评分 6分。 图20 男,43岁。腹痛、恶心呕吐,T38.1°C, C反应蛋白33.5 mg/L,肌酐243.6/L正常值,血淀粉酶2876.6 U/L,BISAP评分3分。a) 入院时CECT示胰腺弥漫性增粗,强化不均匀,胰头及胰体部斑片状不强化区(箭),胰周多处积液(E); b) 5个月后复查CT平扫示继发脓肿形成,胰体尾部不规则含气腔(箭)。MCTSI评分 10分。
AP并发症
约15%~20%的AP出现并发症[5],包括血管性与非血管性并发症两大类。
1.血管并发症
内脏静脉血栓:内脏静脉血栓是AP最常见的血管并发症。笔者一组连续251例行CECT的AP患者中内脏静脉血栓出现率为32.7%。脾静脉最常受累(约70%),其次为肠系膜上静脉、门静脉,性腺静脉、下腔静脉偶见受侵[15],可单支或多支静脉发病。血栓出现原因可能与静脉直接受炎症侵犯或胰酶损伤、积液压迫、血管痉挛、凝血状态改变有关。CECT特点(图8、9):上述血管内充盈缺损、狭窄,脾静脉血栓者还可出现脾门及胃底、胃大弯周围静脉纡曲增粗,称为左侧性门静脉高压。CT评分较高者易出现内脏静脉血栓,NP患者内脏静脉血栓发生率是IEP的2倍。
假性动脉瘤:AP所致的假性动脉瘤主要见于胰腺周围动脉,脾动脉最多见,其次为胃左动脉,胃十二指肠动脉、胰十二指肠动脉、胃左动脉等较少见,罕见于腹主动脉及肝动脉。假性动脉瘤出血是胰腺炎致命性并发症[16,17]。CT特点(图10):平扫呈类圆形或不规则形稍高密度结节,并可见不规则血肿、胃肠道积血,CECT显著强化,CTA可直接显示假性动脉瘤的载瘤动脉。但须注意的是对于假性动脉瘤检查应包括门静脉期及平衡期扫描,有时还需要延迟扫描,其原因是假性动脉瘤内血流较缓慢,单纯的动脉期有可能遗漏病变。另外,CT检查也可能漏诊很小的假性动脉瘤。
出血:AP并发出血的原因是胰酶引起的血管壁消化性损伤、静脉曲张、胃肠道溃疡、胃肠道缺血等,急性出血为动脉壁直接侵蚀或假性动脉瘤破裂所致[18]。CT特点(图11):胰腺或胃肠道内、小网膜囊、腹膜腔及腹膜后积血,CECT有可能显示对比剂外溢及假性动脉瘤。
肝脏灌注异常:AP患者发生肝功能衰竭时预后不良,因此对肝功能评价具有重要价值。实验研究已证明SAP时出现肝脏实质损害及肝脏灌注异常,有些肝功能异常与肝血流灌注异常有关,因此测量肝脏灌注有助于预测肝脏损害。AP肝脏灌注异常的主要原因是肝实质或胆囊周围因炎症而肝动脉血流增加。CTP定量分析可能有助于分析SAP时肝脏损害,主要特点是肝动脉灌注(HAP)明显增高,尤以SAP及右半肝为著[19]。多期扫描的CECT(图12a、b)也可显示这种灌注异常,表现为动脉期局部强化显著,而门静脉期与平衡期呈等密度。
2.非血管并发症
弥漫性肝损害:AP患者弥漫性肝损害的发生率约为50%,SAP则超过80%,发生机制包括炎性因子及氧自由基等肝细胞损伤、血管活性物质所致肝血流下降、胆系压力增高所致肝细胞变性与坏死等,实验室检查血脂明显升高。CT特点(图13a、b):主要是肝实质弥漫性或地图状密度减低,可能为急性脂肪肝,这种密度降低与AP严重程度有关,AP越严重者,肝脏密度降低越明显。有效治疗后肝脏密度可迅速改善,一般1周后密度有所恢复,约2~4周恢复正常密度。
继发感染:AP继发感染见于胰周积液、假囊肿及胰腺或胰周坏死,感染最常见的机制为胃肠道粘膜受损,革兰氏阴性菌最多见,临床上出现感染症状。CT特点(图14):上述积液的囊壁增厚及不规则、增强扫描明显强化及囊内见气体密度影。CT引导下活检有助于确定感染的病原菌[20]。
胆管狭窄:胆系结石是我国AP的主要病因之一,因此AP患者常可合并胆管或胆囊结石。另一方面,AP炎性病变也可直接侵犯胆管,尤其是肝外胆管,造成胆管壁增厚及胆管狭窄,以薄层轴面CECT显示最佳(图15)。
胰腺坏死与胰管相通:这是AP一种少见并发症,仅见于NP,尤其是中央腺体坏死,导致坏死区直接与胰管相通(图16),CT多方位重组有助于显示。但MRCP是目前显示坏死与胰管关系的最佳手段,ERCP胰管造影也可显示胰管与坏死区的关系。PP也可与胰管相通,与坏死的区别是PP有完整的囊壁。
胃肠道并发症:包括胃肠道壁水肿、缺血及麻痹性肠梗阻。胃肠道壁水肿的原因包括AP炎性反应直接侵犯(主要见于胃、十二指肠、空肠上段)、静脉血栓。CT表现(图17)为胃肠道壁全层增厚、增强扫描为分层状,有时可见肠系膜静脉血栓。麻痹性肠梗阻的原因为内脏神经丛受侵及胃肠道蠕动减弱,CT显示弥漫性小肠与结肠扩张,内见积液与气液平面。
AP还常合并胸腔积液,为单侧或双侧性,CT表现为胸腔内水样密度影,一般为少量,也可达中等量、甚至大量积液。
CTSI修订版及应用举例
目前有关AP的CT分级系统至少有7种,其中最常用者为1990年Balthazar提出的CT严重度指数(CTSI)[21],其依据为胰腺实质改变与积液,CTSI不足之处是未与器官衰竭、胰腺外并发症、血管并发症相联系,且不同评价者之间的一致性仅为中度,原因是这些评价方法存在主观性、未考虑炎症的范围、胰周积液的大小及容积、早期诊断为轻度者仍可进展为重度AP、入院24 h内CT难以检出胰腺坏死、以及CT形态学改变并不总与临床严重度相关。为此,2004年Mortele等对此标准进行了修订、简化,即MCTSI。MCTSI反映器官衰竭及胰腺外并发症,不仅考察积液的多少,还观察其性质,胰腺坏死则按其范围简化分类为<30%与>30%。胰腺外并发症也在MCTSI考虑范围之内,包括胸腔积液、腹水、胰腺实质外病变、胰周血管受侵、胃肠道侵犯等,近期一大组150例研究已证实MCTSI较CTSI与预后的相关性更好[6],MCTSI较高者局部并发症明显增多。
以下列出CTSI与MCTSI评分方法(表1),以及轻、中、重度AP各1例(图18~20)。

表1 CTSI与修订的CTSI(MCTSI)
注:MCTSI评分0~2分者为轻度AP,4~6分为中度,8~10分为重度AP。
[1] Türkvatan A,Erden A,Türkoglu MA,et al.Imaging of acute pancreatitis and its complications.Part 1:acute pancreatitis[J].Diagnostic and Interventional Imaging,2015,96(2):151-160.
[2] Zaheer A,Singh VK,Queeshi RO,et al.The revised Atlanta classification for acute pancreatitis:updates in imaging terminology and guidelines[J].Abdominal Imaging,2013,38(1):125-136.
[3] Dupuis CS,Baptista V,Whalen G,et al.Diagnosis and management of acute pancreatitis and its complications[J].Gastrointest Interv,2013,2(1):36-46.
[4] Pallisera A,Adel F,Ramina JM.Classifications of acute panvreatitis:Atlanta and beyond[J].Cent Eur J Med,2014,9(4):543-549.
[5] Bollen TL.Imaging of acute pancreatitis:update of the revised Atlanta classification[J].Radio Clin N Am,2012,50(3):429-445.
[6] Jain S,Gupta S,Chawla AS,et al.Comparative study of Balthazar computed tomography severity index and modified computed tomography severity index in predicting the outcome of acute pancreatitis[J].Apollo Medicine,2014,11(1):74-83.
[7] Wahab S,Khan RA,Ahmad I,et al.Imaging and clinical prognostic indicators of acute pancreatitis;a comparative insight[J].Acta Gastroenterol Latinoam,2010,40(3):283-287.
[8] Park JY,Jeon TJ,Ha TH,et al.Bedside index for severity in acute pancreatitis:comparison with other scoring systems in predicting severity and organ failure[J].Hepatobiliary pancreat Dis Int,2013,12(6):645-650.
[9] 唐明.CT评价急性重症胰腺炎预后的价值[J].放射学实践,2010,25(7):768-771.
[10] Tsuji Y,Takahashi N,Fletcher JG,et al.Subtraction color map of contrast-enhanced and unechanced CT for the prediction of pancreatic necrosis in early stage of acute pancreatitis[J].AJR,2014,202(4):w349-w352.
[11] Hirota M,Satoh K,Kikuta K,et al.Early detection of low enhanced pancreatic parenchyma by contrast-enhanced computed tomography predicts poor prognosis of patients with acute pancreatitis[J].Pancreas,2012,41(7):1099-1104.
[12] Yadav AK,Sharma R,Kandasamy D,et al.Perfusion CT:can it predict the development of pancreatic necrosis in early stage of severe acute pancreatitis?[J].Abdominal Imaging,2014,40(3):488-499.
[13] Türkvatan A,Erden A,Secil M,et al.Fluid collections associated with acute pancreatitis:a pictorial eassy[J].Canadian Association of Radiologists J,2014,65(3):260-266.
[14] Kamal A,Haider M,Askintala VS,et al.Comparison of CT and MRI for quantification of fluid and debris within collection and pancreatic ductal disruption following acute pancreatitis using the revised Atlanta classification 2012:an inter-reader variability study[J].Gastrointestinal Endoscopy,2014,79(55SUPL):AB304.
[15] Zhou J,Ke L,Tong Z,et al.Risk factors and out come of splanchnic venous thrombosis in patients with necrosizing acute pancreatitis[J].Thrombosis Research,2015,135(1):68-72.
[16] Subhash R,Lyoob VA,Bonny N.Complicated acute pancreatitis:the worst-case scenario[J].J Postgraduate Medcine,2012,58(2):154-155.
[17] Yu YH,Sohn JH,Kim TY,et al.Hepatic artery pseudoaneurysm caused by acute idiopathic pancreatitis[J].World J Gastroenterol,2012,18(18):2291- 2294.
[18] Mortelé KJ,Mergo PJ,Taylor HM,et al.Peripancreatic vascular abnormalities complicating acute pancreatitis:contrast-enhanced helical CT findings[J].Eur J Radiology,2004,52(1):67-72.
[19] Koyasu S,Isoda H,Tsuji Y,et al.Hepatic arterial perfusion increases in early stage of severe acute pancreatitis patients:evaluation by perfusion computed tomography[J].Eur J Radiology,2012,81(1):43-46.
[20] Parvin R,Louie T,Pitchumoni CS,et al.Infectious complications of acute pancreatitis[J].Infect Dis Clin Pract,2013,21(2):94-104.
[21] Bollen TL,Singh VK,Maurer R,et al.A comparative evaluation of radiologic and clinical scoring systems in the early prediction of severity in acute pancreatitis[J].Am J Gastroenterol,2012,107(4):612 -619.
050000 石家庄,河北医科大学第二医院影像科
袁涛(1976-),女,河北定州人,博士,副教授,主要从事胸腹部影像诊断工作。
全冠民,E-mail:quanguanmin@163.com
R576; R449; R814.42
A
1000-0313(2015)10-1005-06
10.13609/j.cnki.1000-0313.2015.10.008
2015-03-30
2015-07-13)