副猪嗜血杆菌感染禁食初乳仔猪实验动物模型的构建*
2015-03-29陈洪波赵书红侯永清黎旺明
陈洪波,程 蕾,向 敏,赵书红,侯永清,黎旺明
(1.武汉轻工大学动物科学与营养工程学院,动物营养与饲料安全湖北省协同创新中心,湖北武汉430023;2.武汉市农科院畜牧兽医科学研究所,湖北武汉430208;3.华中农业大学动物科学技术学院,农业动物遗传育种与繁殖教育部重点实验室,湖北武汉430070;4.通城县种畜场,国家级华中两头乌猪(通城猪)保种场,湖北通城437400)
副猪嗜血杆菌(Haemophilus parasuis,HPS)是一种非溶血、NAD依赖性的革兰氏阴性短小杆菌,作为一种机会致病菌,通常存在于健康猪只的上呼吸道部位。毒力菌株侵入机体后可引起菌血症,临床表现以猪格拉泽氏病(Glässer's disease)为主要特征,即纤维蛋白性心包炎、多发性关节炎、脑膜炎,进而使动物败血病症加重;有些感染还导致鼻炎、中耳炎和急性肺炎等[1-2]。目前,HPS已成为猪场最主要的细菌性病原体之一,每年给包括我国在内的世界各国养猪业造成很大损失[2]。由于该菌存在多种血清型并且不同血清型菌株毒力存在较大差异,所以现有疫苗在异源保护方面并不理想[3]。抗生素治疗不仅导致生产成本上升,还会引起一系列社会、环境问题,正迫使人们研发更加有效的预防方案。另外,研究表明:猪群中存在针对HPS感染的遗传差异[4],这使得通过遗传改良途径培育出抗性品系/品种成为可能。构建稳定、可靠的活体感染模型是深入研究这些问题的关键。
根据实验猪只的不同,活体感染模型的构建有多种。自然分娩后、仔猪哺乳期间,细菌可于较早时间经母猪传染给仔猪,所以新生小猪首先会存在针对细菌的被动免疫,随后会建立主动免疫[5-6],因此利用普通仔猪使得实验条件下复制猪格拉泽氏病的稳定性大大降低。Vahle等[7]曾利用剖腹产、禁食初乳仔猪(Caesarean-derived and colostrum-deprived,CDCD)成功复制出了HPS感染,但是该方法要求对母猪实施剖腹产,需要配备专业的外科手术医生、严格的无菌手术室等条件,导致成本极其高昂,并不现实。无特定病原体(Specific pathogen free,SPF)仔猪即HPS阴性仔猪也曾被应用于HPS感染的活体建模[8],但是在目前生产条件下HPS阴性猪群已经很难找到,而且该方法同样对技术要求很高致使成本昂贵,操作难度更大且不可靠。
禁食初乳(colostrum-deprived,CD)仔猪,即仔猪经母猪自然分娩后立即作必要隔离并禁食初乳,使用代乳料饲喂。以CD仔猪作为实验动物可以成功复制HPS感染[9-10]:一方面,由于仔猪出生后与母猪的早期隔离,阻止了HPS于上呼吸道的定植、最大程度上避免了母体抗体的不利影响;另一方面,与CDCD和SPF仔猪相比,饲养期间不需要苛刻的无菌环境,硬件条件相对宽松,操作简单、成本较低。因此,CD仔猪被认为比较适合用于实验条件下的HPS感染建模。鉴于现有相关技术仍存在诸多问题,本研究旨在结合国内实际条件,以不同品种猪只为实验动物进一步探讨利用CD仔猪进行HPS感染的可行性与科学性,并对相关技术流程做进一步优化。
1 材料与方法
1.1 实验动物与试验场地
同日出生通城仔猪(n=12)选自国家级华中两头乌猪(通城猪)保种场;同日出生杜长大三元杂交仔猪(n=15)选自武汉市江夏区某大型畜禽有限公司。母猪自然分娩时实施人工助产,经产道分娩后避免新生仔猪吮吸初乳,禁止其接触母猪、地面、栏舍等;断脐、擦干后立即转入经万金水○R(深圳市某公司)消毒处理的泡沫保温箱中。全部仔猪分娩后于3~5h内运输至武汉市农科院畜牧兽医科学研究所实验动物中心[许可证号:SYXK(鄂)2014-0081];实验中心采用负压净风系统,环境温度25℃左右,进猪前经臭氧彻底消毒处理,保育栏悬挂红外保温灯以辅助仔猪取暖。
1.2 CD仔猪的饲喂
对新生CD仔猪采用婴儿奶瓶饲喂流食,40~45℃温开水冲泡,每餐前对奶瓶清洗后紫外消毒30 min,每只仔猪固定用同一只奶瓶。CD仔猪的1~12日龄均喂食人工乳;13~21日龄采用人工乳并辅助颗粒饲料饲喂,每1L流食中按照颗粒料每日5%~10%的比例递加,对应人工乳粉以5%~10%的比例减少;22日龄后自由采食颗粒饲料和饮水(温开水)。期间,7~21日龄不间断训练采食颗粒饲料(料槽内撒饲)。详细饲喂方案见表1。
1.3 CD仔猪的日常管理
CD仔猪出生后禁食初乳,不进行任何疫苗注射;为减少应激,无断牙、断尾处理,仅利用耳标钳佩戴耳标。

表1 禁食初乳仔猪饲喂方案Table 1 Feeding program for colostrum-deprived piglets
所有CD仔猪1日龄时肌肉注射浓度为10%的右旋糖酐铁注射液1mL(东方澳龙制药有限公司)。1~3日龄时,根据CD仔猪的体重,每天向每头CD仔猪注射50μL/kg的肌注土霉素注射液(华北制药股份有限公司)以防止拉稀。3日龄后若有拉稀发生,则立即转入隔离栏喂养直至康复;期间,根据体重,自发现日起,连续3d,向对应CD仔猪早晚分别注射50μL/kg的土霉素注射液和头孢噻呋钠注射液(齐鲁动物保健品有限公司);加强保暖的同时,每天灌食糖盐水以补充体液,每升糖盐水中含20g葡萄糖、3.5g氯化钠和2.5g碳酸氢钠,攻毒前2周停用任何抗生素药品。对于因打斗等因素造成的外伤及时做消毒、包扎等必要处理。
人员进出实验动物中心均需喷雾消毒(万金水○R经1∶500稀释后使用),动物栏舍等每日喷雾消毒1~2次;动物粪尿每日于消毒后清理。攻毒前不定期利用水银体温计直肠测温以鉴别异常猪只,加强日常观察,每日记录仔猪状态并评分(正常:N,10';异常:A,轻微拉稀或发烧畏寒9',拉稀7',消瘦5';死亡:D,0')。早上给料前,每隔1周空腹称重。
对于因喷雾消毒、人工喂乳导致的仔猪体表过分湿潮,采用猪爽宝(北京清智德成科技有限公司)均匀涂抹躯体以快速干燥体表防止仔猪体温失调。22日龄时,每个品种猪只随机分为两组:对照组和攻毒组,分组后分栏饲养。
1.4 HPS细菌培养与CD仔猪攻毒
HPS(0165菌株,血清型5)由华中农业大学农业微生物国家重点实验室周锐教授惠赠。细菌冻干粉利用TSA平板[5%(v/v)胎牛血清,0.006%(m/v)NAD]划线,37℃培养24~36h后挑取单菌落,然后于TSB液体培养基[5%(v/v)胎牛血清,0.006%(m/v)NAD]中37℃、180rpm扩大培养约12h。对新鲜菌液利用无菌PBS经100万倍稀释,取100μL均匀点涂TSA平板,37℃培养后进行CFU计数,同时,测定新鲜菌液的OD600吸光度;重复多次,建立细菌CFU与OD600值的一元线性回归方程。
35日龄时采集CD仔猪鼻拭子,确认动物为HPS阴性,具体做法为:将采集的鼻拭子迅速置于500μL无菌PBS中,充分震荡10min后于10 000 g离心10min,去掉上清,以离心管底部微量悬液为模板(取1μL)直接进行细菌特异性16SrDNA检测;PCR扩增产物821bp,引物序列为:5'GGCTTCGTCACCCTCTG3'/5'GTGATGAGGAAGGG TGGTGT3'(Tm=60℃)。前腔静脉采集非抗凝外周血2mL,室温静置2h后再于4℃静置6h,然后4℃、8 000rpm离心10min分离血清;利用猪胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae,APP)ApxIV-ELISA抗体检测试剂盒(武汉科前动物生物制品有限责任公司)检测CD仔猪血清APP抗体以判断动物是否存在APP感染,具体方法参照试剂盒说明书。
45~46日龄实施HPS攻毒。攻毒前使用镇定剂麻醉猪只,具体为:空腹称重后肌肉注射0.1mg/kg硫酸阿托品注射液,15min后肌肉注射10mg/kg Zoletil 50®(法国维克);待仔猪麻醉后(约5~10 min)气管内接种致死剂量的HPS细菌109CFU(TSB液体培养基悬浮,共1mL),对照组猪只气管内注射1mL无菌TSB液体培养基;攻毒后肌肉注射0.15mg/kg阿替美唑解除麻醉。
1.5 临床病征观察与数据采集
攻毒后每日定时直肠测温。密切观察猪群状态,共包括以下六项内容:行为举止(机敏性)、呼吸(急促程度)、跛行/关节肿胀(单肢、双肢、倒地)、神经症状(肌肉僵直、颤抖、抽搐、瘫痪)、咳嗽和进食。
1.6 实验动物剖检与样本采集
分别于HPS攻毒前后0dpi(day post infec-tion)、1dpi、3dpi利用一次性真空采血管(武汉致远医疗科技有限公司)经前腔静脉采集2mL外周血(EDTAK2抗凝)用于血液参数分析和细菌分离。攻毒后对垂死猪只经麻醉处理后(方法同前述)放血、剖检,重点检查:腹腔、胸腔、心包腔、大脑、关节等部位。采集腹膜、脾脏、肺脏、心脏、大脑、硬脑膜等组织用于组织病理分析等。
1.7 HPS分离鉴定
取抗凝外周血100μL,利用无菌PBS等倍稀释后涂TSA平板,37℃培养24~36h后挑取HPS疑似单菌落利用PCR法进行鉴定(方法同前述)。利用血液组织细胞基因组提取试剂盒(天根生化)提取肺脏组织以及其中HPS细菌基因组DNA,PCR法扩增HPS 16SrDNA,鉴定HPS(方法同前述)。
1.8 组织病理与血液参数分析
仔细切取适当大小新鲜组织于4%多聚甲醛浸泡固定至少24h,制作石蜡切片,HE染色后用于组织病理分析。利用全自动五分类血细胞分析仪(CELL-DYN○R3700,美国雅培)分析HPS攻毒前后外周血中WBC(白细胞绝对值)、NEU(嗜中性粒细胞绝对值)、LYM(淋巴细胞绝对值)、MONO(单核细胞绝对值)、EOS(嗜酸性粒细胞绝对值)、BASO(嗜碱性粒细胞绝对值)、RBC(红细胞)等22项血液参数。
2 结果与分析
2.1 CD仔猪存活率与生长发育
依据本研究建立的CD仔猪饲喂、管理流程(图1),通城猪和杜长大三元杂交猪至感染前分别死亡2头和3头,存活率分别为83.3%(10/12)和80%(12/15);总体上,存活率达81.5%(22/27)。临床观察发现:腹泻是仔猪死亡的主要原因,多见于4~9日龄,其中1头于35日龄死亡,期间少食甚至拒食,迅速消瘦,病发后2~3天死亡。剖检发现,死亡仔猪中存在卡他性肠炎并伴随肺炎症状;采集病灶组织经麦康凯培养基培养后显示至少存在大肠杆菌感染(数据未列出)。
生长发育方面,通城猪断奶前(21日龄)日增重18~66g不等,平均日增重38g;断奶后(22日龄)至感染前(45日龄)日增重61~247g,平均日增重约154g;杜长大猪断奶前(21日龄)日增重32~69 g,平均日增重51g;断奶后(22日龄)至感染前(46日龄)日增重165~267g,平均日增重约210g。这些数据表明,相对于杂交品种,通城猪在总体上生长速度明显较慢。
2.2 HPS攻毒后CD仔猪临床病征
攻毒前,对健康存活的通城和杜长大CD仔猪的病原体检测显示:两猪群均未无HPS感染(图2,A~B),而且通城猪体内不存在APP(图2C);但所有杜长大猪体内APP血清抗体呈阳性(图2C),表明存在APP野毒感染。实验于22日龄将两个猪群分别随机分为攻毒组和对照组,根据前期利用新鲜菌液建立的HPS细菌OD600值与CFU之间的一元线性回归方程(图2,D~E),于45~46日龄实施气管内接种攻毒。
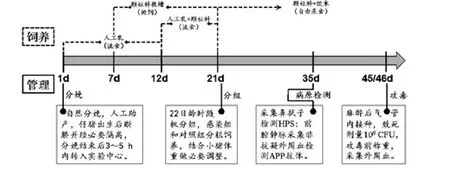
图1 副猪嗜血杆菌感染前禁食初乳仔猪饲养管理程序Fig.1 Feeding and management schedule for colostrum-deprived piglets before HPS
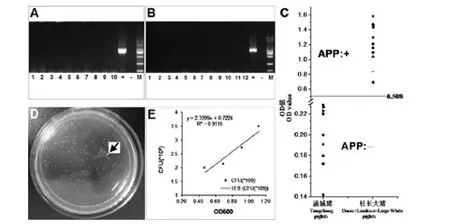
图2 感染前禁食初乳仔猪中副猪嗜血杆菌检测、培养和猪胸膜肺炎放线杆菌检测A.通城仔猪(泳道1~10)中副猪嗜血杆菌检测,“+”为阳性对照(821bp),“-”为阴性对照,“M”为DNA marker(DL2000);B.杜长大仔猪(泳道1~12)中副猪嗜血杆菌检测;C.CD仔猪中APP检测;D.副猪嗜血杆菌TSA平板生长的单菌落(其中箭头所指为杂菌);E.副猪嗜血杆菌CFU与OD600吸光值之间的一元线性回归方程Fig.2 Feeding and management schedule for colostrum-deprived piglets before c HPSA.HPS detections in Tongcheng piglets(lane 1~10).“+”and“-”is the positive and negative control of HPS 16srDNA(821bp),respectively.“M”is the DNA ladder of DL2000.B.HPS detections in Duroc×Landrace×Large white piglets(lane 1~12).C:APP detections in both breeds.D.Single HPS colonies on TSA culture,in which a polluted colony is marked with the arrow.D.The unary linear regression analysis between HPS CFU and OD600
采用致死剂量(109CFU)对CD仔猪气管内接种攻毒后,通城猪临床征状明显,而杜长大三元杂种猪直至感染后2周未呈现任何征状。通城猪于攻毒后12h便表现出畏寒、扎堆、饮食废绝,严重个体甚至已不愿站立;24h后猪只中出现跛行、关节肿大的典型征状,个别的呈现出急性败血症状或严重的神经症状。36h起感染猪只开始陆续死亡,其中,2头于2dpi死亡(36hpi、40hpi),3头于3dpi死亡(50hpi、52hpi、68hpi),1头于4dpi死亡(76hpi);期间,对照组猪只一直正常。
2.3 攻毒前后CD仔猪体温变化
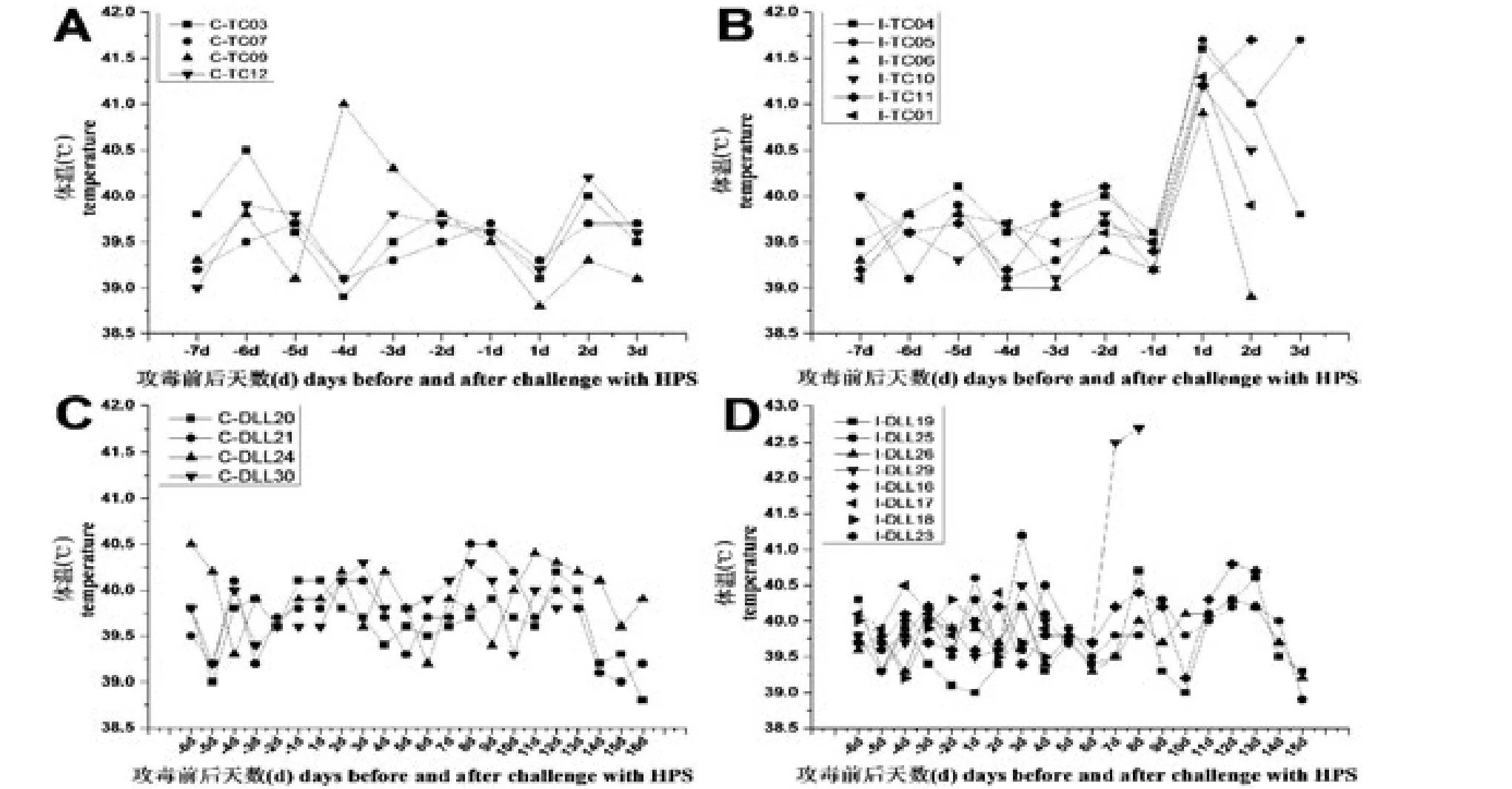
图3 副猪嗜血杆菌感染前后禁食初乳仔猪体温变化图A和图B分别代表通城猪对照组和攻毒组,图C和图D分别代表杜长大猪对照组和攻毒组;“C”和“I”分别表示“对照”和“感染”。Fig.3 Body temperature changes in colostrum-deprived piglets before and after HPSTemperatures of the control groups(“C”)and HPS challenged(“I”)groups from Tongcheng(TC)and Duroc×Landrace× Large white(DLL)breeds are presented in figures A~B and C-D,respectively.
攻毒前,通城CD仔猪总体体温基本保持在38.5~40℃,平均39.5℃(图3,A~B);HPS感染后,对照组猪只体温无明显变化,而攻毒组仔猪体温于1日内便明显升高,甚至接近42℃(图3B),部分急性感染仔猪因为濒临死亡,攻毒后2天体温开始下降。攻毒前,绝大多数杜长大CD仔猪体温基本保持在39~40℃,个别猪只略微高于40℃(图3,C~D);HPS感染后,除攻毒组中1头仔猪体温明显升高外(6~8dpi),无论对照组还是攻毒组体温2周内均无明显变化。
2.4 实验动物剖检与组织病理
HPS攻毒后,所有通城仔猪表现出严重的败血症状,尤其是在四肢末端和吻突最为明显,此外体表其他部位也呈现出败血病征(图4A)。剖检分析显示,HPS感染导致仔猪肺脏(图4D)等组织不同程度地出现炎症变化,其中,纤维素性浆膜炎主要集中在腹腔(图4E)、胸腔和心包腔(图4G);尤其在心脏表面可见大量纤维素沉积。此外,在腹腔、胸腔、心包腔和关节腔(图4B)有大量积液产生,甚至腹腔积液较为浑浊(伴随纤维素渗出)。肉眼观察未在脑部(硬脑膜)发现明显病变;对照组动物未见上述炎症病变(图4,H和I)。
石蜡组织切片镜检后发现(图5),尽管剖检显示脑部病征不明显但是HPS感染可能导致仔猪伴随较为严重的纤维素-化脓性脑膜炎,与腹膜、心脏组织类似,感染后大脑中也存在较多的白细胞侵润。细菌感染还导致心脏、脾脏、肺脏在组织形态上发生较大改变,主要表现为组织结构松软,中间充斥较多的纤维蛋白沉积;此外,脾脏组织动脉外周淋巴鞘(periarterial lymphoid sheath,PALS)和淋巴滤泡中淋巴细胞数量明显减少(可能与细菌感染导致的淋巴细胞溶解有关)。HPS感染还导致发病猪只肺脏、脾脏、腹膜和大脑组织中不同程度地出现血管充血、肿胀、凝血甚至性成血栓,这些组织病理变化与临床上观察到的急性败血症状相吻合。
2.5 攻毒后HPS分离鉴定
HPS攻毒后采集外周血,经TSA平板培养后发现绝大多平板有菌落生成且生长速度较快(37℃恒温培养5~6h后即形成肉眼可见菌落),菌落形态鉴别显示大多不是HPS(杂菌),这通过对细菌特异性基因的PCR扩增后得以进一步证实。但是部分仔猪的TSA血平板上疑似目的菌,与杂菌相比,疑似菌生长速度较慢而且呈透明或半透明状,区别十分明显(图6B)。同时以杂菌和标准HPS细菌为对照,PCR扩增后发现:在经HPS攻毒的6头通城仔猪中有4头仔猪外周血中分离出了HPS(图6 A)。其中,对04、06、11号仔猪于攻毒后1天内便可以检出(图6A中分别编号为0401、0601、1101);对05号仔猪于攻毒后第3天检出(0503)。部分仔猪由于在攻毒后较早死亡,试验中未做检测。实验分别随机选择3头攻毒和对照仔猪,对肺脏组织中细菌特异性基因的PCR扩增结果显示,攻毒组仔猪中肺部存在HPS病原体(图6C)。
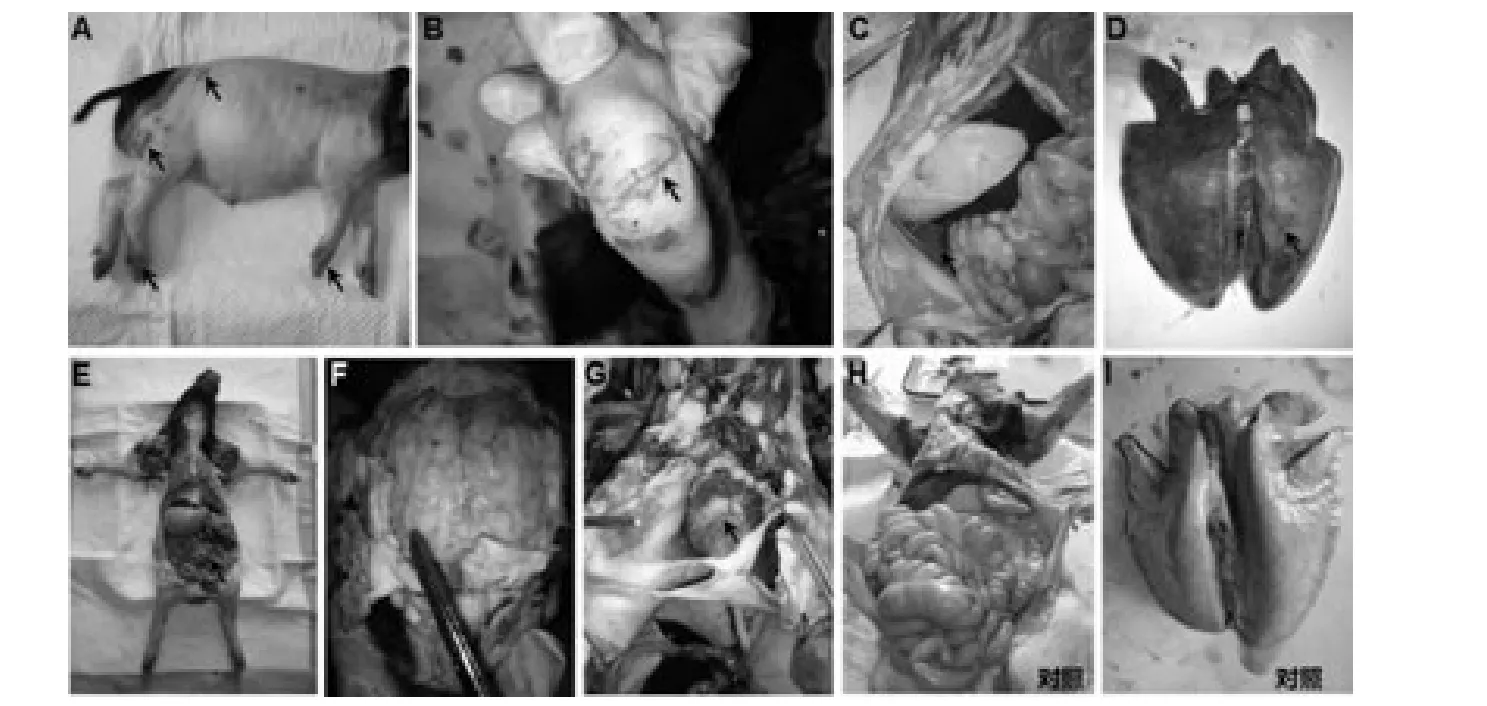
图4 副猪嗜血杆菌感染后通城仔猪剖检分析Fig.4 Gross findings of necropsy in Tongcheng piglets afte HPS challenge
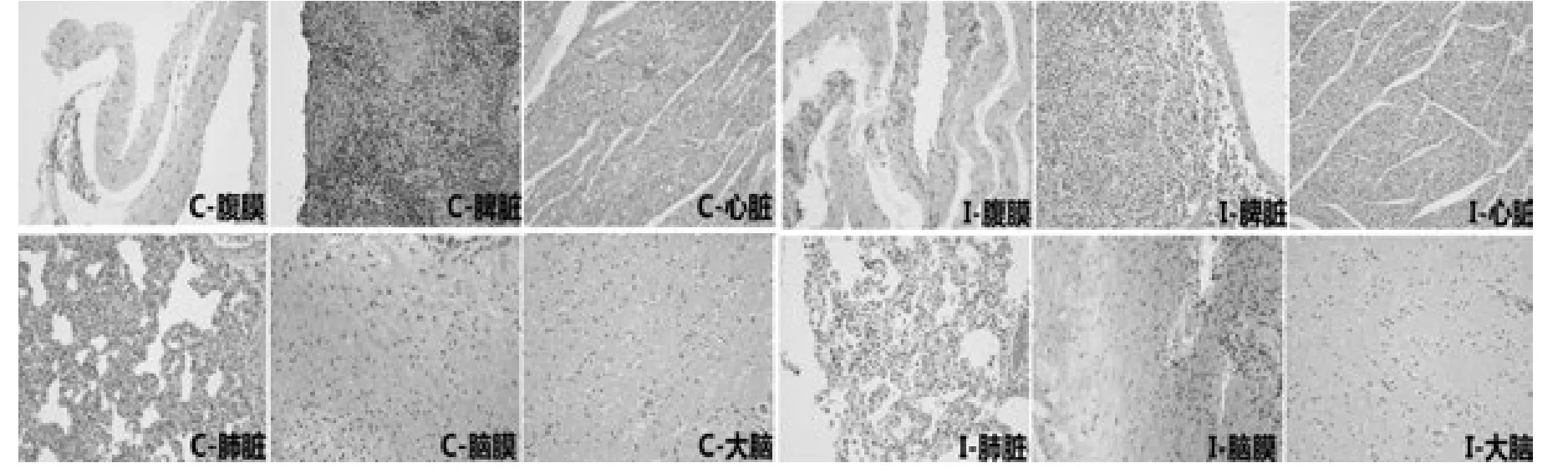
图5 副猪嗜血杆菌感染后通城仔猪组织病理分析(×200)对照组织和感染组织分别以“C”和“I”标识Fig.5 Histopathological findings in tissues of Tongcheng piglets after HPS challenge(×200)Tissues from the control group and HPS infected group are marked with“C”and“I”,respectively
2.6 HPS感染后外周血细胞亚类分析
血液五分类结果(图7)表明,致死剂量细菌感染后仔猪外周血中红细胞(RBC)和总白细胞(WBC)数量未发生明显变化。但是具体到白细胞亚类,嗜中性粒细胞(NEU)和嗜酸性粒细胞(EOS)感染后有增殖趋势;而淋巴细胞(LYM)和单核细胞(MONO)呈下降趋势,其中以前者较为明显,这与组织病理观察到的脾脏中的情况相一致。嗜碱性粒细胞(BASO)在外周血中的水平一直很低,由于部分样本中BASO检测失败,本研究未做进一步分析。
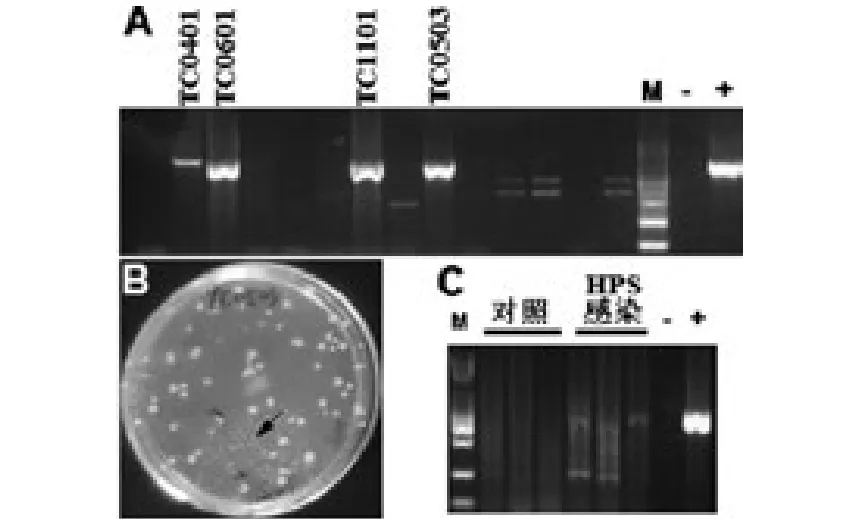
图6 副猪嗜血杆菌感染后通城仔猪中细菌分离与PCR鉴定A.血液-TSA平板的菌落PCR鉴定;B.血液中分离出HPS细菌的代表性TSA平板,箭头所指为HPS菌落(较大菌落为杂菌);C.肺脏组织中HPS细菌的PCR鉴定Fig.6 Bacteria isolation and PCR from Tongcheng piglets challenged with HPSA.Image of the PCR results from blood-TSA cultures.B.Representative image of the blood-TSA culture,in which HPS colonies are marked with the arrow(bigger colonies are the polluted bacteria).C.PCR result of HPS specific 16s rDNA from control and challenged lungs

图7 副猪嗜血杆菌感染前后通城仔猪外周血细胞水平变化Fig.7 Changes of peripheral blood cells in Tongcheng piglets before and after HPS
3 讨 论
由于绝大多数猪场均不同程度地存在HPS,仔猪出生后通过与母猪、栏舍等接触可以在很短时间内被感染,通常细菌会驻留在扁桃体[6]、气管[8]和鼻腔[11]中,但并无发病表现,这主要是由于受母体抗体(初乳中)和仔猪自身随后建立的主动免疫双重因素的影响[5-6]。但作为一种机会致病菌,仔猪本身的免疫状态与HPS感染发病关系密切[5];此外,断奶应激、转群应激以及其他病原体协同感染均有可能诱发格拉泽氏病[2]。所以,利用普通断奶仔猪复制HPS感染不仅比较困难而且非常不稳定。与利用CD仔猪复制HPS感染相比,利用CD仔猪不仅可以稳定地复制出格拉泽氏病,而且操作更为简单、经济[9-10]。
保证CD仔猪存活率是复制HPS感染的前提,也最为关键。与Blanco等[10]不同,本研究采用商业化的仔猪代乳料饲喂仔猪,因为对于大部分实验室获得牛初乳可能比较困难,此外,牛初乳需要做消毒处理,不仅增加了操作的复杂性而且有可能因处理不当加重仔猪腹泻甚至感染新的病原体。为了减少应激,我们一直使用奶瓶饲喂人工乳至21日龄,期间自7日龄起训练小猪采食颗粒料,尽管个别仔猪早在7日龄会舔食颗粒料,但均属于较为随机的采食行为。一般来讲,15日龄内仔猪很难主动采食颗粒饲料。所以,之前研究[9-10]中于4日龄断奶后转为颗粒料流食喂养至15日龄的强化训练做法很可能会增加仔猪应激。本研究通过较长时间的人工乳喂养与13日龄起渐进式地向颗粒饲料过渡(图1),总体上使得仔猪感染前成活率达81.5%,高于国外实验室29%[9]或79%[10]的水平。
影响HPS感染的诸多因素中不仅包括母体抗体和仔猪免疫状态,相关病症的出现与否可能还与其他病原体感染有关。采用致死剂量HPS攻毒后所有通城仔猪症状明显并且于4日内发病死亡;而杜长大仔猪直至攻毒后2周不仅未见体温升高也无明显临床病征。尽管感染前通城仔猪和杜长大仔猪均显示为HPS阴性,但是ELISA检测发现杜长大仔猪中存在APP感染(图2C);由于APP与HPS同属巴斯德菌科,二者之间可能存在交叉免疫保护。有意思的是,Fu等[12]证明:采用基因缺失的APP减毒活菌株免疫仔猪后可以对致死剂量的HPS感染产生免疫保护。所以,本研究中利用杜长大CD仔猪复制HPS感染失败极可能与APP血清抗体的交叉保护有关。这也提示我们,复制猪格拉泽氏病至少要保证实验动物为HPS和APP双阴性猪。但由于HPS也会引起肺炎症状,同时流行病学调查发现该细菌存在与其他多种重大病原体如猪蓝耳病病毒(Porcine Reproductive and Respiratory Syndrome virus,PRRSV)、猪流感病毒(Swine Influenza Viruses,SIV)、猪圆环病毒II型(Porcine Circovirus type-2,PCV-2)、猪链球菌(Streptococcus suis,S.suis)、猪胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae,APP)、致病性埃希氏大肠杆菌(E.coli)等存在协同感染情况[13-15],故对CD仔猪的筛选方面充分考虑这些病原体是非常有必要的,尽管结合国内大部分猪场的实际情况来看有可能会比较困难。
针对HPS感染的CD仔猪模型,不同的科研人员关注点可能存在差异。根据病发的具体情况基本可以分为三种:急性感染、亚急性感染和慢性感染。利用免疫背景清晰、简单的CD仔猪作实验动物可能会更容易把握这一点。因为在排除复杂免疫因素的影响之后,通过准确控制攻毒剂量便有望可以构建出理想的活体感染模型。我们发现,使用新鲜HPS菌液统计细菌数量是非常必要的,倘若菌液室温放置过久或过夜冷藏保存,统计结果甚至会存在数量级上的差异。本研究结果表明,细菌剂量为109CFU时可导致100%的通城CD仔猪发病,其中大部分可以存活3天,个别猪只死亡较早,暗示还存在影响病程的其他因素;我们结合临床感染病发情况推测体重可能是其中一个非常重要的因素。Blanco等[10]研究证实:细菌剂量为108CFU时可导致94%的CD仔猪发病并推测更高剂量可能导致猪只迅速休克[10]。结合上述结果,经气管内攻毒时急性感染模型可以以1×109CFU为参照通过加大剂量调整,而亚急性和慢性模型可以以5×108CFU为参照通过减小剂量调整,直至5×107CFU。照此,品种因素可以不予考虑,而若采用其他攻毒途径如鼻腔接种,对应剂量可能需要加大,需要进一步研究。
从感染动物体内分离出HPS细菌是判定动物模型效果的重要参考之一,除此之外还要密切结合临床病症。本研究中所有通城CD仔猪经致死剂量攻毒后尽管死亡时间存在差异,但是相关病程基本相同,临床表现也十分相似,均出现明显的败血症和神经性症状并伴随关节肿大、不愿站立等情形。剖检分析显示所有攻毒组动物存在腹膜炎伴随浑浊腹腔积液,但心脏部位的病变程度存在一定差异。作为一种重要的猪细菌性呼吸道疾病病原体,肺脏分菌是优先选项。但实验条件下可能由于不同猪只的感染程度不同,其他组织中(如腹膜、心包膜、关节液等)分出细菌的情况也存在不同[10]。另外,HPS感染可以引起菌血症[2],所以对于多时间点的研究来讲血液可以作为首选样本用于细菌分离。本研究直接对新鲜抗凝血涂布TSA平板成功分离出了HPS,但是也有血液HPS为阴性的情况。有可能是杂菌的存在抑制了HPS的生长,也有可能是血液中细菌含量很低,利用TSA固体培养基难以分离。下一步,我们将把TSA平板培养与血液样本中总DNA的PCR扩增结合起来,有望会使结果更准确。
本研究利用五分类血细胞分析仪初步对HPS攻毒后通城CD仔猪的血液参数进行了分析,发现HPS可以抑制淋巴细胞的增殖(图7),但由于血液参数分析本身的技术限制没有直接揭示具体的淋巴细胞类型。我们之前对HPS感染后脾脏转录组变化的研究揭示出淋巴组织结构与发育功能(Lymphoid Tissue Structure and Development)以及Th、CTL、B细胞相关典型信号通路(canonical pathway)被抑制[16],这也与本研究对脾脏组织病理的分析结果一致;与本研究结果相对应,Frandoloso等[17]利用流式细胞术对于HPS感染后细胞免疫应答的最新研究结果发现,感染显著抑制CD3+γδTCR+细胞和CD3ε+CD8α+CD8β+细胞增殖。综上所述,HPS可能通过抑制宿主获得性免疫应答(具体为T淋巴细胞应答)实现免疫逃避,这为具体深入探讨相关分子致病机制指明了方向。有意思的是,我们发现HPS攻毒后血液单核细胞呈下降趋势;de la Fuente等[18]研究结果显示,尽管感染导致外周血单核细胞(PBMC)中SWC3+单核细胞和粒细胞数量增加,但似乎对宿主的免疫保护作用不大;随后他们发现PBMC中CD172α+CD163+单核细胞于感染后显著增加,但单核细胞组织相容性分子SLAIIDR却与此同时发生下调表达[17]。我们推测,这种不一致性可能与不同感染模型中单核细胞增殖或者进入组织中(成为巨噬细胞)的程度不同有关,我们通过综合分析多个实验室的转录组变化数据后发现,肺泡巨噬细胞在抵抗HPS感染中可能具有极其重要的作用(未发表数据)。我国于2001年将通城猪等19个猪种列为国家级重点地方品种[19],Zhou等[20]和Li等[21]研究表明通城猪对PRRSV感染具有较为明显的抗性,并初步鉴定了相关抗性基因。因此,针对HPS感染深入探讨通城猪相关细胞免疫应答的抗性研究,对于系统挖掘我国著名地方猪种优势基因资源具有重要意义。
4 结 论
(1)本研究结合国内实际通过对CD仔猪饲养管理流程的进一步优化提高了仔猪存活率。
(2)经致死剂量HPS攻毒后通城CD仔猪具有典型的格拉泽氏病病征,成功构建了HPS感染CD仔猪的活体研究模型。
(3)研究为下一步更加清晰探讨HPS不同感染模式下宿主-病原体互做的分子机制奠定了基础,也为猪其他重大病原体活体感染模型的构建提供了参考。
[1] Oliveira S,Pijoan C.Haemophilus parasuis:new trends on diagnosis,epidemiology and control[J].Veterinary Microbiology,2004(99):1-12.
[2] Brockmeier S L,Register K B,Kuehn J S,et al.Virulence and Draft Genome Sequence Overview of Multiple Strains of the Swine Pathogen Haemophilus parasuis[J].PLoS ONE,2014,8:e103787.
[3] Miniats O P,Smart N L,Rosendal S.Cross protection among Haemophilus parasuis strains in immunized gnotobiotic pigs[J].Canadian Journal of Veterinary Research,1991(55):37-41.
[4] Blanco I,Canals A,Evans G,et al.Differences in susceptibility to Haemophilus parasuis infection in pigs[J].Canadian Journal of Veterinary Research,2008(72):228-235.
[5] Solano-Aguilar G I,Pijoan C,Rapp-Gabrielson V,et al.Protective role of maternal antibodies against Haemophilus parasuis infection[J].American Journal of Veterinary Research,1999(60):81-87.
[6] Oliveira S,Batista L,Torremorell M,et al.Experimental colonization of piglets and gilts with systemic strains of Haemophilus parasuis and Streptococcus suis to prevent disease[J].Canadian Journal of Veterinary Research,2001(65):161-167.
[7] Vahle J L,Haynes J S,Andrews J J.Interaction of Haemophilus parasuis with nasal and tracheal mucosa following intranasal inoculation of cesarean derived colostrum deprived(CDCD)swine[J].Canadian Journal of Veterinary Research,1997(61):200-206.
[8] Segales J,Domingo M,Solano-Aguilar G I,et al.Immunohistochemical detection of Haemophilus parasuis serovar 5in formalin-fixed,paraffin-embedded tissues of experimentally infected swine[J].Journal of Veterinary Diagnostic Investigation,1997(9):237-243.
[9] Oliveira S,Galina L,Blanco I,et al.Naturally-farrowed,artificially reared pigs as an alternative model for experimental infection by Haemophilus parasuis[J].Canadian Journal of Veterinary Research,2003(67):146-150.
[10] Blanco I,Galina-Pantoja L,Oliveira S,et al.Comparison between Haemophilus parasuis infection in colostrum-deprived and sow-reared piglets[J].Veterinary Microbiology,2004(103):21-27.
[11] Amano H,Shibata M,Kajio N,et al.Pathologic observations of pigs intranasally inoculated with serovar 1,4and 5of Haemophilus parasuis using immunoperoxidase method[J].Journal of Veterinary Medical Science,1994(56):639-644.
[12] Fu S,Ou J,Zhang M,et al.The live attenuated Actinobacillus pleuropneumoniae triple-deletion mutant DapxIC DapxIIC DapxIV-ORF1strain,SLW05,immunizes pigs against lethal challenge with Haemophilus parasuis[J].Clinical and Vaccine Immunology,2013(20):134-139.
[13] Fablet C,Marois C,Kuntz S G,et al.Longitudinal study of respiratory infection patterns of breeding sows in five farrowto-finish herds[J].Veterinary Microbiology,2011(147):329-339.
[14] Yu J,Wu J,Zhang Y,et al.Concurrent highly pathogenic porcine reproductive and respiratory syndrome virus infection accelerates Haemophilus parasuis infection in conventional pigs[J].Veterinary Microbiology,2012(158):316-321.
[15] Karg G,Bilkei G.The effect of season and vaccination for Gl?sser's disease and post-weaning Coli bacillosis in an outdoor pig unit endemically infected with virulent strain of Haemophilus Parasuis serotype 5and pathogenic Escherichia coli[J].Journal of Veterinary Medicine Series B-infectious Diseases and Veterinary Public Health,2002(49):464-468.
[16] Chen H,Li C,Fang M,et al.Understanding Haemophilus parasuis infection in porcine spleen through a transcriptomics approach[J].BMC Genomics,2009(10):64.
[17] Frandoloso R,Martinez-Martinez S,Yubero S,et al.New insights in cellular immune response in colostrum-deprived pigs after immunization with subunit and commercial vaccines against Gl?sser's disease[J].Cell Immunology,2012(277):74-82.
[18] De La Fuente A J,Gutierrez-Martin C B,Rodriguez-Barbosa J I,et al.Blood cellular immune response in pigs immunized and challenged with Haemophilus parasuis[J].Research in Veterinary Science,2009(86):230-234.
[19] Yang J,Wang J,Kijas J,et al.Genetic diversity present within the near-complete mtDNA genome of 17breeds of indigenous Chinese pigs[J].Journal of Heredity,2003(5):381-385.
[20] Zhou P,Zhai S,Zhou X,et al.Molecular characterization of transcriptome-wide interactions between highly pathogenic porcine reproductive and respiratory syndrome virus and porcine alveolar macrophages in vivo[J].International Journal of Biological Sciences,2011(7):947-959.
[21] Li Z,Chen R,Zhao J,et al.LSM14Ainhibits porcine reproductive and respiratory syndrome virus(PRRSV)replication by activating IFN-βsignaling pathway in Marc-145[J].Molecular and Cellular Biochemistry,2015(1-2):247-256.
