PCV2Rep蛋白N-糖基化位点突变对病毒复制的影响
2015-03-29徐胜男时建立徐绍建吴晓燕丛晓燕杜以军吴家强王金宝
徐胜男,时建立,彭 喆,徐绍建,吴晓燕,丛晓燕,杜以军,吴家强,李 俊*,王金宝*
(1.青岛农业大学动物科技学院,山东青岛266109;2.山东省畜禽疫病防治与繁育重点实验室,山东济南250100;3.山东省农业科学院畜牧兽医研究所,山东济南250100)
猪圆环病毒(Porcine circovirus,PCV)是1974年由德国学者Tischer等首次从猪肾传代细胞(PK15)中分离得到,1982年被命名为猪圆环病毒[1]。猪圆环病毒分为两个血清型,即PCV1和PCV2。其中,只有PCV2具有致病性,能引起断奶仔猪多系统衰竭综合征(Post weaning multisystemic wasting syndrome,PMWS),皮炎和肾病综合征(Porcine dermatitis and nephropathy syndrome,PDNS),增生性坏死性间质性肺炎(Proliferative and necrotizing pneumonia,PNP)等疾病[2],给养猪业造成严重的经济损失。目前该病毒已成为国内外研究的热点,但其致病机制目前尚未完全清楚。
猪圆环病毒2型主要由与病毒复制相关的Rep蛋白,与免疫原性相关的Cap蛋白及ORF3编码的与细胞凋亡相关的非结构蛋白3种蛋白组成[3],其中Rep蛋白含有3个N-糖基化位点,即23~25aa(NPS)、256~258aa(NQT)和286~288aa(NAI)[4]。糖基化作为一种主要的翻译后修饰对蛋白质功能有着重要影响,病毒蛋白的糖基化在病毒的生命周期中起着重要的作用。目前有PCV2Cap蛋白N-糖基化位点突变对PCV2核酸疫苗免疫原性影响的报道[5],但Rep蛋白N-糖基化位点突变在病毒复制及致病性中的作用如何未见报道。
Fenaux等[6]报道,双拷贝PCV2DNA克隆的感染性明显强于单拷贝PCV2DNA克隆,拯救病毒的增殖滴度接近其亲本病毒。因此,本研究拟在前期实验室构建好的单拷贝PCV2感染性克隆[7]的基础上,获得三个单点突变的双拷贝PCV2全长感染性克隆。在体外拯救突变病毒的基础上,进行接种PK-15细胞,研究突变病毒的复制性,以明确Rep蛋白N-糖基化位点突变对病毒复制的影响,为进一步阐明PCV2的复制及致病机制提供参考。
1 材料与方法
1.1 细胞和质粒
无猪圆环污染的PK-15细胞、重组质粒PEASY-Blunt-PCV2、单拷贝突变体感染性克隆M 23、M 256、M 286由山东省畜禽疫病防治及繁殖重点实验室制备保存。
1.2 主要试剂
PCR引物由上海生工生物工程股份有限公司合成;TransStartTM FastPfu DNA聚合酶、Trans-T1感受态细胞、pEASY-Blunt Cloning Kit购自北京全式金生物技术有限公司;普通质粒小提试剂盒、DNA纯化回收试剂盒购自天根生化科技(北京)有限公司;T4DNA连接酶、dNTP、DNA Marker DL-2 000和DL-5 000购自宝生物工程(大连)有限公司;限制性核酸内切酶BamHI、SacII、XhoI购自NEB有限公司;LipofectamineTM 3 000、胰酶、DMEM细胞培养基购自英潍捷基(上海)贸易有限公司;PCV2/Cap单克隆抗体由山东省畜禽疫病防治及繁殖重点实验室制备保存;D-氨基葡萄糖、FITC标记的羊抗鼠的二抗均购自美国Sigma-Aldrich公司。
1.3 主要仪器
PTC-2000型PCR仪购自美国MJResearch公司;核酸定量仪购自购自美国Thermo公司;Light-Cycle480购自美国罗氏公司;冷冻离心机购自德国Eppendorf公司;CO2培养箱购自美国Thermo公司。
1.4 引物设计
根据GenBank上已发表的PCV2基因序列,利用Premier 5.0软件设计、合成1对含有SacII、XhoI酶切位点及1对含有SacII、BamHI酶切位点的能扩增PCV2全长的PCR引物P1、P2、P3、P4。
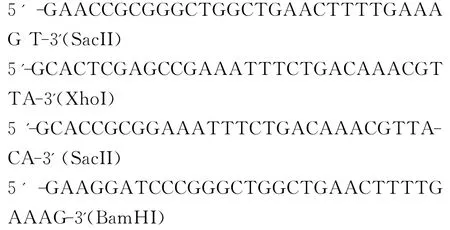
1.5 双拷贝突变体2M23、2M256、2M286及未突变体2PCV2的构建
1.5.1 A片段的构建 分别以重组质粒PEASYBlunt-PCV2及单拷贝突变体感染性克隆M 23、M 256、M 286为模板,P1、P2为引物扩增其全长。使用50μL体系:引物(10μM各2μLdNTPs10 mM)2μL;TransStartTM FastPfu DNA聚合酶1 μL;5×TranStart FastPfu Buffer 10μL;模板20倍稀释后取2μL;灭菌水补齐50μL。反应程序为:预变性95℃10min,变性95℃1min,退火59℃1min,延伸72℃2min,共35个循环;最后72℃延伸10min。跑胶回收1 767bp的片段并用XhoI、SacII限制性内切酶进行双酶切、胶回收后命名为A片段。
1.5.2 B片段的构建 分别以重组质粒PEASYBlunt-PCV2及单拷贝突变体感染性克隆M 23、M 256、M 286为模板,用引物P3、P4扩增其全长,其他同1.5.1。胶回收1 767bp的片段并用BamHI、SacII限制性内切酶双酶切、胶回收后命名为B片段。
1.5.3 C载体的构建 将重组质粒PEASY-Blunt-PCV2进行XhoI、SacII限制性内切酶双酶切,跑胶回收大小约为3 900bp的片段并命名为C载体。
1.5.4 D载体的构建 将A片段用T4DNA连接酶连入C载体。双酶切验证正确后命名为D载体。1.5.5 双拷贝感染性克隆的构建 用BamHI、SacII限制性内切酶双酶切D载体,跑胶回收大小约为5 700bp的片段,将B片段连入该载体,转化Trans-T1感受态细胞中,并进行双酶切、测序鉴定。
1.6 重组质粒转染及间接免疫荧光检测
将生长到对数期的无PCV污染的PK-15细胞用胰酶进行常规消化铺6孔板,每空2mL,密度为0.25×106~1×106,37℃培养。待细胞铺满70%~90%时按照LipofectamineTM3 000转染试剂盒说明书将2M23、2M256、2M286和2PCV2DNA克隆质粒转染无PCV污染的PK-15细胞,并设立空载体转染为对照。在转染后48h参照文献[8]中的方法,对转染细胞进行洗涤、固定等处理后,用PCV2/Cap单克隆抗体作为一抗,用FITC-羊抗鼠IgG作为二抗,进行间接免疫荧光试验(IFA)来检测病毒抗原;同时将部分拯救病毒接种新培养的PK-15细胞并连续传至5代。
1.7 拯救病毒TCID50的测定
取拯救病毒2M23、2M256、2M286和2PCV2每一代的细胞培养物分别以10-1~10-8的稀释度接种到96孔细胞板,培养72h后进行IFA检测,按照Reed-Muench法计算其TCID50。测定拯救病毒在细胞中的增殖规律。
1.8 荧光定量PCR检测细胞的病毒载量
将盲传至第5代的细胞毒2M23、2M256、2M 286和2PCV2DNA反复冻融后分别提取DNA,用实验室之前建好的以0RF2为靶基因的SYBRGreen实时荧光定量PCR方法进行定量检测[9],研究细胞中病毒核酸的变化规律。反应体系为25 μL:2×SYBR Premix Ex TaqTM 12.5μL、引物各1μL、模板2μL、去离子水8.5μL。荧光定量PCR反应条件为:95℃5min,95℃20s,55℃20s,70℃30s且收集荧光信号,40个循环。
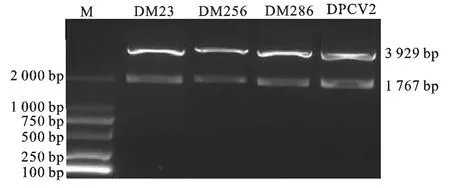
图1 D载体双酶切鉴定结果Fig.1 Restriction enzyme digestion identification of D vector by enzyme digestion
2 结果与分析
2.1 双拷贝2M23、2M256、2M286和2PCV2感染性克隆的鉴定
将D载体用XhoI、SacII进行双酶切产生2个条带,大小分别与PEASY-Blunt载体片段(3 929 bp)和A片段(1 767bp)相符(图1)。2M23、2M 256、2M286和2PCV2经BamHI、SacII双酶切后得到2个条带,大小分别与D载体(5 700bp)和B片段(1 767bp)相符(图2)。
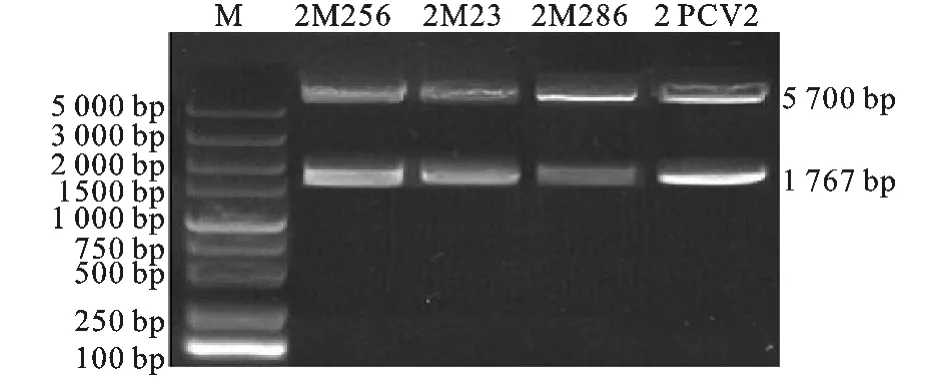
图2 双拷贝感染性克隆酶切鉴定结果Fig.2 Identification of double copies Infectious clone by enzyme digestion
2.2 测序鉴定结果
将重组质粒2M23、2M256、2M286和2PCV2及盲传5代后的拯救病毒DNA进行测序鉴定。结果显示,双拷贝全基因组按照预先设计的成功顺式串联入载体;盲传5代后的病毒DNA除之前设计的ORF1 23aa、256aa、286aa位点由天冬酰胺(N)突变为天冬氨酸(D)之外,其他均与PCV2SD1全基因组(DQ346683)序列完全相同,没有出现其他任何变异。
2.3 IFA检测结果
将盲传5代的转染重组质粒2M23、2M256、2M 286和2PCV2及空载体在72h以后进行IFA检测。如图3所示,所有拯救病毒都能检测到特异性荧光信号,其中2M286和2PCV2(图3C、D)的荧光强度和荧光数量明显高于2M23和2M256(图3A、B),而转染空载体的PK-15细胞则没有特异性荧光染色。检测结果表明,PCV2Rep蛋白N-糖基化位点突变后病毒均能在PK-15细胞内表达,但N-糖基化位点23~25aa、256~258aa突变后表达量明显低于未突变体病毒;N-糖基化位点286~288aa突变后对表达量影响较小。

图3 拯救病毒IFA的检测结果(200×)Fig.3 Rescued viruses detected by IFA(200×)
2.4 病毒TCID50的测定结果
对上述拯救的病毒以1∶5的比例感染PK-15细胞进行传代培养,表明1~2代的拯救病毒增殖比较缓慢,自第3代起病毒增殖加快,传至第5代病毒
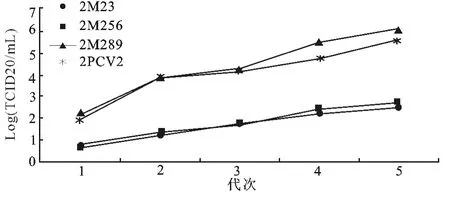
图4 拯救病毒不同代次病毒体外增殖曲线Fig.4 Growth curve of the rescued viruses during different passages
2.5 细胞病毒载量检测结果
用SYBR-Green实时荧光定量PCR方法对突变病毒和亲本病毒进行细胞中病毒载量的定量检测,各突变体病毒与亲本病毒相比差异显著(P<0.05)。PCV2Rep蛋白的23~25aa、256~258aa N-糖基化位点突变后降低病毒的复制能力册,而286~288aa N-糖基化位点突变后能增强病毒的复制能力(图5)。
3 讨 论
PCV2是引起猪圆环病毒疾病的主要致病因子,是危害目前世界养猪业的重要病原[10]。由于基因型的改变和基因组大小的变化均发生在ORF2内[11],因此人们的研究热点均集中在PCV2Cap蛋白,而ORF1的研究相对较少。ORF1作为PCV2最大的开放阅读框编码的Rep蛋白对病毒的复制至关重要,PCV1与PCV2相比较,Rep蛋白氨基酸序列同源性达86%,这也是2种血清型PCV病毒产生抗原交叉性的主要原因所在[12],所以对PCV2Rep蛋白的研究也至关重要。
N-糖基化在病毒的发病机理和免疫逃避中扮演着重要的角色[13],在病毒颗粒的包装和成熟、感染力及扩散等方面也有着重要的作用[14]。因此,这一领域的研究已成为近年来的研究热点。将PCV2的Cap蛋白N-糖基化位点突变后的PCV2核酸疫苗免疫小鼠能增强DNA疫苗在小鼠体内的特异性反应[5]。为研究Rep蛋白上N-糖基化位点突变后对病毒生理特性的影响,本试验构建了双拷贝单点突变PCV2全长感染性克隆。在体外拯救病毒的基础上,研究N-糖基化位点突变对病毒复制的影响。
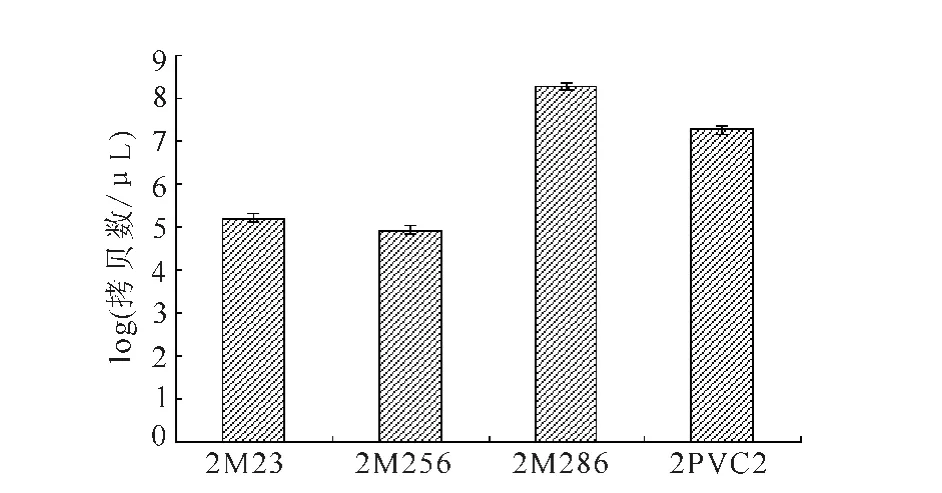
图5 细胞中病毒的定量检测Fig.5 Quantitative detection of virus in cells
本研究结果表明,PCV2Rep蛋白的23~25毒价基本稳定。2M232M256突变体病毒毒价明显低于未突变体病毒2PCV2;2M286突变体病毒毒价要稍高于未突变病毒2PCV2的毒价(图4)。aa、256~258aaN-糖基化位点突变后病毒的复制能力明显降低,286~288aaN-糖基化位点突变后反而增强病毒的复制能力。对于N-糖基化两点和三点之间的相互作用,以及对病毒致病力的影响如何需要进一步研究。
[1] Tischer I,Rasch R.Characterization of papovavirus and picornavirus-like particles in permanent pig kidney cell lines[J].Zentralbl Bakteriol,1974,226(2):153-167.
[2] Joaquim Segalés,Carles Rosell,Mariano Domingo,et al.Pathological findings associated with naturally acquired porcine circovirus type 2associated disease[J].Veterinary Microbiology,2004,98(2):137-149.
[3] Liu J,Chen1,Kwang J,et al.Characterizations of a previously unidentified viral protein of porcine circovirus type2infected cells and its role in virusinduced apoptosis[J].J.Virol,2005(79):8262-8274.
[4] Husa P,Chalupa P,Husova L,et al.The SEN virus-will there be another letter in the alphabet of viral hepatitis[J].Vnitr Lek,2002,48(8):763-766.
[5] Jinyan Gu,Ruibin Cao.Deletion of the single putative N-glycosylation site of the porcine circovirus type 2Cap Protein enhances specific immune responses by DNA immunisation in mice[J].The Veterinary Journal,2012(192):385-389.
[6] Fenaux M,Opriessnig T,Halbur P G,et al.Cloned genomic DNA of type 2porcine circovirus is infectious when injected directly into the liver and lymph nodes of pigs:characterization of clinical disease,virus distribution,and pathologic lesions[J].J Virol,2002,76(2):541-551.
[7] 王 鹏,张熙艳,时建立,等.PCV2Rep蛋白N-糖基化位点突变及其真核表达载体的构建[J].中国兽医杂志,2014,50(1):24-26.
[8] 李 俊,时建立,于 周,等.猪圆环病毒2型双拷贝感染性DNA的构建及体外拯救[J].生物工程学报,2009,25(11):1 633-1 638.
[9] Li J,Shi J I,Wu X Y,et al.Differentiation of PCV1and PCV2 by a multiplex real-time PCR assay[J].Vet Rec,2013,173(14):346.
[10] Opriessnig T,Meng X J,Halbur P G,et al.Porcine circoviruses type 2-associated disease:update on current terminology,clinical manifestations,pathogenesis,diagnosis,and intervention strategies[J].J Vet Diagn Investig,2007,19(6):591-615.
[11] Li W,Wang X,Ma T,et al.Genetic analysis of porcine circovirus type 2(PCV2)strains isolated between 2001and 2009:genotype PCV2bpredominate in postweaning multisystemic wasting syndrome occurrences in eastern China[J].Vi-rus Genes,2010,40(2):244-251.
[12] Gibbs M J,Weiller G F.Evidence that a plant virus switched hosts to infect a vertebrate and then recombined with a vertebrate-infecting virus[J].Proc.Natl.Acad.Sci.U.S.A.1999,96(14):8 022-8 027.
[13] Vigerust D J,Shepherd V L.Virus glycosylation:Role in virulence and immune interactions[J].Trends in Microbiology,2007,15(5):211-218.
[14] Dowling W,Thompson E,Badger C,et al.The influences of glycosylation on the antigenicity,immunogenicity,and protective efficacy of ebola virus GP DNA vaccine[J].Virol,2007,81(4):1 821-1 837.
