硫化镍矿生物浸出研究进展
2015-03-26王金庆梁长利罗仙平
王金庆 严 群 梁长利 罗仙平
1.江西理工大学资源与环境工程学院,江西 赣州341000;2.江西理工大学建筑与测绘工程学院,江西 赣州341000;3.江西理工大学工程研究院,江西 赣州341000;4.西部矿业股份有限公司,青海 西宁810006;5.青海省高原矿物加工工程与综合利用重点实验室,青海 西宁810006)
镍具有良好的机械强度、延展性和化学稳定性,广泛应用于钢材、电镀、电池、化工等领域,已成为现代航天航空、国防等工业不可或缺的金属。随着高品位、易处理镍矿资源的日益开采,低品位难处理镍矿资源特别是复杂硫化镍矿的开发越来越受到重视,然而,传统的硫化镍矿选矿技术已经无法实现该类矿石资源的有效回收[1-3]。因此开发高效、低成本提镍新技术,提高硫化镍矿资源的综合利用水平,对我国工业生产持续稳定健康发展具有重要意义。
生物浸出是指利用微生物自身的特性,将有价金属从矿石(或矿床)中浸溶出来。该方法特别适于处理常规选矿方法难以处理或无经济效益的矿产资源,如贫细杂矿、废矿、表外矿及难采矿,具有工艺简单、操作简便、投资少、成本低、综合利用率高和环境污染小等优势[4]。20 世纪50 年代,铜、铀硫化矿生物浸出得到了工业化应用,进入20 世纪80 年代,生物冶金技术的发展速度更加迅猛,在铜、铀、金等的生物冶金方面取得了大规模工业化应用[5],近年来,微生物浸出的金属种类已拓展到铜、铀、镍、钴、锌、锰、金、银等10 多种有色金属、贵金属和一些稀有金属[6-7]。
硫化镍矿生物浸出研究始于20 世纪70 年代,Razzell 等最早进行了细菌浸出针镍矿(NiS)的试验研究,14 d 的镍浸出率为70%。相对针镍矿而言,镍黄铁矿的浸出速度较快,5 d 的镍浸出率可达87%[8]。后来国内外的科研单位对硫化镍矿的生物浸出技术开展了多方向的研究,如我国部分科研院所及高校对硫化镍矿的生物浸出作用机制及工艺参数等进行了大量研究,2002 年,我国金川公司成功进行了低品位硫化镍矿生物浸出半工业试验,以氧化亚铁硫杆菌为主的混合浸矿菌株浸出金川尾矿,结果显示,镍、铜、钴浸出率分别达87.84%、84.05% 和86.35%[9]。目前,澳大利亚、芬兰、中国等国均拥有硫化镍矿生物浸出工业试点工程[10-11]。
1 硫化镍矿浸出微生物研究
硫化镍矿主要包括镍黄铁矿((Fe,Ni)9S8)、含镍磁黄铁矿((Fe,Ni)7S8)、针镍矿(NiS)、硫镍钴矿((Ni,Co)3S4)及紫硫镍铁矿((Fe,Ni)2S4)等。可用于处理硫化矿石(Cu、Zn、Ni、Co 等)的微生物种类较多,目前已对其进行过研究的有20 余种。这些微生物按生长最佳温度可分为中温菌(Mesophile)、中等嗜热菌(Moderate thermophie)、高温菌(Thermophile),常见的硫化矿浸矿细菌见表1。

表1 硫化矿生物浸出常用菌种Table 1 Common strains for sulfide ore bioleaching
近年来,研究者们针对硫化镍矿的生物浸出,研发了一些新型高性能的浸矿细菌。温建康等[12]发现了一株低温浸矿菌(Thiobacillus ferrooxidans Retech -L-I),并在硫化镍矿的低温堆浸工艺中得到应用,该技术不仅有利于环境保护,还能用来开发传统选冶技术难以回收利用的低品位镍矿资源,特别适用于常温和高温生物堆浸技术难以实现工业化的高寒低温地区硫化镍矿资源的开发,因而进一步扩大了镍矿资源的利用范围,并有效提高了镍的综合利用水平。晏磊等[13]开发了一株嗜铁钩端螺旋菌(Leptospirillum ferriphilum strainYQH1),该菌对Ni2+具有极强的耐受性,能在Ni2+浓度为35 g/L 的环境中正常生长、繁殖,受浸出液中金属离子浓度升高的影响极小,可广泛应用于环境保护以及含镍矿物的生物浸出。
2 硫化镍矿生物浸出作用机制
生物浸出技术经历了几十年的研究发展,研究者已基本了解了微生物浸出过程的反应规律和作用原理。针对硫化镍矿生物浸出过程的机理研究,与大部分硫化矿(如黄铜矿)的生物浸出相似,其浸出过程复杂,一般会同时发生化学氧化、生物氧化及原电池反应,这一过程普遍认为有直接作用、间接作用、两者的复合作用以及电化学作用存在[14-17]。
2.1 微生物直接作用机制
生物浸出的直接作用是指微生物吸附于矿物表面(硫化矿直接作用示意图如图1),以硫化矿为能源物质,通过自身的酶系氧化硫化矿物,将金属硫化物氧化为酸溶性的二价金属离子以及可溶性的硫酸盐类物质,从而获得生命所需的能量,达到直接氧化分解硫化矿物的目的[16]。在FeS2-H2O -O2体系下,细菌将促使黄铁矿(FeS2)发生以下反应:
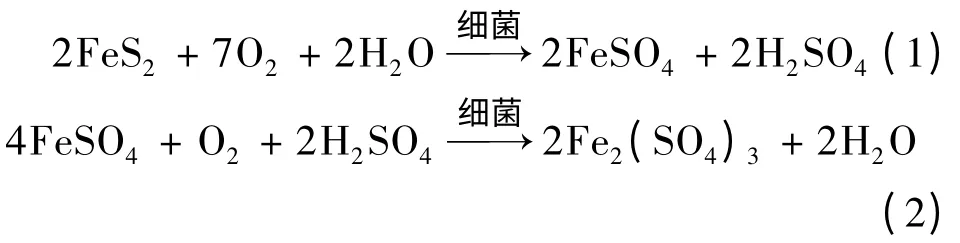
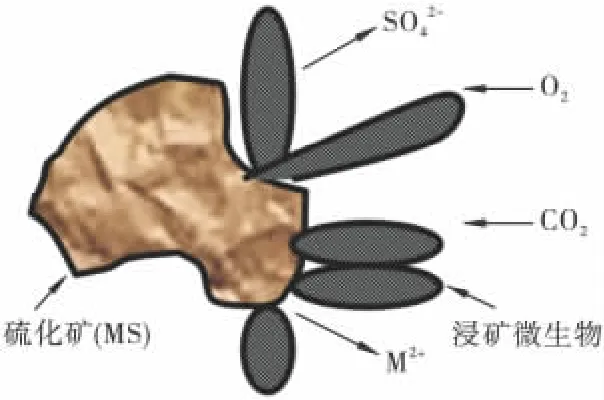
图1 细菌与硫化矿物直接作用示意Fig.1 Sulfide minerals directly affected by bacteria
硫化镍矿生物浸出的研究表明,细菌是直接作用于硫化镍矿物表面的。文献[18]报道了Torma 以无铁的细菌培养基接种细菌,对合成的针镍矿纯矿物进行浸出试验,结果显示镍的浸出速度达555 mg/(L·h)。细菌浸出针镍矿(NiS)的反应有:
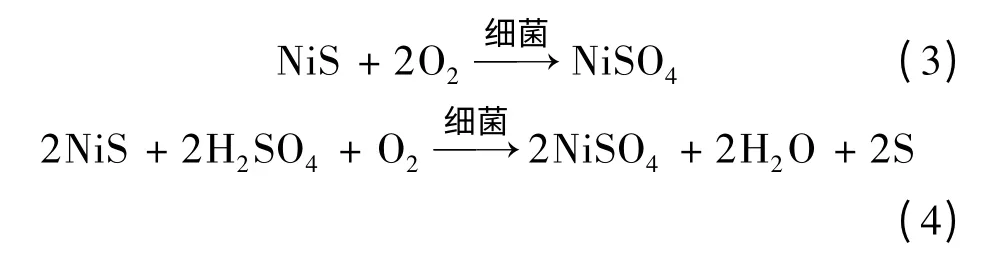
在此类反应过程中,细菌并不参与反应,而是为硫化矿的氧化过程提供催化作用,并且这种催化作用可认为是一种“生物电池反应”所产生的效应[19]。文献[8]报道了关于某硫化矿生物浸出过程的机理研究,其静电位测定显示,细菌在阴极表面存在去极化作用,该作用下细菌可以直接氧化矿物晶格中的硫,因此浸出过程中并未产生单质硫(S0)。细菌的代射产物——氧化型酶(Oxides type enzyme)能够催化矿物表面的阴极反应,从而加快总反应进程,这也证实了该硫化矿生物浸出过程是受细菌直接作用机制控制。
2.2 微生物间接作用机制
生物浸出的间接作用是指依靠细菌的代谢产物——硫酸铁的氧化作用,细菌间接地从硫化矿物的氧化过程中摄取生长所需的能量。此外Fe2(SO4)3可作为一种高效的氧化剂和浸出剂作用于金属硫化矿物,硫化矿在Fe2(SO4)3和H2SO4的作用下发生化学溶解,而反应产物Fe2+受到细菌的作用又会被氧化成Fe3+,得到新的氧化剂,并产生酸性环境,为间接作用的持续进行提供了条件[20]。间接作用的特点是Fe3+和Fe2+在氧化过程中发挥了桥梁作用(硫化矿间接作用示意如图2)。以镍黄铁矿((Fe,Ni)9S8)为例,发生的主要反应有:

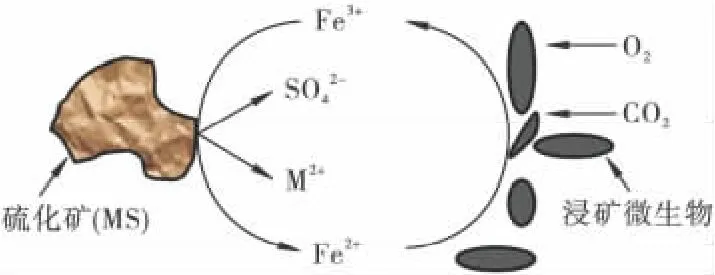
图2 细菌与硫化矿物间接作用示意Fig.2 Sulfide mineral indirectly affected by bacteria
2.3 微生物复合作用机制
微生物浸出的复合作用是指细菌在浸矿的过程中,其既发挥了直接作用,还存在以Fe3+氧化而产生的间接作用。直接作用和间接作用均有可能成为硫化矿生物浸出的主导作用,且2 种作用都不可否定,这是迄今为止多数研究者均认可的微生物浸出硫化矿的机理。事实上,对于硫化镍矿而言,一般都含有一些含铁的类质同象矿物,因此浸出时Fe3+的作用不可忽略。
张广积等[21]研究了镍黄铁矿的生物浸出过程后认为:在镍黄铁矿生物浸出过程中,镍黄铁矿中的硫被矿物表面的吸附菌直接氧化成为单质硫(S0),此时铁以Fe2+的形态存在于溶液中,这是导致镍黄铁矿被溶解的主要原因;浸出过程中吸附菌产生的S0可以被溶液中的游离菌所消耗,因而吸附菌的代谢过程得到进一步加速,与此同时,S0、Fe2+分别被氧化成硫酸和Fe3+的过程中可产生部分酸,进而间接地促进矿物的溶解。因而镍黄铁生物浸出过程中同时存在直接作用与间接作用。
2.4 微生物浸出电化学机理
大多数硫化矿均含有杂质且存在晶格分布不均匀现象,因此硫化矿物多具有导体或半导体的性质,在微生物浸出的过程中,由于“原电池效应”的存在,矿物表面发生一系列的电化学反应;再者,矿物的溶解过程可认为是腐蚀反应的一种,故可以通过相关电化学原理以及电化学测量技术来研究并揭示微生物浸矿的机理[4,22]。
在生物浸出过程中,当2 种硫化矿物互相接触时能够形成伽伐尼电池,在电化学原电池对中,金属矿物越活泼,越易发生腐蚀;反之,金属矿物惰性越强,则越易被阴极保护[23]。对含镍黄铁矿、黄铜矿和磁黄铁矿的混合矿进行生物浸出的研究结果显示:当镍的浸出率为25%时,铜的浸出率仅为2%,即镍黄铁矿相比黄铜矿的静电位低[24-25]。因此,当镍黄铁矿与黄铁矿接触时,镍黄铁矿将优先被选择性溶解,此外,镍-铁硫化矿细菌浸出体系中有如下一系列反应(镍黄铁矿-黄铁矿原电池示意图如图3)。
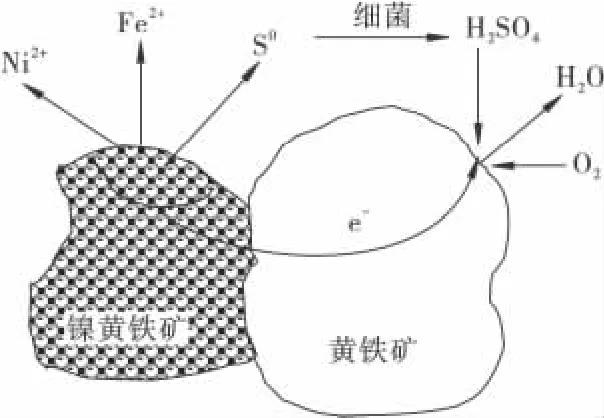
图3 镍黄铁矿-黄铁矿原电池示意Fig.3 Nicopyrite-pyrite galvanic cell
磁黄铁矿的阳极氧化:
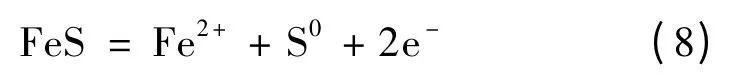
镍黄铁矿的阳极氧化:
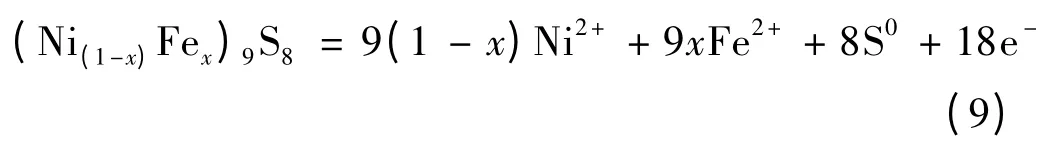
氧的阴极还原:

总的电化学反应为
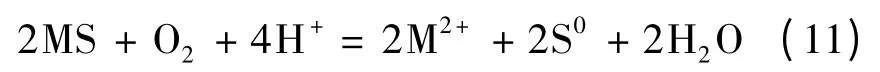
在式(8)、式(9)中,反应器中的阳极会形成单质硫(S0),在细菌(如T. f 和T. t)作用下,Fe2+和单质硫(S0)会被氧化成Fe3+与SO2-4,最后生成硫酸高铁盐。在反应过程中,细菌的作用在于将被浸矿物表面所产生的硫膜移走,暴露出硫化矿的新鲜表面,保证了硫化矿的生物氧化,使得电化学氧化反应能够继续进行[17]。
3 硫化镍矿生物浸出作用机理研究进展
研究矿物的生物浸出机理对寻求有效的强化方法以提高生物浸矿的浸出效率具有重要意义。为此,研究者针对硫化镍矿生物浸出机制及电化学机理进行了相关的试验研究。
方兆珩等[26]为确定细菌在镍黄铁矿生物浸出过程中的作用,以浓度为10 g/L 的Fe2(SO4)3溶液对镍黄铁矿进行浸出试验,并与细菌浸出、稀硫酸浸出试验结果进行对比,其中使用稀硫酸与Fe2(SO4)3浸出时,两者浸出液的初始pH 值相同。结果表明,3 种方式的浸出率由大到小依次为:细菌>Fe2(SO4)3>稀硫酸,由此认为,镍黄铁矿的生物浸出过程由细菌起主导作用。此外,表面吸附菌和浸出液中游离菌的浸出对比试验结果表明,镍黄铁矿表面吸附菌的直接作用强于溶液中游离菌的作用。
Santos 等[27]用中温铁氧化菌对硫化镍矿进行生物浸出研究,获得了镍浸出率为70%的指标。研究结果还表明:在细菌生长过程中,过高浓度的Fe2+会影响细菌对硫化镍矿的生物浸出效率;矿石中的磁黄铁矿表面会生成单质硫(S0),并优先于镍黄铁矿发生溶解,由此认为只有在更高的电位下,镍黄铁矿才可能发生溶解。
邓敬石[28]采用透析技术研究细菌对矿物的直接或间接作用机理。研究结果表明,细菌浸出镍黄铁矿过程中,细菌直接作用占主导,同时还存在稀酸及Fe3+的化学氧化作用,但两者的作用是次要的。细菌浸出体系中氧化还原电位较高,除无铁细胞悬浮溶液浸出初期有少量Fe2+外,浸出过程溶液中均无Fe2+的积累。
鲁敏等[29]采用已驯化的氧化亚铁硫杆菌(Thiobacillus ferrooxidans)进行硫化镍矿的生物浸出研究。结果表明,氧化亚铁硫杆菌能迅速吸附于硫化镍矿表面,并在此基础上于某些特定的位点直接氧化矿物表面形成蚀孔,继而通过孔隙向四周扩展浸蚀,就此认为硫化镍矿生物浸出的关键在于细菌在矿物表面的吸附并对其产生浸蚀作用,因此Fe3+可以显著提高矿物的浸出效率。
Li Hongxu 等[30]利用表面吸附和没有吸附嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans)的镍黄铁矿粉末微电极进行电化学测试研究,表征了镍黄铁矿氧化过程分解机理。循环伏安CV 结果表明:在-0.2 V 的低电位区,当镍、铁离子析出时镍黄铁矿转化为中间相Fe4.5-yNi4.5-xS8-z;当电位在-0.2 ~0.2 V 时,有不稳定的紫硫镍矿Fe3Ni3S4和FeNi2S4形成,并且矿物表面伴有单质硫(S0)的产生;当电位达到0.2 V 以上时,不稳定相会全部分解;在高电位(0.7 V)时,析出的亚铁离子被氧化成高价铁离子。氧化亚铁硫杆菌的存在促使峰电位变高,反应起始电位负移,还对矿物表面产生的单质硫(S0)有氧化去除作用。此外,生物浸出和电化学试验结果都表明:在pH <2 时,降低pH 值会小幅减慢氧化过程的进行。
Mariekie Gericke 等[31]研究了不同工艺条件下镍铜硫化矿精矿的生物浸出过程。结果表明:在矿石的给料浓度较高和磨矿粒度较粗的情况下,通过控制一期反应堆高温厌氧系统的氧化还原电位可提高铜的浸出速率,铜的浸出率高达95%;二期反应堆中高氧化还原电位氛围可实现镍的浸出率大于98%。这些措施和方法可在一定程度上提高镍和铜的浸出率,缩短浸出时间。
李宏煦等[32]应用硫化矿细菌修饰粉末微电极研究了细菌对混合硫化矿的电化学作用影响。结果表明:添加黄铁矿后的混合硫化矿,在阳极方向未能出现明显的FeS2氧化峰,这证明了FeS2和(Ni,Fe)9S8混合时,(Fe,Ni)9S8的氧化溶解加快,而FeS2的氧化过程受到抑制。
4 微生物浸矿过程的影响因素研究进展
生物浸出过程伴随着许多复杂反应的发生,包括细菌生长繁殖、生物化学反应以及浸出剂与矿物的化学反应等。因此,影响微生物浸矿过程的因素较多,主要有培养基组成、矿浆温度、矿浆pH 值、矿浆浓度、表面活性剂等;其次还包括金属离子、紫外线、通气量和催化离子等。近年来,国内外众多学者针对硫化镍矿的生物浸出过程影响因素进行了大量研究。G. Nkulu 等[33]研究了温度、pH 值、浸出时间、搅拌速度和矿浆浓度对含铜、钴和镍多金属硫化矿浮选精矿生物浸出的影响。并应用方差分析来验证每个参数条件对该精矿生物浸出的影响程度,结果显示,对浸出过程影响由大到小的顺序为:矿浆浓度>pH 值>温度。
4.1 培养基
研究表明,在微生物浸出过程中,浸出介质中微生物的浓度越高,金属矿物的浸出速度越快。所以,欲使矿物快速浸出,则需维持微生物繁殖的高速度。这就要求在生产过程中,为细菌生长补充必要的营养物质。Mikhail Vainshtein 等[34]研究发现一种自养型生物——嗜盐盐芽孢杆菌(Halothiobacillus halophilus,简称H.halophilus)中存在甲酸脱氢酶时,会表现出另一种硫杆菌属的特性。这一发现促进了甲酸强化生物浸出的研究,以加拿大某硫化镍矿为浸出底物,中温嗜酸H.halophilus DSM 6132 为浸出剂,进行生物浸出试验。结果表明,添加0.3% 甲酸的H.halophilus 相比无甲酸的H.halophilus 接种矿石时,前者镍的回收率增加了70 倍。
4.2 矿浆温度
在微生物浸矿过程中,矿浆温度不仅制约微生物的生长繁殖过程,同时也影响着微生物的氧化能力。Flávio L.S.Cruz[35]研究了温度对嗜温菌(Acidithiobacillus ferrooxidans)和中度嗜热菌(Sulfobacillus thermosulfidooxidans)浸出硫化镍矿的影响。在34 ℃时,外加Fe2+对金属的溶解无影响,当50 ℃时,添加FeSO4(2.5 g/L)所取得的浸出效果最佳。同时循环伏安法测试表明,与34 ℃时相比,在50 ℃条件下能产生一个更高的电流密度值,从而加快镍的浸出速度。
4.3 矿浆pH 值
矿浆pH 值对微生物的繁殖速率、氧化活性、固体产物的生成均有影响,因此,寻求微生物生长繁殖的最佳pH 值范围至关重要。Cameron Rory A 等[36]将含铜、钴、镍硫化矿碎磨至一定细度,在30 ℃条件下进行了搅拌釜浸出试验,评估了pH 值(2 ~5)对生物浸出的影响。结果表明,当pH 值为2 ~3 时,从镍黄铁矿和磁黄铁矿中浸出镍的效果较好(浸出3 周后,浸出率为49% ~86%)。
4.4 矿浆浓度
在微生物搅拌浸出工艺中,矿浆浓度是影响金属浸出率的一个重要因素。Ali Ahmadi 等[37]通过生物浸出技术回收伊朗科尔曼省Golgohar Iron 硫化矿尾矿中的有价金属,在培养基相同时(Norris、9K),研究了在矿浆浓度分别为5%、10%时,尾矿中铜、镍、钴的浸出率。结果表明:在矿浆浓度为5%的条件下,浸出30 d 后,铜、镍、钴的浸出率分别为55.0%、98.2%、59.5%;当矿浆浓度为10%时,浸出30 d 后,镍、钴的浸出率均不足40%。由此认为:在矿浆浓度为5%时,存在更高的氧化还原诱导电位,该电位下适于镍钴硫化矿的生物浸出。
4.5 表面活性剂
由于表面活性剂能改变矿石的表面疏水性和渗透性,当表面活性剂处于最佳浓度值时,能显著提高微生物的浸矿效率。Sunil Kumar Behera 等[38]加入表面活性剂吐温20,用Aspergillus niger 对预处理过的印度Sukinda 铬铁矿表土在摇瓶中生物浸取镍。考察添加表面活性剂吐温20 对Aspergillus niger 生长及浸镍效果的影响。结果表明,添加低浓度的吐温20对Aspergillus niger 从预处理过的铬铁矿表土中提取镍是有利的,加速了Aspergillus niger 对碳源的消耗,从而改善了镍浸出效果。在预处理矿浆浓度为2%、温度为30 ℃的条件下,添加吐温20 的镍浸取率能达到39%,未添加表面活性剂吐温20 的镍浸取率仅为24%。
5 结论与展望
近年来,硫化镍矿生物浸出技术获得了较快发展,但其浸出周期长、大规模工业化应用等问题还有待解决。今后应在以下几方面加强硫化镍矿的生物浸出技术研发工作:
(1)掌握微生物的化能自养生存方式和能量产生机理,为提高细菌生长繁殖速度等提供理论支持。另外,高性能浸矿菌种的培养、筛选、驯化和细菌快速氧化的研究工作也应受到重视。
(2)硫化镍矿生物浸出的作用机理已较为清楚,但硫化镍矿生物浸出过程中矿物晶体结构变化、微生物代谢过程、浸出动力学等相关研究还需进一步加强。
(3)针对硫化镍矿生物浸出强化技术的研究报道较少,因此,应积极开展该方向的研究,其中生物浸出与超声波强化技术的有机结合有望成为今后研究的重点。
(4)影响硫化镍矿生物浸出效率的因素较多,通用的浸出参数很难获得满意的浸出指标,因此根据矿石特征及具体的浸出环境,研究开发与矿石性质相适应的工艺流程与参数极为重要。
[1] 罗仙平,冯 博,周贺鹏,等. 铜镍硫化矿选矿技术进展[J]. 有色金属:选矿部分,2013(S1):12-14.
Luo Xianping,Feng Bo,Zhou Hepeng,et al. Research progress on mineral processing technology of copper-nickel sulfide ore[J].Nonferrous Metals:Mineral Processing Section,2013(S1):12-14.
[2] 刘 岩,翟玉春,王 虹. 镍生产工艺研究进展[J]. 材料导报,2006(3):79-81.
Liu Yan,Zhai Yuchun,Wang Hong.Research on production process of nickel[J].Materials Review,2006(3):79-81.
[3] Zhen Shijie,Qin Wenqing,Yan Zhongqiang,et al.Bioleaching of low grade nickel sulfide mineral in colun reactor[J]. Transactions of Nonferrous Metals Society of China,2008,18:1480-1484.
[4] 张 琛,郑红艾,周笑绿,等. 生物浸出技术的发展及其电化学研究现状[J].金属矿山,2014(12):122-128.
Zhang Chen,Zheng Hongai,Zhou Xiaolu,et al.Bioleaching development and electrochemical research status[J]. Metal Mine,2014(12):122-128.
[5] Shoemaker R S,Darrah R M.The economics of heap leaching[J].Mining Engineering,1968,20(12):90.
[6] Fislier J R.Bacterial Leaching of Elliot Lake uranium ore[J]. Can Min Met Bull,1966,79:588-592.
[7] 杨显万,沈庆峰,郭玉霞.微生物湿法冶金[M].北京:冶金工业出版社,2003:4-6.
Yang Xianwan,Shen Qingfeng,Guo Yuxia.Microbial Hydrometallurgy[M].Beijing:Metallurgical Industry Press,2003:4-6.
[8] 《浸矿技术》编委会.浸矿技术[M]. 北京:原子能出版社,1994:427.
Leaching Technology Editorial Board. Leaching Technology[M].Beijing:Atomic Energy Press,1994:427.
[9] Cam Eron R A,Lastra R,Mortazav S,et al. Bioleacbing of a lowgrade ultramafic nickel sulphide ore in stirred-tank reactors at elevated pH[J].Hydrometallurgy,2009,97(3/4):213-220.
[10] Riekkola Vanhanen M. Talvivaara black schist bioheapleaching demonstration plant[J].Adv Mater Res,2007(20/21):30-33.
[11] 温建康,阮仁满,孙雪南.金川I 低品位镍矿资源微生物浸出研究[J].矿冶,2002,11(1):55-58.
Wen Jiankang,Ruan Renman,Sun Xuenan. Study on bioleaching low-grade nickel ores in Jinchuan[J]. Mining and Metallurgy,2002,11(1):55-58.
[12] 温建康,刘 学,舒荣波,等.一株低温浸矿菌及其用于硫化镍矿的低温堆浸工艺:中国,CN101434920[P].2009-05-20.
Wen Jiankang,Liu Xue,Shu Rongbo,et al.A psychrotrophic bacterial strain for bioleaching and its use in the heap leaching process at low temperature of nickel sulfide ore:China,CN101434920[P].2009-05-20.
[13] 晏 磊,张 爽,王伟东,等.一株嗜铁钩端螺旋菌及其在硫化镍矿浸出中的用途:中国,CN104130962A[P].2014-11-05.
Yan Lei,Zhang Shuang,Wang Weidong,et al.A strain of Leptospirillum Ferriphilum and its use in the bioleaching of nickel sulfide ore:China,CN104130962A[P].2014-11-05.
[14] 廖梦霞,汪模辉,邓天龙.难处理硫化矿生物湿法冶金研究进展Ⅱ氧化机制、强化细菌浸出与生物反应器设计[J].稀有金属,2004(5):931-935.
Liao Mengxia,Wang Mohui,Deng Tianlong. Biohydrometallurgical progresses on refractory sulfides Ⅱbacterial oxidative mechanism for sulfides[J]. Chinese Journal of Rare Metals,2004(5):931-935.
[15] 彭会清,吴江林,许辅瑶.微生物浸镍研究[J].矿冶,2008(3):55-58.
Peng Huiqing,Wu Jianglin,Xu Fuyao. Bioleaching of nickel research[J].Mining and Metallurgy,2008(3):55-58.
[16] 张才学,周 平.硫化镍矿的细菌浸出机理[J].国外金属矿选矿,2003(7):9-11.
Zhang Caixue,Zhou Ping.Bioleaching mechanism of nickel sulfide ore[J].Metallic Ore Dressing Abroad,2003(7):9-11.
[17] 赵思佳,翁 毅,肖 超. 镍钴硫化矿生物浸出研究进展[J].湖南有色金属,2011(6):10-16.
Zhao Sijia,Weng Yi,Xiao Chao.Review on bioleaching of nickel /cobalt sulfide ore[J].Hunan Nonferrous Metals,2011(6):10-16.
[18] 曾伟民,邱冠周. 黄铜矿生物浸出机制研究进展[J]. 金属矿山,2012(2):94-98.
Zeng Weimin,Qiu Guanzhou.Research progress of chalcopyrite bioleaching mechanism[J].Metal Mine,2012(2):94-98.
[19] Boon M,Heijnen J J. Biohydrometallurgical Technologies[M].Warrendale:Minerals,Metals & Materials Society,1993:217-230.
[20] 李宏煦,王淀佐,陈景河. 细菌浸矿的间接作用分析[J]. 有色金属,2003,55(4):98-100.
Li Hongxu,Wang Dianzuo,Chen Jinghe. Discussion on indirect mechanism of bioleaching[J]. Nonferrous Metals Engineering,2003,55(4):98-100.
[21] 张广积,方兆珩.氧化亚铁硫杆菌浸出镍黄铁矿机理的初步分析[J].过程工程学报,2001(4):374-377.
Zhang Guangji,Fang Zhaoheng.Preliminary analysis on the mechanism of bioleaching of nicopyrite by thiobacillus ferrooxidans[J].The Chinese Journal of Process Engineering,2001(4):374-377.
[22] Mebta A P.Kinetic study of sulfide leaching by galvanic interaction between chalcopyrite,pyrite and sphalerite in the presence of T.ferrooxidans(30 ℃)and thermophilic microorganism(55 ℃)[J].Biotech Bioeng,1982,24(4):919-940.
[23] Rand Larkin K A,王 军.硫化矿生物浸出电化学[J].国外金属矿选矿,1997(2):44-54.
Rand Larkin K A,Wang Jun. Electrochemistry of bioleaching of sulfide ore[J].Metallic Ore Dressing Abroad,1997(2):44-54.
[24] Hayato Sato,Hiroshi Nakazawa,Yasuo Kudo. Effect of silver chloride on the bioleaching of chalcopyrite concentrate[J].International Journal of Mineral Processing,2000,59(1):17-24.
[25] 甄世杰.金川高镁型低品位硫化镍矿生物浸出的应用基础与技术研究[D].长沙:中南大学,2010.
Zhen Shijie.Application Basis and Technology Research on the Bioleaching of Jinchuan Low Grade Nickel-bearing Sulfide Ore Containing High Magnesium[D]. Changsha:Central South University,2010.
[26] 方兆珩,柯家驹,李洪枚,等.生物浸出低品位镍铜硫化矿[J].有色金属:冶炼部分,2002(4):2-8.
Fang Zhaoheng,Ke Jiaju,Li Hongmei,et al. Bioleaching of lowgrade Ni-Cu sulfide ore[J].Nonferrous Metals:Extractive Metallurgy,2002(4):2-8.
[27] Santos,Barbosa,Souza,et al. Bioleaching of a complex nickel-iron concentrate by mesophile bacteria[J].Minerals Engineering,2006,19(22):1251-1258.
[28] 邓敬石.中等嗜热菌强化镍黄铁矿浸出的研究[D].昆明:昆明理工大学,2002.
Deng Jingshi.Study on Strengthen the Leaching of Nickel Pyrite by Moderate Thermophile[D]. Kunming:Kunming University of Science and Technology,2002.
[29] 鲁 敏,关晓辉,赵浩然,等.嗜酸氧化亚铁硫杆菌对低品位硫化镍矿的生物浸出[J].材料导报,2014,28(12):51-54.
Lu Min,Guan Xiaohui,Zhao Haoran,et al. Research on bio-leaching of nickel sulfide ore by thiobacillus ferrooxidans[J].Materials Review,2014,28(12):51-54.
[30] Li Hongxu,Li Chao,Zhang Zhiqian. Decomposition mechanism of pentlandite during electrochemical bio-oxidation process[J].Transactions of Nonferrous Metals Society of China,2012,22(3):731-739.
[31] Mariekie Gericke,Yageshni Govender.Bioleaching strategies for the treatment of nickel-copper sulphide concentrates[J].Minerals Engineering,2011,24(11):1106-1112.
[32] 李宏煦,刘晓荣.黄铁矿和镍黄铁矿混合细菌浸出过程的原电池效应[J].有色金属,2002(4):47-50.
Li Hongxu,Liu Xiaorong. Galvanic affection bio-leaching of pentlandite and pyrite mixture[J].Nonferrous Metals Engineering,2002(4):47-50.
[33] Nkulu G,Gaydardzhiev S,Mwem E.Statistical analysis of bioleaching copper,cobalt and nickel from polymetalic concentrate originating from Kamoya deposit in the Democratic Republic of Congo[J].Minerals Engineering,2013,48:77-85.
[34] Mikhail Vainshtein,Tatiana Abashina,Alexander Bykov,et al.Formate supplementation can increase nickel recovery by Halothiobacillus halophilus[J]. World J Microbiol Biotechnol,2015,31:535-537.
[35] Flávio L S Cruz. High-temperature bioleaching of nickel sulfides:thermodynamic and kinetic implications[J]. Hydrometallurgy,2010,105(1/2):103-109.
[36] Cameron Rory A,Lastra Rolando,Gould W.Douglas.Bioleaching of six nickel sulphide ores with differing mineralogies in stirred-tank reactors at 30 degrees C[J].Minerals Engineering,2013,49:172-183.
[37] Ali Ahmadi,Maryam Khezri,Ali Akbar Abdollahzadeh.Bioleaching of copper,nickel and cobalt from the low grade sulfidie tailing of Golgohar Iron Mine,Iran[J].Hydrometallurgy,2015,154:1-8.
[38] Sunil Kumar Behera,Lala Behari Sukla. Microbial extraction of nickel from chromate overburdens in the presence of surfactant[J]. Transactions of Nonferrous Metals Society of China,2012,22:2840-2845.
