膨润土对废水中Ni2 + 的吸附特性研究
2015-03-26曹晓强陈亚男吕宪俊
曹晓强 陈亚男 张 燕 邱 俊 李 琳 吕宪俊
( 山东科技大学化学与环境工程学院,山东 青岛266590)
电镀、仪表、电子等行业生产过程中会排放大量的含重金属离子废水,重金属离子具有不可生物降解、有毒、能在生物体内富集等特点[1],会对环境及生物产生不利影响。去除废水中重金属离子的方法主要有化学沉淀法、离子交换法、吸附法、膜分离法、电渗析法等[2-3]。吸附法因具有效率高、操作简单、吸附剂来源广泛等特点而成为处理含重金属离子废水的常用方法。这种方法本身的缺点是传统吸附剂(如活性炭)成本较高且再生困难,故而开发更加经济并同样高效的替代产品成为未来研究的重点。在大量潜在的替代品中,以膨润土为代表的天然黏土材料逐渐得到了重视。膨润土是一种以蒙脱石为主要矿物的黏土,具有较高的比表面积[4-6],因而具有较高的表面能,吸附能力强,此外,膨润土还具有良好的吸水膨胀性、悬浮性以及较高的阳离子交换容量等[7],因此大量研究人员采用膨润土作为吸附剂,以Cd2+、Cu2+、Zn2+、Pb2+等重金属离子为目标污染物开展吸附研究[8-9]。
本研究采用山东莱阳膨润土,选择Ni2+为目标污染物,考察膨润土对Ni2+吸附能力的影响,在丰富相关理论的同时为膨润土作为吸附材料的工业化应用打下基础。
1 试验材料与仪器
1.1 试验材料
试验所用的天然膨润土由山东莱阳鑫达矿业有限公司提供,属于钙基膨润土。试验试剂有硝酸镍、硝酸、柠檬酸铵、乙二胺四乙酸二钠、碘、氨水、丁二酮肟、硫酸、氢氧化钠,均为分析纯。
1.2 试验仪器
WFJ7200 型可见分光光度计((尤尼柯)上海仪器设备有限公司),PHS -3C 型数字式酸度计(江苏江分电分析仪器有限公司),精密电子天平(赛多利斯科学仪器(北京)有限公司),SHA -B 型水浴恒温振荡器(江苏金坛国胜实验仪器厂),TD5A -WS 型台式低速离心机(金坛市恒丰仪器制造有限公司)。
2 试验方法
将一定量的Ni(NO3)2·6H2O 溶解在蒸馏水中,制备不同初始浓度的含Ni2+废水。取一定体积的含Ni2+废水加入到150 mL 锥形瓶中,然后称取一定质量的膨润土投加到锥形瓶中,于恒温水浴振荡器中以一定的振荡速度进行吸附,吸附温度设定为20 ℃。吸附结束后将混合溶液置于离心机中以4 000 r/min离心分离10 min,取上清液。利用丁二酮肟光度法测定上清液中残余的Ni2+浓度,计算膨润土对Ni2+的吸附率。
3 试验结果与讨论
3.1 溶液Ni2+初始浓度对膨润土吸附Ni2+的影响
根据电镀废水中常见的Ni2+浓度范围,取Ni2+的初始浓度分别为50、100、200 mg/L,在固液比为12.5 g/L、振荡速度为100 r/min、自然pH(pH=7.5)条件下进行试验,结果如图1 所示。
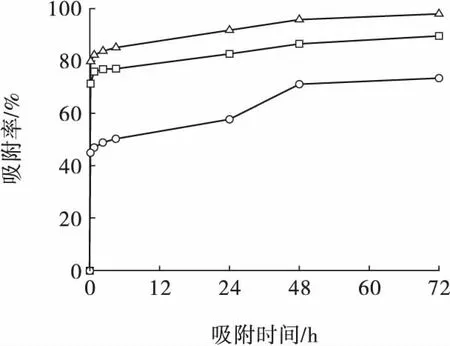
图1 溶液Ni2+初始浓度对膨润土吸附Ni2+的影响Fig.1 Effect of initial Ni2+ concentration on the adsorption of Ni2+ by bentonite
由图1 可知:随着溶液Ni2+初始浓度的增加,膨润土对Ni2+的吸附率逐渐降低;膨润土对Ni2+的吸附非常快,在10 min 左右就能够达到很高的吸附率,此后,随着吸附时间的延长吸附率缓慢上升;当吸附时间达到72 h,Ni2+初始浓度为50、100、200 mg/L 时对应的吸附率分别为97.8%、89.4%和73.3%。随着溶液中Ni2+初始浓度的提高,吸附过程中的传质动力增大,需要更多的吸附剂来捕获吸附质,但吸附量增加的幅度不及溶液Ni2+浓度上升的幅度[10],因此随着溶液Ni2+初始浓度的增加,膨润土对Ni2+的吸附率逐渐降低。综合考虑,取Ni2+初始浓度为100 mg/L。
3.2 固液比对膨润土吸附Ni2+的影响
在振荡速度为100 r/min,Ni2+初始浓度为100 mg/L,自然pH,固液比分别为8.33、12.5、20、25、50、75 g/L 条件下进行试验,结果如图2 所示。

图2 固液比对膨润土吸附Ni2+的影响Fig.2 Effect of ratio of solid to liquid on the adsorption of Ni2+ by bentonite
由图2 可知:随着固液比的增加,膨润土对Ni2+的吸附率逐渐提高;固液比为50 g/L 和75 g/L 时对应的吸附率均已达到90%以上,说明提高固液比有利于膨润土对Ni2+的吸附。随着固液比的增加,膨润土颗粒表面可用的吸附位点增加,吸附剂用量较低时,几乎所有颗粒的表面结合位点都用来吸附Ni2+,从而有较高的吸附率;但吸附剂用量较多时,颗粒表面大部分结合能较高的位点被结合能较低的位点占据,降低了单位吸附剂的利用率[11];此外,吸附剂用量较多时,溶液中吸附剂膨润土颗粒之间容易发生碰撞,导致颗粒间发生聚合,从而使颗粒表观粒径变大,比表面积减小,这都使得膨润土对Ni2+的吸附量降低[10]。在实际处理中,吸附剂的过量使用不但会导致其利用率的下降,还使会增加后续处理的难度。综合考虑,取固液比为12.5 g/L。
3.3 振荡速度对膨润土吸附Ni2+的影响
为考察不同流态对膨润土吸附溶液中Ni2+的影响,在固液比为12.5 g/L,Ni2+初始浓度为100 mg/L,自然pH,振荡速度分别为0(静止)、50、100、200 r/min 条件下进行试验,结果如图3 所示。
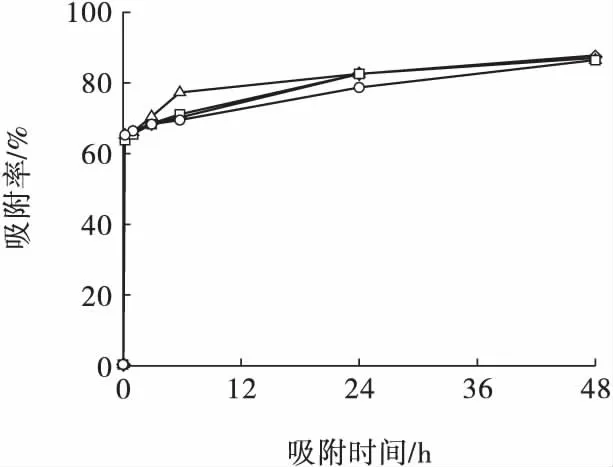
图3 振荡速度对膨润土吸附Ni2+的影响Fig.3 Effect of oscillation speed on the adsorption of Ni2+ by bentonite
由图3 可知,不同振荡速度条件下,膨润土对Ni2+吸附率略有差距,但不明显,特别是吸附24 h后,其吸附效果趋于一致。因此,振荡速度对于膨润土吸附效果影响不大,可以忽略。膨润土吸附剂本身呈粉末状,在溶液中以胶体形态存在,具有较好的分散性,因此能够与Ni2+充分接触;另外,膨润土对重金属离子的吸附过程主要是以离子交换、表面络合作用为主[12],这两种作用的作用力是在分子以及离子层面,相比而言,振荡仅属于一般外力,因而对吸附过程的影响有限。因此,膨润土作为吸附剂用于实际生产时,不需要单独为其吸附过程提供搅拌,仅依靠废水本身流动产生的动力即可达到比较好的吸附效果,从而节约处理费用。
3.4 pH 值对膨润土吸附Ni2+的影响
溶液pH 值不仅会影响重金属离子在溶液中的存在形态[13-14],还会影响膨润土颗粒的表面电位和表面电荷密度,进而影响膨润土对重金属离子的吸附[15-16]。因此,pH 值对吸附率的影响是多重的,相对其他因素而言更加复杂。固定固液比为12.5 g/L、无振荡、Ni2+初始浓度为100 mg/L,考察不同溶液pH值对膨润土吸附Ni2+的影响,结果如图4 所示。

图4 溶液pH 值对膨润土吸附Ni2+的影响Fig.4 Effect of pH on the adsorption of Ni2+ by bentonite
由图4 可以看出:膨润土对Ni2+的吸附率受pH影响很大。随着pH 值的增加,Ni2+的去除率呈增加趋势,但不同pH 值下表现出的吸附行为不同。pH对膨润土吸附Ni2+的影响可以分为3 种情况:①当溶液呈酸性时,膨润土对Ni2+的吸附率非常低,而且随时间的延长提高幅度很小,甚至还出现了随吸附时间延长吸附率下降的情况(pH =2 时);②pH =7.5时,膨润土对Ni2+的吸附率增加幅度较大,吸附稳定时,膨润土对Ni2+的吸附率可达95%以上;③当溶液呈碱性(pH 值为9、11)时,膨润土对Ni2+的吸附率基本稳定在99%以上。
为考察pH 对膨润土吸附Ni2+的作用机理,固定固液比为12.5 g/L、无振荡、Ni2+初始浓度为100 mg/L,考察不同pH 条件下膨润土对Ni2+的饱和吸附量,结果如图5 所示。

图5 pH 对Ni2+饱和吸附量的影响Fig.5 Equilibrium adsorbed amount of Ni2+ under different pH
由图5 可以看出,随着pH 值的升高,膨润土对Ni2+的饱和吸附量逐渐提高,并在pH >8 以后趋于稳定。导致该现象的原因可能有:①pH 值会影响膨润土表面用于吸附重金属离子的吸附位数量,当pH<7 时,质子化作用释放一定量H+,与金属离子产生竞争吸附,争夺吸附剂表面有限的吸附位点,吸附率降低;当pH >7 时,膨润土中的铝羟基和硅羟基发生水解,可以额外提供部分吸附位,吸附率提高[17]。②pH 值会影响膨润土本身的电荷分布,低pH 值时膨润土表面电荷以永久电荷为主,随着pH 值的升高,膨润土表面电荷则以可变电荷为主;在吸附重金属离子的过程中,永久电荷位主要发生离子交换作用,可变电荷位主要发生配合作用[18]。pH <7.5 时,Ni2+在溶液中主要以Ni2+和NiOH+形式存在[19],膨润土会与这两者发生离子交换反应,但是由于大量H+的存在,抑制了该反应的进行,甚至大量的H+还会将初期被膨润土吸附的部分Ni2+和NiOH+从膨润土中交换出来,导致吸附率降低;pH >7.5 后,Ni2+在溶液中形成Ni(OH)2沉淀,吸附率提高;pH >10.2 后,溶液中会形成Ni(OH)3-,同时膨润土表面解离出OH-使其带正电,因此能够与Ni(OH)3-发生静电吸附从而有利于Ni2+的净化[13,14,20]。
综上,pH >8 条件下,Ni2+的水解作用对提高其净化效率有重要影响。为了验证水解机制对Ni2+去除的影响,试验中不加膨润土,仅利用0.1 mol/L 的NaOH 溶液将含Ni2+溶液调整至预设pH 值后以4 000 r/min 直接离心分离10 min,试验结果如图6所示。

图6 水解机制对Ni2+去除的影响Fig.6 Effect of hydrolysis mechanism on the adsorption of Ni2+
由图6 可以看出,即使不加膨润土,当溶液pH >9 时,通过水解也可以有效去除溶液中的Ni2+,Ni2+去除率接近100%,而且在试验过程可以观察到离心管底部有绿色固体沉淀出现。这进一步说明了水解作用是高pH 条件下Ni2+的去除机制之一。
4 结 论
(1)膨润土对Ni2+的吸附非常快,在10 min 左右就能够达到很高的效率,随着Ni2+初始浓度的增加,膨润土对Ni2+吸附率降低;提高固液比有利于膨润土对Ni2+的吸附,膨润土对Ni2+的吸附率随固液比的增加而提高,但增加固液比降低了单位吸附剂的利用率,还增加了后续处理的难度;振荡速度对于膨润土吸附效果影响不大,基本可以忽略;随着pH 值的增加,膨润土Ni2+的去除率呈增加趋势。在Ni2+初始浓度为12.5 g/L,固液比为12.5 g/L,无振荡,自然pH 时,膨润土对Ni2+去除率可达95%以上。
(2)pH 对膨润土吸附Ni2+的影响很大,不同pH下Ni2+的去除机制不同,当溶液pH <7 时,H+会与Ni2+发生竞争吸附从而降低吸附效果,pH 值的增加有利于Ni2+的去除,但pH >7.5 后Ni2+的水解成为主要去除机制,另外不同pH 下Ni2+的不同存在形态也对吸附率产生了影响。
[1] Ayhan Demirbas.Heavy metal adsorption onto agro-based waste materials:a review[J].Journal of Hazardous Materials,2008,157:220-229.
[2] Bhattacharya A K,Mandal S N,Das S K. Adsorption of Zn (Ⅱ)from aqueous solution by using different adsorbents[J]. Chemical Engineering Journal ,2006,123:43-51.
[3] Lin S H,Juang R S.Heavy metal removal from water by sorption using surfactant-modified montmorillonite[J]. Journal of Hazardous Materials,2002,92:315-326.
[4] Ramesh A,Hasegawa H,Maki T,et al. Adsorption of inorganic and organic arsenic from aqueous solutions by polymeric Al/Fe modified montmorillonite[J]. Separation and Purification Technology,2007,56(1):90-100.
[5] Inglezakis V J,Stylianou M,Loizidou M. Ion exchange and adsorption equilibrium studies on clinoptilolite,bentonite and vermiculite[J].Journal of Physics and Chemistry of Solids,2010,71(3):279-284.
[6] Vieira M G A,Almeida Neto A F,Gimenes M L,et al. Sorption kinetics and equilibrium for the removal of nickel ions from aqueous phase on calcined Bofe bentonite clay[J].Journal of Hazardous Materials,2010,177(1/2/3):362-371.
[7] 朱利中,陈宝梁.有机膨润土及其在污染控制中的应用[M]. 北京:科学出版社,2006.
Zhu Lizhong,Chen Baoliang. Organic Bentonite and Its Application in Pollution Control[M].Beijing:Science Press,2006.
[8] Kaya A,Oren A H.Adsorption of zinc from aqueous solutions to bentonite[J].Journal of Hazardous Materials ,2005,125:183-189.
[9] Lazarevi S C,Jankovi I,Jovanovi D,et al.Adsorption of Pb2+,Cd2+and Sr2+ions onto natural and acid activated sepiolites[J].Applied Clay Science,2007,73:47-57.
[10] Zhang Hui,Chen Lei,Zhang Dechao,et al.Impact of environmental conditions on the adsorption behavior of radionuclide63Ni(Ⅱ)on γ-Al2O3[J]. Colloids and Surfaces:Physicochemical and Engineering Aspects ,2011,380:16-24.
[11] Huang J H,Liu Y F,Wang X G. Selective sorption of tannin from flavonoids by organically modified attapulgite clay[J]. Journal of Hazardous Materials,2008,160:382-387.
[12] Kubilay S,Gurkan R,Savran A,et al. Removal of Cu(Ⅱ),Zn(Ⅱ)and Co(Ⅱ)ions from aqueous solutions by adsorption onto natural bentonite[J].Adsorption,2007,13:41-51.
[13] Yang Shitong,Zhao Donglin,Zhang Hui,et al. Impact of environmental conditions on the sorption behavior of Pb(Ⅱ)in Na-bentonite suspensions[J]. Journal of Hazardous Materials,2010,183(1/2/3):632-640.
[14] Weng Chihuang,Sharma Y C,Chu Suehua.Adsorption of Cr(VI)from aqueous solutions by spent activated clay[J].Journal of Hazardous Materials,2008,155:65-75.
[15] Mockovciakováa A,Orolinova Z,Skvarla Jir. Enhancement of the bentonite sorption properties[J]. Journal of Hazardous Materials,2010,180:274-281.
[16] Sheng Guodong,Wang Suowei,Hu Jun,et al. Adsorption of Pb(Ⅱ)on diatomite as affected via aqueous solution chemistry and temperature[J].Colloids and Surfaces,2009,339:159-166.
[17] Wu X L,Zhao Donglin,Yang S T.Impact of solution chemistry conditions on the sorption behavior of Cu(Ⅱ)on Lin'an montmorillonite[J].Desalination,2011,269(1/3):84-91.
[18] Akafia Martin M,Reich Thomas J,Koretsky Carla M.Assessing Cd,Co,Cu,Ni,and Pb sorption on montmorillonite using surface complexation models[J].Applied Geochemistry,2011,26(S):154-157.
[19] Pablo Liberto,Chávez M.Lourdes,Abatal Mohamed. Adsorption of heavy metals in acid to alkaline environments by montmorillonite next term and Ca-previous term montmorillonite next term[J].Chemical Engineering Journal,2011,171 (3):1276-1286.
[20] Zhang Hanbing,Tong Zhangfa,Wei Tengyou,et al. Removal characteristics of Zn(Ⅱ)from aqueous solution by alkaline Ca-bentonite[J].Desalination,2011,276(1/2/3):103-108.
