紫外分光光度法和蒽酮-硫酸法测定参芎葡萄糖注射液中总糖含量**
2015-03-26朱迪谭丹侯靖宇向文英王爱民兰燕宇郑林
朱迪,谭丹,侯靖宇,向文英,王爱民,3,兰燕宇,3,郑林,3**
(1.贵阳医学院贵州省药物制剂重点实验室,贵州贵阳550004;2.贵阳医学院民族药与中药开发应用教育部工程研究中心,贵州贵阳
550004;3.贵阳医学院药学院,贵州贵阳550004)
“参芎葡萄糖注射液”为上市的中药注射剂品种,由丹参和盐酸川芎嗪配伍组成,具有抗血小板聚集,扩张冠状动脉作用,临床用于闭塞性脑血管病及其它缺血性血管疾病的治疗[1-3]。参芎葡萄糖注射液现行质量标准仅对丹参素和盐酸川芎嗪进行定量控制,难以全面控制产品内在质量。为进一步完善参芎葡萄糖注射液质量控制方法,达到《中药、天然药物注射剂基本技术要求》所规定的“多成份制成的注射剂,所测成份应大于总固体量的80%”要求,本研究建立了参芎葡萄糖注射液总糖的含量测定方法,为产品的质量控制与综合评价提供科学的参考依据。
1 材料与方法
1.1 仪器与试药
紫外可见分光光度计(日本岛津公司,UV 2401),超声波清洗器(250 W,频率27~34 kHz;北京医疗设备二厂),AE240十万分之一电子天平(梅特勒-托利多仪器上海有限公司),超纯水机(四川沃特尔科技发展有限公司),TAISITE水浴锅,移液枪(1 000μL,Eppendorf)。D-无水葡萄糖(批号111506,中国食品药品检定研究院),蒽酮(30015014,国药集团化学试剂有限公司),浓硫酸[20131201,重庆川东化工(集团)有限公司]。8个不同批次的参芎葡萄糖注射液(批号为:20131125-1,20131125-2,20130979-1,20130979-2,20131104-1,20131104-2,20131211-1,20131211-2)均由贵州景峰注射剂有限公司提供。
1.2 总糖含量测定方法
1.2.1 溶液的制备对照品溶液的制备:精密量取D-无水葡萄糖20 mg,置100 mL容量瓶中,加水至刻度,摇匀,得对照品溶液。供试品溶液制备:取注射液1 mL,加水定容至50 mL,摇匀后,再取1 mL加水定容至50 mL,得供试品溶液A,取供试品溶液A 2 mL,加入8 mL蒽酮试剂,摇匀后,沸水浴加热10 min,放至室温后,冰浴冷却5 min后,室温放至10 min。空白溶液制备:取纯化水2 mL于离心管中,加入8 mL蒽酮试剂,摇匀后,沸水浴加热10 min,放至室温后,冰浴冷却5 min后,室温放至10 min。蒽酮试剂的制备:取0.2 g蒽酮,加浓硫酸至100 mL,即配即用。
1.2.2 检测波长以水为参比,分别于紫外可见分光光度计上对标准系列溶液和供试品溶液进行全扫描,对照品溶液最大吸收波长为620 nm,供试品溶液最大吸收波长为625 nm,二者紫外光谱和最大吸收波长基本一致,故确定参芎葡萄糖注射液中总糖含量的测定波长为620 nm。对照品和供试品紫外光谱,见图1,空白紫外光谱,见图2。
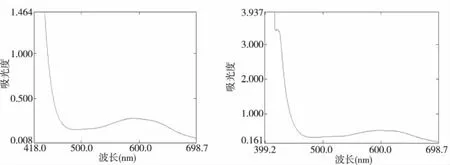
图1 对照品和供试品紫外光谱图Fig.1 UV spectrogram of standards and samples

图2 空白紫外光谱图Fig.2 UV spectrogram of blank
1.3 方法学考察
1.3.1 线性关系用移液枪量取取对照品溶液0.40、0.60、0.80、1.00、1.50至10 mL离心管中,再用移液枪加水至2 mL,摇匀后,加入8 mL蒽酮试剂,摇匀后,沸水浴加热10 min,放至室温后,冰浴冷却5 min后,室温放至10 min,即得对照品工作液。分别取对照品工作液,以水为参比溶液,在620 nm波长处测定吸光度,以浓度C为横坐标,吸光度A为纵坐标,绘制标准曲线,计算回归方程为A=35.500 C-0.041 80,r=0.999 3,结果表明葡萄糖对照品浓度在0.008~0.03 g/L范围内与溶液的吸光度之间呈良好的线性关系。
1.3.2 精密度试验取同一浓度的对照品工作液(0.025 g/L),按上述建立的紫外分光光度法连续测定6次吸光度值,结果6次测定值的RSD为0.79%,说明仪器精密度良好。
1.3.3 重复性试验取同一批号参芎葡萄糖注射液(批号为:20131125-1)6份,按“1.2.1”项下方法制备供试品溶液,分别测定吸光度值并计算含量,结果6次测定值的RSD为2.7%,说明此方法的重复性良好。
1.3.4 稳定性试验精密称取重复性试验项下参芎葡萄糖注射液,按“1.2.1”项下方法制备供试品溶液,按上述建立的紫外分光光度法,分别于0,1,2,4,6,8,24 h测定吸光度值,结果供试品溶液中总糖含量的RSD为2.5%,表明供试品溶液在24 h内稳定性良好。
1.3.5 回收率试验精密称取重复性试验项下参芎葡萄糖注射液9份,每份0.5 mL,分别精密加入葡糖糖对照品溶液适量,按“1.2.1”项下方法制备供试品溶液,按上述建立的紫外分光光度法测定吸光度值并计算总糖的含量,结果表明:9份供试品加样回收率结果在98.17%~108.13%之间,RSD为2.9%,说明此方法具有良好的回收率,见表1。
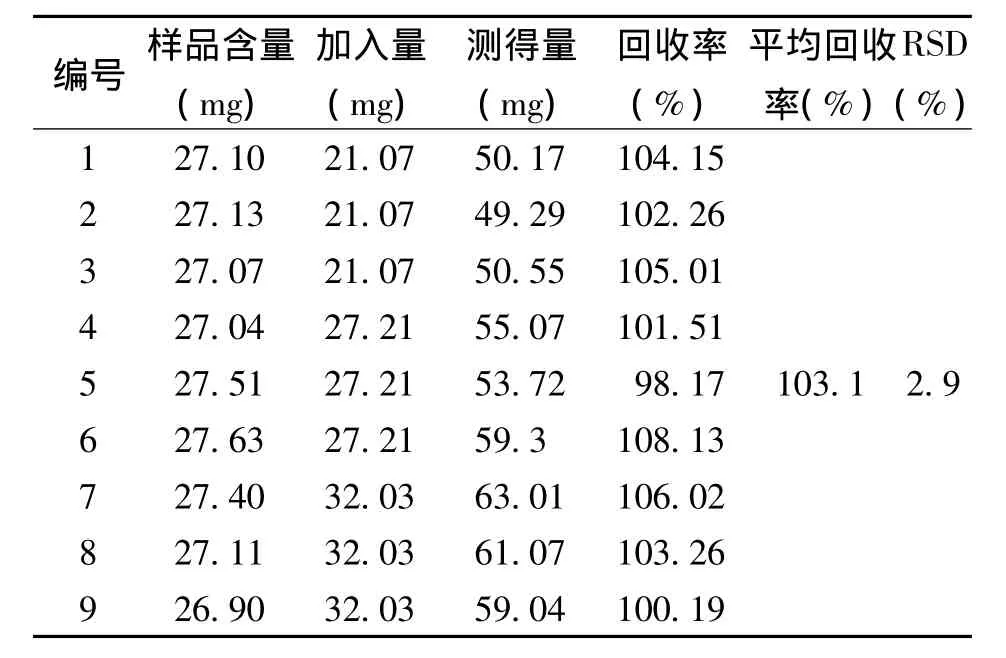
表1 回收率试验结果Tab.1 Test results of recovery
1.4 样品测定
8批参芎葡萄糖注射液,按“1.2.1”项下方法制备供试品溶液,按上述建立的紫外分光光度法测定吸光度值,分别计算供试品溶液中总糖含量,结果见表2。
2 讨论
目前测定总糖的方法有苯酚-硫酸法和蒽酮-硫酸法,苯酚-硫酸法中苯酚需要进行蒸馏后才能使用,污染较大,稳定性差,线性关系不好且重现性差[4-14]。因此本研究采用蒽酮-硫酸法对参芎葡萄糖注射液进行总糖含量测定,研究结果表明线性关系理想,重现性、稳定性均良好,结果准确可靠,且简便可行。
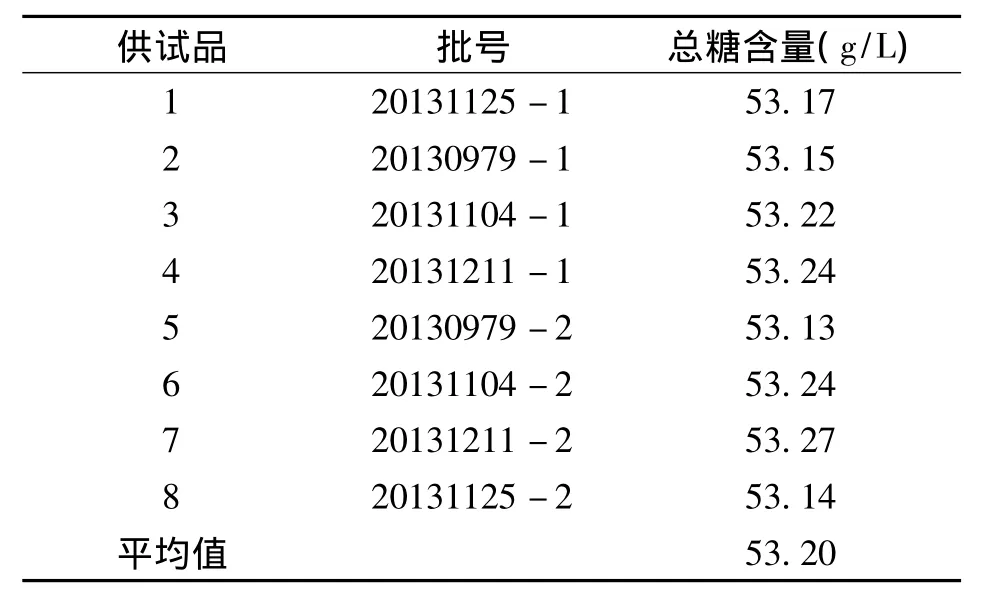
表2 8批参芎葡萄糖注射液中总糖含量测定结果Tab.2 Determination results of total sugar in 8 battle of Shenxiong glucose injection
为更好的反映参芎葡萄糖注射液的内在质量,本研究对参芎葡萄糖注射液中主总糖进行了测定,探讨和建立科学、可靠、简便的总糖定量测定方法。建立的紫外可见光分光光度法,经方法学考察,该方法可以较为简便、快速、准确地测定参芎葡萄糖注射液中总糖的含量,可为参芎葡萄糖注射液的质量评价提供检测标准。
[1]王珊珊,刘艳红.参芎葡萄糖注射液活血化瘀及耐缺氧将效应研究[J].现代中西医志,2014(4):358-362.
[2]陈兴坚,刘建红.参芎葡萄糖注射液的临床应用进展[J].中国实用医药,2010(13):247-249.
[3]李达文,龚惠,叶勇,等.参芎葡萄糖注射液对缺血再灌注损伤心肌的保护作用[J].中国分子心脏病学杂志,2012(1):51-56.
[4]郑林,庞秀清,兰燕宇,等.UFLC法同时测定参芎葡萄糖注射液中6种主要成分[J].中成药,2012(7):1276-1279.
[5]郑林,庞秀清,黄勇,等.参芎葡萄糖注射液的UFLC指纹图谱研究[J].中国医药工业杂志,2013(6):611-614.
[6]张钰,覃容贵,安东琴,等.紫外可见分光光度法测定深裂竹根七多糖的含量[J].贵阳医学院学报,2014(3):371.
[7]王欢,卢红梅,张义明,等.固态发酵食醋中还原糖、总糖含量测定[J].中国酿造,2011(9):172-175.
[8]翁霞,辛光,李云霞.蒽酮比色法测定马铃薯淀粉总糖的条件研究[J].食品研究与开发,2013(17):86-88.
[9]郭雷,吕明生,王淑军等.苯酚-硫酸法测定樱桃酒中总糖[J].食品研究与开发,2010(6):130-132.
[10]陈焕娜,刘洋,赵晓霞,等.分光光度法测定丹参总酚含量方法的研究[J].亚太传统医药,2010(8):19-22.
[11]陈农,丁宁,彭国平,等.两种方法测定丹参滴注液糖类含量[J].医药导报,2013(5):672-674.
[12]阮鸣.冠心宁注射液中大类成分的含量测定[J].南京晓庄学院学报,2013(3):71-75.
[13]李萌,刘新国,吴金虎,等.前愈复方中多糖成分的提取工艺优选[J].中国医院药学杂志,2011(24):2018-2021.
[14]孙淑玲,刘坤,杨新涛.关于食品中总糖测定中几个问题的探讨[J].中国卫生检验杂志,2013(13):2852-2853.
