电动势法测量Na2PbO2和Na2ZnO2生成自由能
2015-03-26王志猛谢宏伟翟玉春
王志猛,谢宏伟,张 懿,翟玉春,3
(1.东北大学 材料与冶金学院,沈阳 110819;2.中国科学院 过程工程研究所 湿法冶金清洁生产技术国家工程实验室,北京 100190;3.东北大学秦皇岛分校 资源与材料学院,秦皇岛 066004)
铅、锌是重要的有色金属,我国是世界第一的铅锌生产和消费大国[1]。然而,由于多年开采,矿石品位不断下降。现有铅的冶炼几乎都是火法冶炼,湿法炼铅还处于试验阶段。火法炼铅过程中,伴生的铜分散进入铅冰铜和粗铅,从铅冰铜中回收铜和铅仍是一个尚未解决的难题,伴生的锌主要进入炉渣,采用高污染的烟化法回收,造成资源和能源浪费以及环境污染[2-6]。锌冶炼以湿法为主,但该法存在对锌品位低、多金属复杂矿难于处理、工艺流程较长等问题。现有的铅锌冶炼工艺,对于一些多金属复杂矿,如低品位铅锌矿、铋钼矿、金锑矿等,处理和分离相关金属均很困难,金属回收率低、能耗高、三废排放量大、环境污染严重[7-9]。基于我国现有含铅锌资源现状和冶炼工艺存在缺陷的事实,开发高效、清洁冶金新工艺已成为重要的发展方向。
低温碱性熔炼以其低温节能、高效、高选择性展示出良好的应用前景。与传统火法冶金相比,低温碱性熔炼一般在低于1173 K条件下进行,不产生熔融渣[10]。该技术是前苏联科学家首先提出的,当时用于处理原生铅[11]。近年来,我国冶金工作者将低温碱性熔炼技术向前推进,应用于原生矿产资源冶炼和二次资源处理。在低温碱性熔炼过程中,多金属复杂物料中两性金属转化为金属单质和可溶性金属钠盐,钠盐可实现再生利用[12-15]。但对该工艺相关体系的热力学性质欠缺了解,影响对实际冶炼过程的理解和改进。因此,获得相关金属氧化物钠盐热力学性质对深入分析和了解碱性熔炼过程具有重要的意义。
本文作者以PbO、ZnO和NaOH为原料,通过固相合成法合成Na2PbO2和Na2ZnO2。采用自制的β(β″)-Al2O3固体电解质管构建电池,通过测量构建的电池反应电动势,计算Na2PbO2和Na2ZnO2生成自由能[16-18],为铅锌资源的低温碱性熔炼研究提供数据基础和理论依据,同时,也为其他金属钠盐的热力学数据的获取提供可行的技术方法。
1 实验
1.1 原料和仪器
实验所用原料有:氢氧化钠(AR)、一氧化铅(AR)、氧化锌(AR)、三氧化二铬(AR)、亚铬酸钠(AR)、偏铝酸钠(CR)、高纯氧化铝(99.999%(质量分数))、高纯氩气(99.999%(质量分数))。
实验所用仪器为硅碳管电阻炉、ZWK-1600型可编程序温度控制仪、AUTOLAB型电化学工作站和QM-3SP04型行星球磨机。
1.2 实验过程
采用β(β″)-Al2O3固体电解质管组装钠浓差电池为待测电池,测定钠盐生成自由能。待测电池电动势测量前,必须检测电池测量系统,利用ZrO2-Y2O3固体电解质管组装氧浓差电池作为系统标定电池。将待测电池和系统标定电池同时置于硅碳管炉中1273 K恒温10 h后,在1273~700 K范围内降温交替测量两个电池不同温度下的电动势值,每个温度点恒温2 h,至电动势波动值小于0.1 mV时,记录稳定的电动势值。
实验过程在氩气气氛下进行,高纯氩气经过硅胶、分子筛干燥剂和P2O5干燥除水,并分别经过装满铜屑和镁屑的电阻炉充分脱氧得到干燥纯净的氩气。
1.3 电池的设计和组装
1.3.1 系统标定电池的设计和组装
利用ZrO2-Y2O3固体电解质管组装氧浓差电池为系统标定电池:

关于系统标定电池有较多报导[19],电池装置如图1所示。

图1 电池装置示意图Fig.1 Schematic diagram of battery device:1—Platinum electrode;2—Corundum tube;3—Corundum slice;4—Spring;5—Corundum tube;6—ZrO2-Y2O3electrolyte tube;7—Fe+FexO;8—NiO+Ni
1.3.2 测定Na2PbO2生成自由能的电池设计和组装
1.3.2.1 Na2PbO2的制备
以PbO和NaOH为原料制备Na2PbO2。按照PbO与NaOH的摩尔比为1:2的比例球磨混合均匀,置于程序控温的硅碳棒电阻炉中,在氩气气氛下进行恒温固相反应,化学反应方程式为

反应温度分别为1023 K、1073 K、1123 K[20],恒温6 h后降至室温,快速转移至真空手套箱中,研细待用。
1.3.2.2 电池设计和组装
测定Na2PbO2生成自由能的电池为

相应的半电池反应分别为
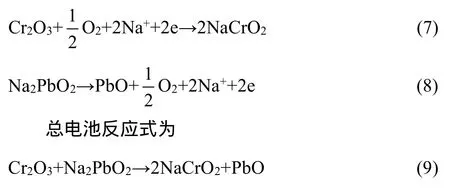
在真空手套箱中将Na2PbO2和PbO混合物磨细,压实于β(β″)-Al2O3电解质管中,连接好铂丝电极,用高温水泥密封,经473 K烘干3 h后再经873 K烘干5 h。参比电极材料应该有可靠的自由能数据,选择NaCrO2+Cr2O3为参比电极材料,将NaCrO2、Cr2O3按照摩尔比1:1球磨混合均匀压实于刚玉管内,电池装置图与系统标定电池类似,电池组装在真空手套箱中进行。
1.3.3 测定Na2ZnO2生成自由能的电池设计和组装
1.3.3.1 Na2ZnO2的制备
制备Na2ZnO2的化学反应方程式为

反应温度分别为923 K、973 K、1023 K,固相反应4 h。
1.3.3.2 电池设计和组装
测量Na2ZnO2生成自由能的电池为

电池制备过程与测量Na2PbO2生成自由能的电池制备过程相同。
1.3.4 测定NaAlO2生成自由能的电池设计和组装
通过相同的方法测量NaAlO2生成自由能,将得到的自由能数据与已有的纯物质热化学手册中数据进行比较,验证电动势法测量Na2PbO2和Na2ZnO2的可靠性。
测量NaAlO2生成自由能的电池为

2 结果与分析
2.1 合成的Na2PbO2和Na2ZnO2的检测
2.1.1 合成的Na2PbO2的检测
合成的Na2PbO2的XRD谱如图2所示。检测条件为Cu靶Kα,加速电压30 kV,电流300 mA,扫描速度7(°)/min。从图2中可以看出,主要物相为Na2PbO2和PbO,同时检测到了较弱的H2O衍射峰,可能是制样和检测过程中样品吸水所致;烧结温度对Na2PbO2的合成影响较小,电池的测量温度为773~1273 K,因此,选择1123 K合成的Na2PbO2为电池材料。

图2 不同温度合成的Na2PbO2的XRD谱Fig.2 XRD patterns of Na2PbO2synthesized at different temperatures:(a)1023 K;(b)1073 K;(c)1123 K
2.1.2 合成的Na2ZnO2的检测
合成的Na2ZnO2的XRD谱如图3所示。从图3中可以看出,合成产物的主要物相为Na2ZnO2和ZnO,当温度为1023 K时,合成的Na2ZnO2的衍射峰变弱,并且产物挥发较多,因此,选择973 K合成的产物作为电池材料。

图3 不同温度合成的Na2ZnO2的XRD谱Fig.3 XRD patterns of Na2ZnO2synthesized at different temperatures:(a)923 K;(b)973 K;(c)1023 K
2.2 系统标定电池测量结果
在700~1273 K范围内,测量得到电池电动势与温度的关系如图4所示。给出的拟合曲线方程为
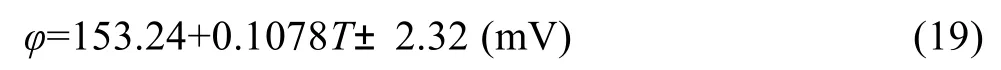
线性相关系数为0.998,与文献[18-19]结果一致,可用作检验实验系统及设备的校验。

图4 系统标定电池电动势与温度关系Fig.4 Relationship between battery electromotive force and temperature for calibrating measurement system
2.3 Na2PbO2生成自由能测定结果
在700~1273 K范围内,Na2PbO2生成自由能测定的电动势值与温度的关系如图5所示,数据拟合处理可得
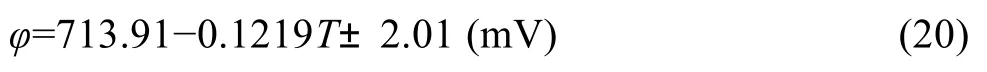
线性相关系数为0.993。

图5 Na2PbO2电池电动势与温度的关系Fig.5 Relationship between electromotive force of Na2PbO2 battery system and temperature
电动势法所测得的电动势数据计算电池反应的自由能变化,根据 GΘΔ =-nφF 得
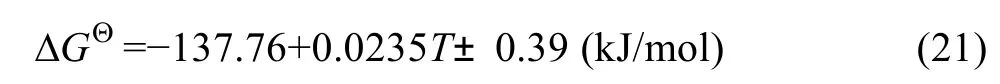
式(19)中的各物质均以独立相存在,因此,该反应的自由能变化写为

Cr2O3、NaCrO2和PbO的标准生成自由能分别为=-1138.30+0.2691T(kJ/mol)、=-856.10+0.1693T±2.5(kJ/mol)[21]和=-216.99+0.0958T(kJ/mol)[22],将以及式(21)代入式(22),得到Na2PbO2的生成自由能与温度关系曲线为

2.4 Na2ZnO2生成自由能的测定结果
在700~1273 K范围内,Na2ZnO2生成自由能测定的电动势值与温度的拟合曲线如图6所示,数据拟合处理可得

线性相关系数为0.991。
电动势法所测得的电动势数据计算电池反应的自由能变化,根据 GΘΔ =-nφF 得

式(14)中的各物质均以独立相存在,因此该反应的自由能变化写为


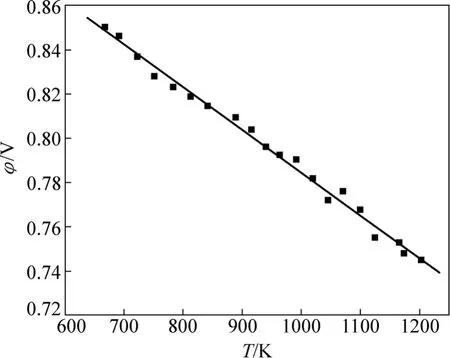
图6 Na2ZnO2电池电动势与温度的关系Fig.6 Relationship between electromotive force of Na2ZnO2 battery system and temperature
2.5 NaAlO2生成自由能的测量结果
在700~1273 K范围内,NaAlO2生成自由能测定的电动势值与温度的拟合曲线如图7所示,数据拟合处理可得
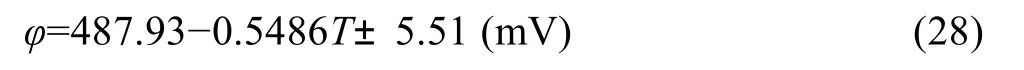
线性相关系数为0.995。
电动势法所测得的电动势数据计算电池反应的自由能变化,根据 GΘΔ =-nφF 得

式(18)中的各物质均以独立相存在,因此该反应的自由能变化写为

Al2O3的标准生成自由能为=-1675.71+0.3140T(kJ/mol)[22],将的标准生成自由能以及式(29)代入式(30),得到NaAlO2的生成自由能与温度的关系为
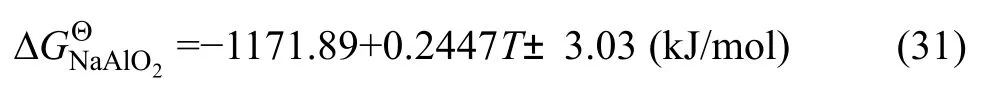
将测量得到的NaAlO2的生成自由能数据与纯物质热化学数据手册中查到的数据进行比较(见表1)。

图7 NaAlO2电池电动势与温度关系Fig.7 Relationship between electromotive force of NaAlO2 battery system and temperature

表1 NaAlO2生成自由能数据对比表Table 1 Comparison of formation free energy of NaAlO2
由表1可知,在实验测量的温度范围内,电动势法测量NaAlO2的生成自由能数据与纯物质热化学数据手册中数据相对偏差不到2%,说明电动势法测量NaAlO2生成自由能是可靠的,而同样方法得到的Na2PbO2和Na2ZnO2生成自由能数据是可靠的。
3 结论
1)以PbO和NaOH为原料,在1123 K固相反应合成 Na2PbO2,构建固体电解质电池 Pt∣PbO,Na2PbO2‖β(β″)-Al2O3‖NaCrO2,Cr2O3∣Pt,在 700~1273 K范围内测量电池反应电动势,计算得到Na2PbO2生成自由能与温度的关系为=-653.13+0.1418T±5.39(kJ/mol)。
2)以ZnO和NaOH为原料,在973 K固相反应合成 Na2ZnO2,构建固体电解质电池 Pt∣ZnO,Na2ZnO2‖β(β″)-Al2O3‖NaCrO2,Cr2O3∣Pt,在 700~1273 K范围内,测量电池反应电动势,计算得到Na2ZnO2生成自由能与温度的关系为=-734.86+0.1309T±5.77(kJ/mol)。
3)采用相同方法测量得到NaAlO2的生成自由能与 温 度 关 系 为=-1171.89+0.2447T±3.03(kJ/mol),与纯物质热化学数据手册比较相对偏差不到2%。说明本实验得到的Na2PbO2和Na2ZnO2生成自由能数据是可靠的,可以为低温碱性熔炼过程提供理论支持。
[1] 李若贵.我国铅锌冶炼工艺现状及发展[J].中国有色冶金,2010,39(6):13-20.LI Ruo-gui.Status and development of lead and zinc smelting process in China[J].China Nonferrous Metallurgy,2010,39(6):13-20.
[2] 覃文庆,郑永兴,刘 维,孔 燕,韩俊伟,罗虹霖,刘三军.鼓风炉水淬铅冶渣的矿物特征[J].中国有色金属学报,2014,24(1):262-268.QIN Wen-qing,ZHENG Yong-xing,LIU Wei,KONG Yan,HAN Jun-wei, LUO Hong-lin, LIU San-jun. Mineralogical characterization of blast furnace slag quenched by water[J].The Chinese Journal of Nonferrous Metals,2014,24(1):262-268.
[3] 梁彦杰.铅锌冶炼渣硫化处理新方法研究[D].长沙:中南大学,2012:2-4.LIANG Yan-jie.Stuay on novel sulfidation technologies in managing Zn&Pb smelting waste[D].Changsha:Central South University,2012:2-4.
[4] DAMSGAARD E F.Exhaustible resources,technology choice and industrialization of developing countries[J].Resource and Energy Economics,2012,34(3):271-294.
[5] KHIN Z,STEPHEN G P,PAUL C,CLIVE B,HOU Zeng-qian.Nature,diversity of deposit types and metallogenic relations of South China[J].Ore Geology Reviews,2007,31(1/4):43-47.
[6] 杨洪英,李雪娇,佟琳琳,陈国宝.高铅铜阳极泥的工艺矿物学[J].中国有色金属学报,2014,24(1):269-278.YANG Hong-ying,LIUXue-jiao,TONGLin-lin,CHEN Guo-bao.Process mineralogy of high lead copper anode slime[J].The Chinese Journal of Nonferrous Metals,2014,24(1):269-278.
[7] 刘凯凯,周广柱,周 静.铅锌冶炼渣性质及综合利用研究进展[J].山东化工,2013,42(7):58-64.LIU Kai-kai,ZHOU Guang-zhu,ZHOU Jing.Lead and zinc smelting slag properties and the progress of its comprehensive utilization[J].Shandong Chemical Industry,2013,42(7):58-64.
[8] 蒋继穆.我国铅锌冶炼现状与持续发展[J].中国有色金属学报,2004,14(1):52-62.JIANG Ji-mu.Status and sustainable development of lead and zinc smelting industry in China[J].The Chinese Journal of Nonferrous Metals,2004,14(1):52-62.
[9] LI Qian,ZHENG Bao,MIN Xiao-bo,SHEN Wen-qian.Acid leaching kinetics of zinc plant purification residue[J].Transactions of Nonferrous Metals Society of China,2013,23:2786-2791.
[10] 郭学益,刘静欣,田庆华,李 栋.有色金属复杂资源低温碱性熔炼的原理与方法[J].有色金属科学与工程,2013,4(2):8-13.GUO Xue-yi,LIU Jing-xin,TIAN Qing-hua,LI Dong.Principle and method of low temperature alkaline smelting in non-ferrous metallurgy complicated resources[J].Nonferrous Metals Science and Engineering,2013,4(2):8-13.
[11] AYu Shustrov,Yu A Matsenko.Low temperature process of lead extraction in accumulator battery scrap separation[J].Non-ferrous Metals,1999,8:22-25.(In Russian)
[12]刘静欣,郭学益,刘 旸.废弃电路板多金属粉末碱性熔炼产物分形浸出动力学[J].中国有色金属学报,2015,25(2):545-552.LIU Jing-xin,GUO Xue-yi,LIU Yang.Fractal leaching kinetics of alkaline smelting product with metal enrichment from waste printed circuit boards[J].The Chinese Journal of Nonferrous Metals,2015,25(2):545-552.
[13]YANGJian-guang,HEDe-wen,TANG Chao-bo,CHEN Yong-ming,SUN Ya-hui,TANG Mo-tang.Thermodynamics calculation and experimental study on separation of bismuth from a bismuth glance concentrate through a low-temperature molten salt smelting process[J].Metallurgical and Materials Transactions B,2011,42(4):730-737.
[14]YANG Jian-guang,TANG Chao-bo,CHEN Yong-ming,HE Jing,TANG Mo-tang.Separation of antimony from astibnite concentrate throug a low-temperature smelting process to eliminate SO2emission[J]. Metallurgical and Materials Transactions B.2011,42(1):30-36.
[15]SHA Liang,GUO Xue-yi,TIAN Qing-hua.Adsorption of Pb2+and Zn2+from aqueous solutions by sulfured orange peel[J].Sci Verse Science Direct Journals,2011,275(1):212-216.
[16] 谢培培,李淑妮,翟全国,蒋育澄,胡满成.电动势法测定混合电解质CsBr+NaBr+H2O体系的活度系数[J].陕西师范大学学报(自然科学版),2013,41(2):49-53.XIE Pei-pei,LI Shu-ni,ZHAI Quan-guo,JIANG Yu-cheng,HU Man-cheng.Electromoriyeforcemeasurementsofactivity coeffcients for the ternary system(CsBr+NaBr+H2O)[J].Journal of Shanxi Normal University(Natural Science Edition),2013,41(2):49-53.
[17] 兰 天,张 虎,罗方祥.电动势法研究HAN与Fe+氧化还原反应动力学[J].核化学与放射化学,2012,34(5):257-261.LAN Tian,ZHANG Hu,LUO Fang-xiang.Reaction kinetic between hydroxylamine nitrate and Fe3+by measuring potential of Fe3+/Fe2+[J].Journal of Nuclear and Radiochemistry,2012,34(5):257-261.
[18]ZHENG Min-hui,CHEN Yi-song.Free energy of formamon of Na2SnO3by EMF measurement usingβ-alumina solid electrolyte cell[J].Acta metallurgica sinica,1992,5(4):320-322.
[19]SJÖDEN O,SEETHARAMAN S,STAFFANSSON L I.On the gibbs energy of formation of wustite[J]. Metallurgical Transactions,1986,17B:179-184.
[20]ERNEST M L,CARL R R,HOWARD F M.Phase diagrams for ceramists 1969 supplement[M].Columbus,Ohio:The American Ceramic Society,1969:2283.
[21]BARIN I,KNACKE O.Thermochemical properties of inorganic substances[M].Berlin:Springer-Verlag,1973:237,439.
[22] 程乃良,牛四通,徐桂英.纯物质热化学数据手册[M].北京:科学出版社,2003:48,1294,1836.CHENG Nai-liang,NIU Si-tong,XU Gui-ying.Thermochemical data of pure substances[M].Beijing:Science Press,2003:48,1294,1836.
