RNAi介导ObR基因沉默对人乳头状甲状腺癌K1细胞增殖与侵袭能力的影响*
2015-03-25张国安
王 帅 孔 霞 张国安 侯 森 崔 文△
(1济南大学山东省医学科学院医学与生命科学学院,山东 济南250062,2山东省医学科学院,济南250022;
3济宁医学院附属济宁市第一人民医院,山东 济宁272011;
4济宁医学院基础学院;5济宁医学院法医学与医学检验学院,济宁272067)
甲状腺癌是目前增长最快的内分泌恶性肿瘤,发生率显著升高。乳头状甲状腺癌占80%~85%,在甲状腺癌中最为常见[1]。有研究显示肥胖人群中甲状腺癌有更高的发病率[2],是恶性肿瘤发生的危险因素之一。瘦素是由肥胖基因(ob)编码的蛋白类激素。对于食物摄取与能量平衡、新陈代谢、神经内分泌也有调节作用[3]。瘦素受体(ObR)是一种跨膜蛋白,属于Ⅰ类细胞因子超家族[4],与Leptin瘦素有很高的亲和力。本文探讨敲除ObR基因后对人乳头状甲状腺癌细胞(K1细胞)增殖和侵袭能力的影响。
1 材料和方法
1.1 材料
K1细胞系购于欧洲细胞库。DMEM培养基购自Fisher公司;胎牛血清(FCS)购自杭州四季青公司;ObR基因沉默序列购于上海吉玛制药技术有限公司;LipofectamineTM2000Reagent购于Invitrogen公司;OPTI-MEM 购于 Gibco公司;TRIZOL购于Ambion公司;FastQuant RT Kit(with gDNase)试剂盒购于北京天根生化科技有限公司;SuperReal PreMix Plus(SYBR Green)试剂盒购于北京天根生化科技有限公司;鼠抗人β-Actin多克隆抗体、羊抗鼠-LgG(H+L)/HRP、羊抗人多克隆抗体、驴抗羊-LgG(H+L)/HRP均购于Santa cruz公司。引物由上海生工设计,ObR上 游:5′-ACCTCTGGTTCCCCAAAAAGG-3′,下 游: 5′-TTGGCAAGGCACAAGACAT-3′;GAPDH 上 游: 5′-GGAGCGAGATCCCTCCAAAAT-3′,下 游:5′-GGCTGTTGTCATACTTCTCATGG-3′。
siRNA-ObR由上海吉玛基因设计:上游:5′-GUGCAGUGUUCAGAGAUAUTT-3′,下游:5′-AUAUCCCUGAACACUGCACTT-3′;阴性对照上 游:5′-UUCUCCGAACGUGUCACGUTT-3′,下游:5′-AUGUGACACGUUCGGAGAATT-3′。
1.2 方法
1.2.1 K1细胞培养与分组 在37℃5%CO2培养箱内,将K1细胞置于含10%FBS的DMEM培养液中培养,取对数生长期的K1细胞用于实验。实验分为K1-CON组(空白对照组即未转染siRNA-ObR的细胞)、K1-NC组(阴性对照组即转染OPTI-NC-siRNA 的 细 胞 )和 K1-ObR 组 (转 染OPTI-ObR-siRNA的细胞)。
1.2.2 siRNA构建 实验前一天使用无双抗含血清培养基铺6孔板,细胞密度为6×105/孔。18h,细胞融合度达60%时开始转染。取1.5ml EP管,每管各加入 OPTI-MEM 50μL,分别加入siRNA-ObR各5μL,室温静置5min,制成 A液。另 取 1.5ml EP 管,每 管 各 加 入 OPTI-MEM 50μL,加入 Lipofectamine 2 000 2μL,室温静置5min,制成B液;将B液加入到A液中,轻柔混合,室温静置20min。将A,B混合液加入到每个已经含有OPTI-MEM的6孔板中,前后左右轻轻混匀;培养箱中箱孵育8h后,将转染液换为无双抗含血清培养基。
1.2.3 Real-time PCR检测 1)RNA提取 转染后细胞培养48h,弃去培养基,加入1ml trizol,裂解5min后,轻轻吹打移入1.5ml EP中。加入0.2ml氯仿,剧烈震荡EP管15s,室温孵育3min。4℃12 000g离心15min,将上层吸出至一1.5ml EP管中,加入0.5ml异丙醇,室温孵育10min。4℃12 000g离心4min,吸掉上层液体,加入1ml配置好的75%乙醇。4℃7500g离心5min,吸掉上层液体。加入1ml配置好的75%乙醇,4℃7500g离心5min,吸掉上层液体,空气干燥5min。加 入 适 量 RNAsae-free,轻 轻 混 匀,55℃ 水 浴10min。nano-drop测量模板RNA的浓度和纯度;2)逆转录 冰上解冻,每种溶液漩涡震荡混匀,简短离心收集,所有步骤操作完成快速置于冰上。建立gDNA去除反应体系,置于42℃,孵育3min;建立反转录反应体系,42℃,孵育15min,95℃,孵育3min之后放于冰上,得到cDNA。3)根据试剂盒说明书建立和进行Real-time PCR反应体系。
1.2.4 Western blotting检测 1)总蛋白提取转染后24h提取蛋白,常规消化离心细胞,1.5ml EP管收集;弃去上清,加入1ml预冷的PBS,吹打均匀;1000rpm,离心5min;弃去上清,加入适量RIPA与PMSF(比例为100∶1),轻轻吹打;漩涡震荡30min;4℃,12000rpm,离心30min,吸出上清;测定蛋白浓度,计算出上样体积。2)SDSPAGE电泳 配制10%分离胶,灌胶、水封后,室温凝固40min;配制5%的浓缩胶10ml,插入梳子,室温凝固30min;凝固后将胶板放入电泳槽内,拔掉梳子,电泳槽中加入配制好的电泳液,孔中加入预染蛋白Ladder与已经变性好的蛋白样品;电流最大,恒定电压,电泳4h;PVDF膜、海绵、玻璃棒、吸水纸等浸泡在转膜液中;撬开玻璃板,用转膜液冲洗胶,根据蛋白分子量Mark所示留下样品蛋白对应的条带;放好海绵、滤纸、PVDF膜、胶准备转膜;恒流转膜300A,2h;5%的脱脂奶粉室温封闭1h;一抗4℃孵育过夜;二抗室温孵育1h;ECL试剂盒两种液体等体积混合后对目的蛋白显色,使用ChemiDocMP成像分析仪曝光。
1.2.5 MTT检测 取对数生长期的K1细胞,常规消化,1000rpm,离心5min;弃去上清,加入适量培养基,制成细胞悬液;细胞计数,铺96孔板,细胞密度为5×103/100μL;18h后SiRNA瞬时转染,每组做3个平行复孔;分别在适当时间加入25μL MTT溶液,培养箱中孵育2h加入Lysis Buffer 100μL;过夜后,放于酶标仪上测570nm波长处的OD值。
1.2.6 Transwe ll实验 用30μL 1∶3稀释的Matrigel胶铺于Transwe ll小室上层,2h后加100 μL DMEM培养基水化,上室加入转染好的K1细胞2×105个,下室加入500μL含10%FBS的培养基,每组设3个复孔。放置培养箱中培养72h。72h后取出小室,PBS清洗3遍,棉签轻轻擦去上室内细胞,无水甲醇固定30min,0.5%的结晶紫染色30min,PBS清洗3次,自然风干,每个浓度组正置显微镜下取5个视野拍照。以上实验重复3次,取平均值。
1.3 统计学方法
采用SPSS17.0统计软件进行统计学分析。
2 结果
2.1 RNAi介导ObR基因沉默后K1细胞ObR mRNA的表达
K1细胞转染48h后,提取RNA,做Real-time PCR,检测沉默ObR基因后K1细胞mRNA表达量分 别 是 (0.00218±0.000486)、(0.00357±0.000937)、(0.00426±0.000426),如下图所示与阴性对照组和空白对照组相比siRNA-ObR沉默组的表达量下降了一半。经SPSS统计学分析后F=7.797、P=0.021,具有统计学意义(见图1)。说明siRNA-ObR在mRNA水平上能显著抑制K1细胞的基因表达。
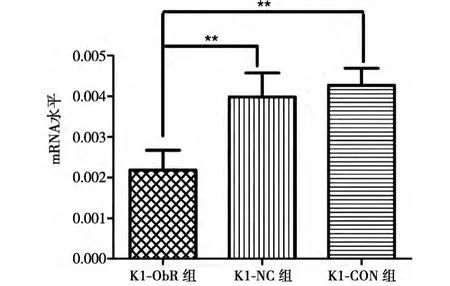
图1 沉默ObR基因后K1细胞的mRNA水平的表达量
2.2 RNAi介导ObR基因沉默后K1细胞ObR蛋白的表达
K1细胞转染24h后,提取蛋白做 Western blotting,检测沉默ObR基因后蛋白水平上表达量。以β-actin作为内参,如下图显示ObR基因沉默组比空白对照组与阴性对照组蛋白水平上的表达量下降,相对表达水平分别是(0.455±0.013)、(0.412±0.014)、(0.226±0.0106),经统计学分析F=287.098、P=0.000,具有统计学意义(见图2)。

图2 沉默ObR基因后蛋白水平上K1细胞的表达量
2.3 RNAi介导ObR基因沉默对K1细胞增殖的影响
分别在转染24h和48h后,在酶标仪上测吸光度值。24h吸光度值分别是(0.061 8±0.003 5)、(0.057 7±0.004 3)、(0.063 0±0.003 7),(F=3.243,P=0.068);48h吸光度值分别是(0.082 2±0.007 3)、(0.076 5±0.005 6)、(0.081 8±0.00 7)(F=2.366,P=0.128)经SPSS分析得出吸光度值没有统计学意义(P>0.05)(见图3)。沉默ObR基因对K1细胞增殖并没有影响,实验结果得出瘦素及其受体不影响K1细胞的增殖。

图3 沉默ObR基因后对K1细胞活性的影响
2.4 RNAi介导ObR基因沉默对K1细胞侵袭能力的影响
Transwell实验可以检测细胞的侵袭能力,K1细胞转染后铺在上室培养72h后,正置显微镜下拍照选取5个视野计算穿出细胞个数。结果分析数据为(47.00±2.000)、(85.67±0.577)、(92.00±1.00),可见ObR沉默后穿出的细胞个数减少(见图4)。说明靶基因沉默后K1细胞侵袭能力减弱。经统计学分析F=1001.313、P=0.000,具有统计学意义。
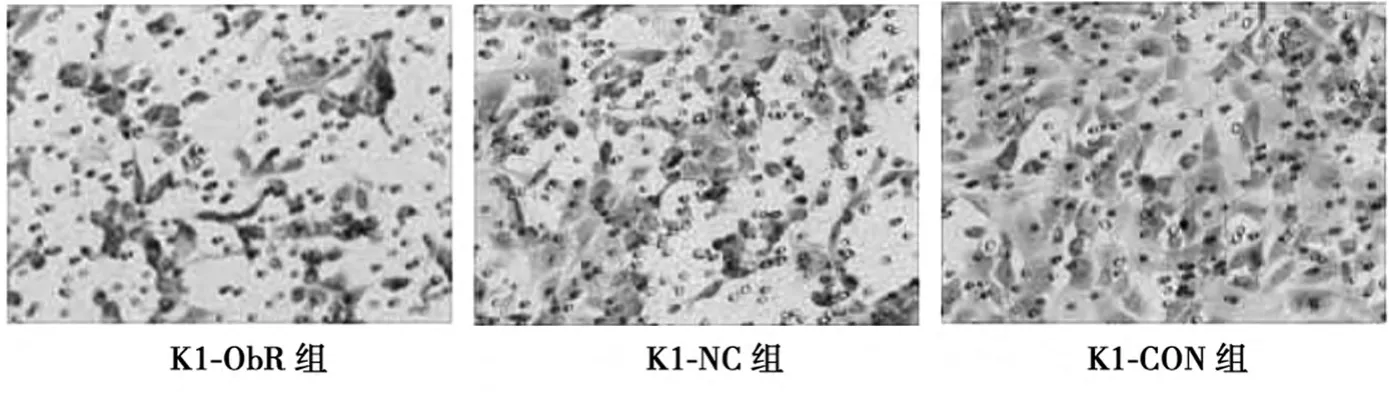
图4 沉默ObR基因后对K1细胞侵袭的影响
3 讨论
瘦素是一种脂肪因子,在许多恶性肿瘤的发生和发展中起了重要的作用,包括胃癌、乳腺癌、子宫内膜癌和结肠癌等。虽然瘦素在体内的致癌作用并非特别显著,但在大多数癌中起到促进癌细胞增殖的作用[5-10],抑制癌细胞的凋亡。Uddin[11]等研究了瘦素在甲状腺癌中PI3K/AKT的信号机制,显示瘦素通过PI3K/AKT通路的激活来刺激细胞增殖、抑制细胞凋亡。RNA干扰(RNA interference,RNAi)是正常生物体内抑制特定基因表达的一种现象,是在进化过程中高度保守的、由双链RNA(double-stranded RNA,dsRNA)诱发的、同源mRNA高效特异性降解的现象。RNAi技术可以抑制相关癌基因的表达。RNA沉默是在转录水平、逆转录水平和翻译水平上来阻断基因表达,并且可以特异的剔除或关闭特定基因的表达。siRNA通过抑制靶向基因的沉默,阻断下游RNA诱导沉默复合体的生物活性来增强抑制肿瘤的作用。
本实验使用RNAi介导ObR基因沉默分析对K1细胞增殖与侵袭能力的影响。沉默ObR基因后观察对K1细胞增殖的影响,结果显示瘦素对K1细胞的增殖并没有影响。这或许是瘦素及其受体仅仅在患癌的起始阶段起了一定的作用,对与癌细胞生长并没有作用;也或许与瘦素抵抗(瘦素无法发挥应有的效应)有一定的关系,原因还需要通过进一步实验来证明。侵袭性是恶性肿瘤不同于其他疾病的显著特点,若在恶性肿瘤发展的过程中用某些方式阻断这一生物学行为,便可以很好地遏制疾病。本文通过Transwell实验探讨KNAi介导ObR基因沉默对K1细胞侵袭能力的影响。沉默ObR基因后K1细胞的侵袭能力显著下降。siRAN-ObR可以有效沉默K1细胞中ObR基因的表达,降低K1细胞的侵袭能力,因此,si-RAN-ObR可以成为甲状腺癌基因靶向治疗的分子。
[1] Podnos Y D,Smith D D,Wagman L D,et al.Survival in patients with papillary thyroid cancer is not affected by the use of radioactive isotope[J].J Surg Oncol,2007,96(1):3-7.
[2] Han J M,Kim T Y,Jeon M J,et al.Obesity is a risk factor for thyroid cancer in a large,ultrasonographically screened population[J].Eur J Endocrinol,2013,168(6):879-86.
[3] Rehem R A,Elwafa W A,Elwafa R A,et al.Study of Serum Leptin in Well-differentiated Thyroid Carcinoma:Correlation with Patient and Tumor Characteristics[J].World J Surg,2014.
[4] Garofalo C,Surmacz E.Leptin and cancer[J].J Cell Physiol,2006,207(1):12-22.
[5] 聂明,崔文.瘦素与卵巢癌研究进展[J].济宁医学院学报,2012,35(3):212-214.
[6] Vona-Davis L,Rose D P.Adipokines as endocrine,paracrine,and autocrine factors in breast cancer risk and progression[J].Endocr Relat Cancer,2007,14(2):189-206.
[7] 侯森,崔文.瘦素脂联素及其受体甲状腺癌关系的研究进展[J].济宁医学院学报,2013,36(3):221-224.
[8] Chen C,Chang Y C,Liu C L,et al.Leptin-induced growth of human ZR-75-1breast cancer cells is associated with up-regulation of cyclin D1and c-Myc and down-regulation of tumor suppressor p53and p21WAF1/CIP1[J].Breast Cancer Res Treat,2006,98(2):121-132.
[9]Chen C,Chang Y C,Liu C L,et al.Leptin induces proliferation and anti-apoptosis in human hepatocarcinoma cells by up-regulating cyclin D1and down-regulating Bax via a Janus kinase 2-linked pathway[J].Endocr Relat Cancer,2007,14(2):513-529.
[10]Shahab Uddin,Prashant Bavi,Abdul K Siraj,et al.Leptin-R and its association with PI3K/AKT,signaling pathway in papillary thyroid carcinoma[J].Endocrine-Relatad Cancer,2010(17):191-202.
