分散固相萃取-高效液相色谱法测定谷物中的桔霉素
2015-03-24黄晓东谢飞飞
黄晓东,卢 健,谢飞飞
(1.安徽省生物制品与食品检测检验及其标准化技术公共服务平台,安徽芜湖 241000;2.安徽工程大学生物与化学工程学院,安徽芜湖 241000)
分散固相萃取-高效液相色谱法测定谷物中的桔霉素
黄晓东1,卢 健2,谢飞飞2
(1.安徽省生物制品与食品检测检验及其标准化技术公共服务平台,安徽芜湖 241000;2.安徽工程大学生物与化学工程学院,安徽芜湖 241000)
目的:建立谷物中桔霉素含量的测定方法。方法:以60%乙醇作提取剂,C18吸附剂分散固相萃取净化样品中的桔霉素,应用高效液相色谱进行分析。结果:该方法标准曲线方程Y=3.13×10-7X-5.59×10-2,线性相关系数R2=0.9999,检出限为0.005mg/L,重复性实验精密度(RSD)为4.51%,加标回收率范围为87.7%~96.4%,所测的三种谷物样品桔霉素含量为0.116~0.385μg/g。结论:该方法简便、准确,可用于谷物中桔霉素含量的测定。
分散固相萃取,桔霉素,谷物,高效液相色谱法
桔霉素(citrinin)是一种真菌产生的次级代谢产物,具有肾毒性。通常在污染的大麦、燕麦、大米和玉米等谷物中可能含有桔霉素[1],但我国还没有建立相关的国家标准检测方法。目前文献报道的桔霉素检测方法有高效液相色谱法[2]、酶联免疫吸附法[3]、液质联用分析法[4]、薄层层析法[5]、抑菌圈法[6]等。薄层层析法、抑菌圈法是较早用于毒素检测的一种方法,方法简单,但灵敏度相对较差,已远远不能满足现代检测要求。酶联免疫法适合于大批量样本的检测,但重现性差,常常需要验证。目前国外相关报道中多为高效液相色谱法和酶联免疫吸附法,Dohnal等[7]选用反相高效液相色谱法进行检测,以甲醇-磷酸盐(80∶20)作为流动相,检测波长为321nm,最低检测限量可达100pg。高效液相色谱法、液质联用分析法、气质联用分析法等方法灵敏、准确[8],但在桔霉素样品前处理时有操作复杂、成本较高等缺陷。分散固相萃取法[9-11]是近几年发展起来的前处理方法,将固相萃取吸附剂颗粒分散在样品的萃取液中,省去了固相萃取法的繁琐,方法更加快速、简便。
1 材料与方法
1.1 材料与试剂
大米、小麦、大麦 产自安徽芜湖;桔霉素标准品 纯度≥99%,北京泰乐琪科技有限公司;乙醇(分析纯)和乙腈(色谱纯) 均购于国药集团化学试剂有限公司;甲醇 色谱纯,天津市大茂化学试剂厂;水为超纯水。
1.2 仪器和设备
Prominence LC-20A高效液相色谱仪 日本岛津公司;KQ-250E型超声波清洗仪 昆山市超声仪器有限公司;RE-85Z旋转蒸发仪 上海青浦沪西仪器厂;TGL-16G高速离心机 上海安亭仪器厂。
1.3 实验方法
1.3.1 色谱条件 Shim-pack VP-ODS色谱柱(150mm×4.6mm,5μm);柱温:28℃;流速:1.0mL/min;进样量:10uL;流动相:乙腈∶甲醇∶水=70∶10∶20(以磷酸调pH为2.5);检测器:荧光检测器,激发波长331nm,发射波长500nm[2]。
1.3.2 桔霉素标准曲线的绘制 准确称取1.0mg桔霉素固体标准品,用甲醇配制成100mg/L桔霉素标准储备液。取一定量的储备液,用甲醇逐级稀释成浓度分别为10.0、5.0、1.0、0.25、0.1、0.05mg/L的桔霉素标准溶液,在选定色谱条件下进行HPLC检测,并计算桔霉素标准曲线线性关系方程。
1.3.3 样品处理 将谷物粉碎后,充分混匀。称取1.0g谷物样品于15mL离心管中,加入4.0mL 60%乙醇,震荡混匀后,于30℃超声提取30min,8000r/min离心10min。重复提取一次,合并上清液并用60%乙醇定容至10mL。
向上述提取液中加入100.0mg C18固相分散萃取净化剂,震荡混匀,8000r/min离心10min,取上清液至旋转蒸发仪中,在(39±2)℃的水浴上旋转蒸发,旋干后,用2.0mL甲醇复溶。经0.45um有机滤膜过滤后,供HPLC分析[9]。
1.3.4 超声提取条件的选择 提取温度:取1.0g小麦样品,加入5.0mL 60%乙醇,分别于20、30、40、50℃超声提取20min,进行样品处理,通过HPLC测定,选择最佳提取温度。
提取时间:取1.0g小麦样品,加入5.0mL 60%乙醇,于30℃超声提取20、25、30、35、40min,进行样品处理,通过HPLC测定,选择最佳提取时间。
固液比:取1.0g同一小麦样品4份,分别按提取剂与样品的固液比(1∶2、1∶3、1∶4、1∶5)加入60%乙醇,于30℃超声提取30min,进行样品处理,通过HPLC测定,选择最佳固液比。
1.3.5 提取剂浓度的选择 分别用浓度为50%、60%、70%和80%的乙醇溶液作为提取剂,对添加了1.0mL 10.0mg/L的桔霉素标准液的小麦样品按1.3.3进行处理,HPLC测定,根据桔霉素的回收率选择最佳提取剂浓度。
1.3.6 分散吸附剂的选择 分别用C8吸附剂、C18吸附剂、PSA(乙二胺-N-丙基)吸附剂和石墨化碳作为分散吸附剂,在添加了1.0mL 10.0mg/L桔霉素标准液的小麦样品中加入60%的乙醇溶液,按1.3.3进行样品处理,通过HPLC测定,确定最佳的分散吸附剂。
1.3.7 方法的重复性实验 称取1.0g小麦样品,添加1.0mL 10.0mg/L桔霉素标准液,按1.3.3进行样品处理,通过HPLC分析。连续五天平行测定同一种谷物样品,计算其精密度。
1.3.8 方法的回收率实验 在1.0g小麦样品中添加1.0mL 10.0mg/L桔霉素标准液,依法进行HPLC分析,计算其加标回收率。
1.3.9 结果计算公式c1=c×V/m
式中:c1为样品中桔霉素含量,单位为微克每克(μg/g);c为仪器检测的质量浓度,单位为毫克每升(mg/L);V为最终定容体积,单位为毫升(mL);m为样品质量,单位为克(g)。
2 结果与讨论
2.1 样品前处理条件的选择
2.1.1 超声提取条件的选择 结果如图1,表明固液比为1∶4,在30℃时超声处理30min,样品的提取效果比较好。
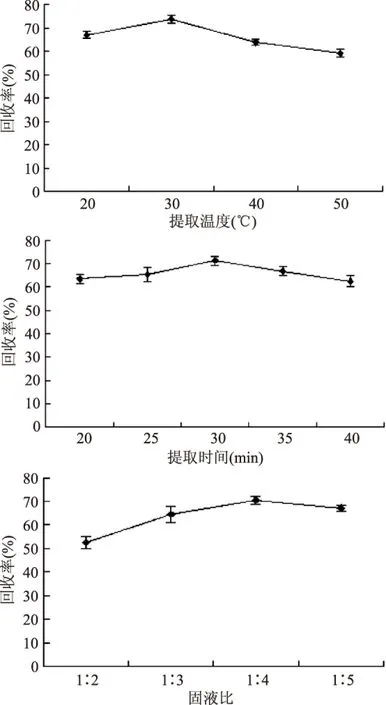
图1 超声提取条件优化Fig.1 Optimization of ultrasound extraction
2.1.2 提取剂浓度的选择 根据文献[12]报道,桔霉素易溶于甲醇、乙醇,但甲醇具有低毒性,因此本文采用乙醇作为提取剂。结果如图2。可见随着乙醇浓度的升高,桔霉素的回收率增加,至60%乙醇时达到最高,此后逐步下降,故选用60%乙醇作为提取剂。
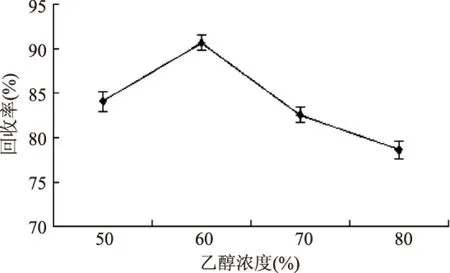
图2 提取剂对回收率的影响Fig.2 Effect of different extraction agents on recovery
2.1.3 分散吸附剂的选择 结果如图3,可见用石墨化碳吸附剂和C8吸附剂作为分散吸附剂时,桔霉素的回收率较低,且PSA对样品中的杂质等干扰物吸附去除量不大,而使用C18吸附剂时,桔霉素的回收率能达到87.88%,同时,考虑高效液相色谱所用色谱柱是反相C18柱,在前处理过程中使用C18吸附剂,有助于去除对色谱柱性能及分离分析有影响的杂质,故本文选用C18作为分散吸附剂。
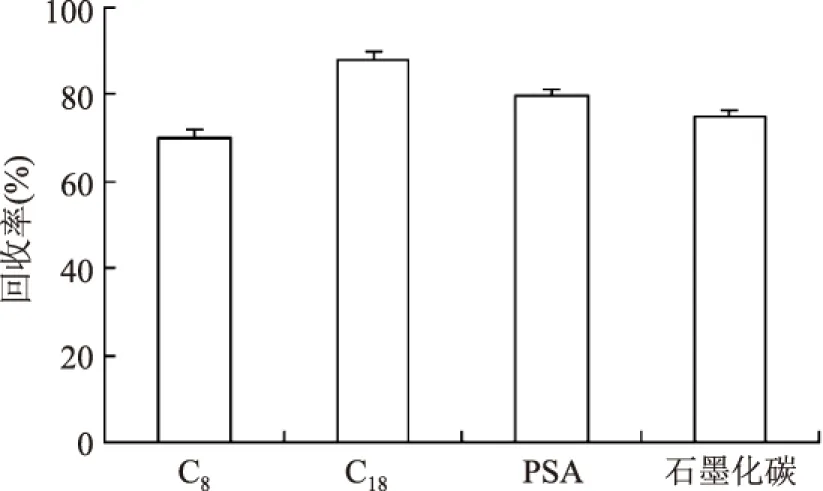
图3 分散吸附剂对回收率的影响Fig.3 Effect of different Scattered adsorbent on recovery
2.2 桔霉素标准曲线的绘制
以峰面积为横坐标,桔霉素浓度为纵坐标绘制标准曲线,经计算其回归方程为:Y=3.13×10-7X-5.59×10-2,R2=0.9999,表明在0.05~5mg/L的范围内,峰面积与桔霉素质量浓度之间线性关系良好,根据信噪比S/N=3得出最低检出限为0.005mg/L。
图4为浓度为1.0mg/L的桔霉素标准液的色谱图,桔霉素的保留时间为7.163min,理论塔板数为3362,较大,表明柱效较好。
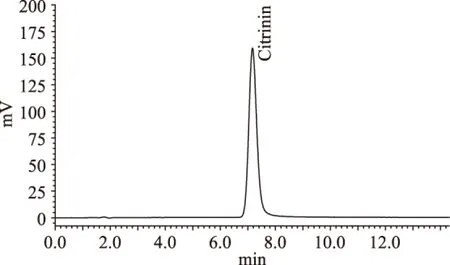
图4 1.0mg/L桔霉素标准溶液色谱图Fig.4 The chromatogram of standard citrinin(1.0mg/L)
2.3 方法的重复性实验
对小麦样品,在同样实验条件下从前处理步骤开始每天测定1次,连续5d,测定结果见表1。由表1可知,该方法具有良好的重复性和精密度。
2.4 方法的回收率实验
回收率结果见表2。数据显示,实验获得的回收率范围为87.7%~96.4%,平均回收率为92.48%,RSD为3.68%,方法的准确度较高。
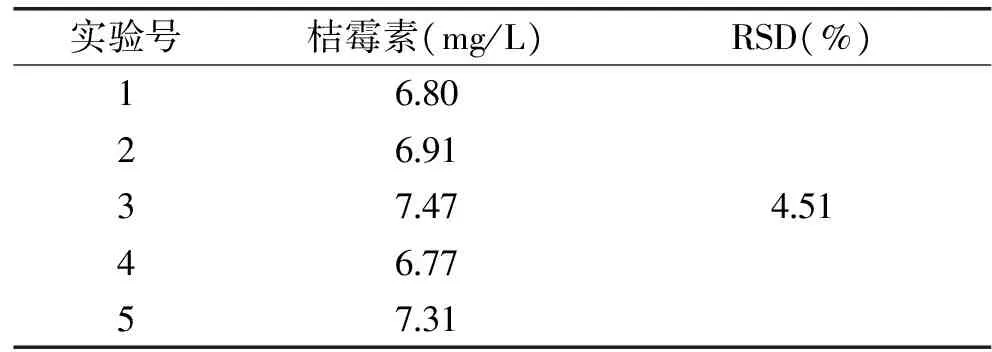
表1 方法重复性实验结果Table 1 Result to method repeated experiments
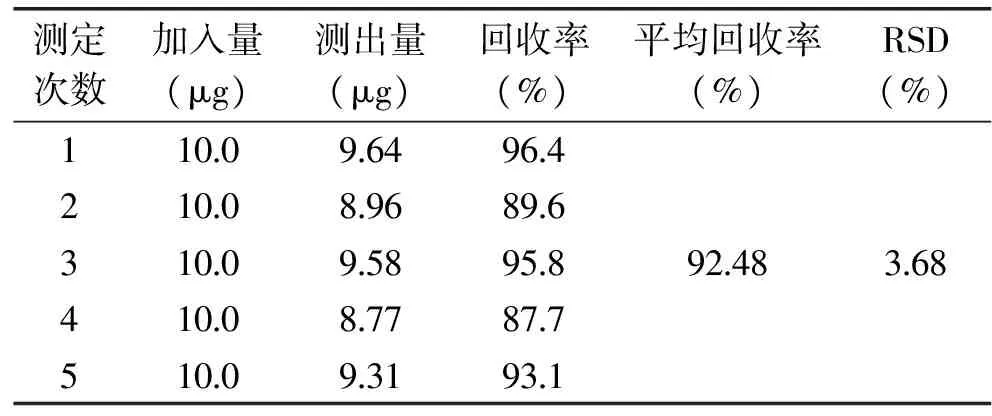
表2 桔霉素加标回收率测定结果Table 2 Recovery rates of citrinin
2.5 谷物样品测定
分别对大米、小麦、大麦等三种谷物样品进行了测定,结果见表3。由表3可知,在大米、小麦、大麦等三种谷物中均存在桔霉素,且大麦中桔霉素的含量较高,相对标准偏差在3.77%~4.43%之间。图5是大米样品的色谱图,可见检测时间在10min之内,较为快捷。
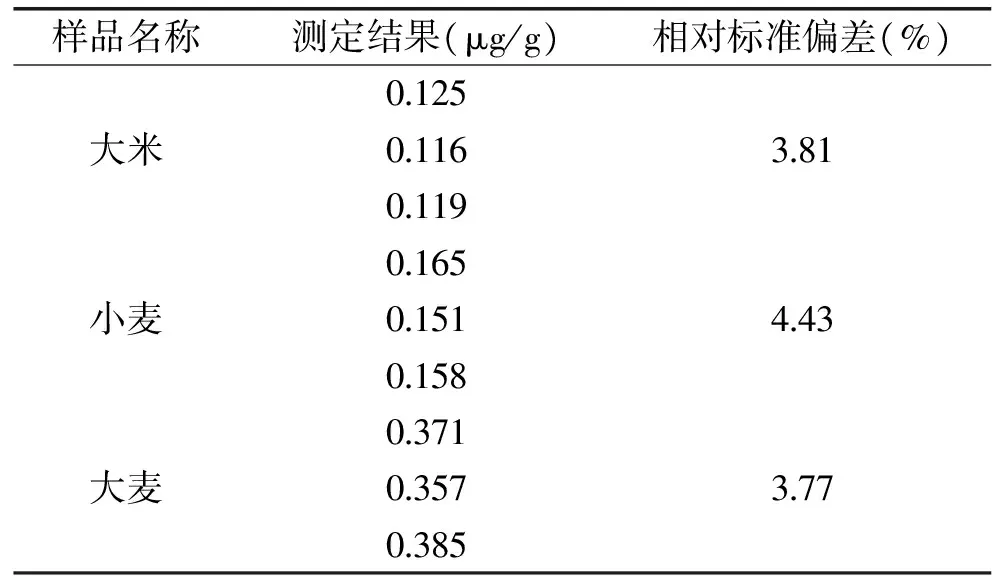
表3 样品桔霉素含量测定结果Table 3 The contain of citrinin in grain
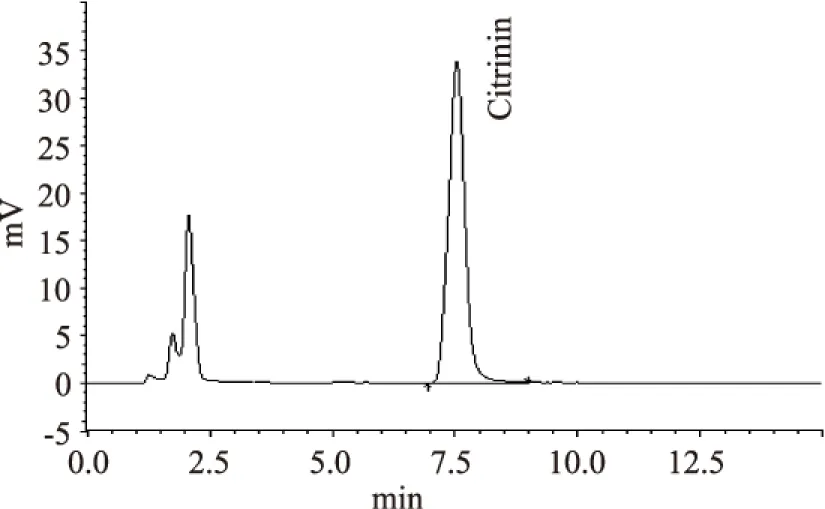
图5 大米样品色谱图Fig.5 The chromatogram of rice
3 结论
本文建立的分散固相萃取高效液相色谱法测定谷物中的桔霉素,样品前处理操作快速简便,方法重现性较好。加标回收率在87.7%~96.4%之间,重复性实验RSD为4.51%,最低检出限为0.005mg/L,实际样品检测中大米含桔霉素为0.116~0.125μg/g,小麦为0.151~0.165μg/g,大麦为0.357~0.385μg/g,检测效果较为满意,适用于谷物中桔霉素的快速检测。
[1]AM do Rosario Marinho. Dicitrinol,a Citrinin Dimer,Produced by Penicillium janthinellum[J].Helvetica Chimica Acta,2011(94):835-841.
[2]李志强,袁永俊,张晓龙.高效液相色谱法测定桔霉素[J].中国调味品,2011(4):72-75.
[3]Kononenko G P,Burkin A A. Immunoenzyme method for the determination of citrinin[J]. Zhurnal Analjticheskoi Khimii,2007,62(7):769-774.
[4]李燕,仇峰,杨美华,等.高效液相色谱-串联质谱法测定中药中桔青霉素[J].药物分析杂志,2011(9):1726-1730.
[5]胡晓清,陈福生,邢淑婕,等.红曲中桔霉素的薄层层析分析[J].食品科学,2003,24(5):126-129.
[6]陈奇,王伟平,张华山,等.红曲米中桔霉素的快速检测方法研究[J].食品科技,2012(11):297-299.

for Citrinin Determination Using High-Performance Liquid Chromatography with Fluorescence Detection[J].Analytical Letters,2010,43(5):786-792.
[8]Zaied C,Zouaoui N,Bacha H,et al.Natural occurrence of Citrinin in Tunisian wheat grains[J].Food Control. 2012.
[9]林海丹,邹志飞,秦燕,等.分散固相萃取-高效液相色谱法快速测定果蔬中的6种保鲜剂残留量[J].色谱,2013(2):170-173.
[10]Gouri S,Yogesh K T,Rajinder K G.A novel optimised and validated method for analysis of multi-residues of pesticides in fruits and vegetables by microwave-assisted extraction(MAE)-dispersive solid-phase extraction(d-SPE)-retention time locked(RTL)-gas chromatography-mass spectrometry with Deconvolution reporting software(DRS)[J].Food Chemistry,2011(3):1300-1308.
[11]Maristela B,Cerqueira,Sergiane S,et al.New sorbent in the dispersive solid phase extraction step of quick,easy,cheap,effective,rugged,and safe for the extraction of organic contaminants in drinking water treatment sludge[J].Journal of Chromatography A,2014(4):10-22.
[12]虞慧玲,许赣荣,陈蕴.红曲桔霉素样品预处理的探讨[J].食品与发酵工业,2003(6):55-59.
Determination of citrinin in grain bydispersive solid-phase extraction and HPLC
HUANG Xiao-dong1,LU Jian2,XIE Fei-fei2
(1.Anhui Public Service for Biological Products and Food Inspection withStandardization Technology Platform,Wuhu 241000,China;2.College of Biochemistry Engineering,Anhui Polytechnic University,Wuhu 241000,China)
Objective:To establish a method to determine the content of citrinin in grain. Method:The samples were extracted with 60% ethanol,and cleaned up by dispersive solid-phase extraction with C18dispersant sorbent and ready for HPLC determination. Results:A standard curve equation was built as follows:Y=3.13×10-7X-5.59×10-2with linear correlation coefficient of 0.9999 and RSD was 4.51%. The average recovery range was 87.7%~96.4%.The citrinin content range of the samples was 0.116~0.385μg/g.Conclusion:This method was sample and accurate,which could be used for detecting citrinin in grain.
dispersive SPE;citrinin;grain;HPLC
2014-05-04
黄晓东(1963-),男,硕士,副教授,研究方向:生物制品与食品检验。
TS207.3
B
1002-0306(2015)05-0263-04
10.13386/j.issn1002-0306.2015.05.047
