枣GDP-D-甘露糖焦磷酸化酶基因的克隆及生物信息学分析
2015-03-24陈莹莹赵智慧卜娇迪刘孟军
陈莹莹,赵智慧,卜娇迪,赵 锦,*,刘孟军,*
(1.河北农业大学中国枣研究中心,河北保定 071001;2.河北农业大学生命学院,河北保定 071001)
枣GDP-D-甘露糖焦磷酸化酶基因的克隆及生物信息学分析
陈莹莹1,赵智慧1,卜娇迪2,赵 锦2,*,刘孟军1,*
(1.河北农业大学中国枣研究中心,河北保定 071001;2.河北农业大学生命学院,河北保定 071001)
GDP-D-甘露糖焦磷酸化酶(GDP-D-mannose pyrophosphorylase,GMP)是植物AsA生物合成的第一个关键酶,至今未见该基因在枣中的相关报道。本研究根据 GenBank 中登录的苹果、桃和草莓等植物GMP保守序列设计引物,采用同源克隆法,从“骏枣”果实中克隆出该基因并对其编码的蛋白进行了生物信息学分析。该基因包含完整的开放阅读框为1086bp,编码361个氨基酸残基,预测蛋白分子量为39.588ku,理论pI值为7.12,命名为ZjGMP(登录号KJ934995);序列分析表明,枣GMP与桃、葡萄、草莓、苹果GMP的相似性分别为88%、87%、87%和87%。进化树分析表明,该基因与桃、苹果和草莓等植物的GMP亲缘关系较近。
枣,GDP-D-甘露糖焦磷酸化酶,基因克隆,生物信息学分析
抗坏血酸(ascorbic acid,AsA)又称维生素C(VC),在生物体中具有重要的代谢功能和抗氧化作用。一方面,它是维持人体健康必不可少的物质[1],缺乏AsA会导致坏血病;另一方面,在植物生长发育过程中如信号转导、细胞生长分裂以及激素合成等诸多方面发挥着重要作用[2],此外,在植物抗寒、抗旱及耐盐碱等抗逆方面有非常重要的生理功能[3]。枣树(ZiziphusjujubaMill.)是我国重要的药食同源植物之一[4],枣果中富含高AsA而广受人们关注,大部分枣品种果实中AsA含量高达400~600mg/100g,有一些品种甚至高达1000mg/100g。因此,研究枣中AsA的合成和调控机制,对揭示枣果积累高含量AsA有着重要意义。
高等植物中主要以L-半乳糖途径合成AsA[5-8],如刺梨、苹果、猕猴桃等。GMP是L-半乳糖途径中的第一步关键酶,催化D-甘露糖-1-磷酸生成GDP-D-甘露糖。GDP-D-甘露糖是AsA合成的基本前提物质,同时又是细胞壁多糖合成和蛋白质糖基化的原料。GMP基因已从拟南芥[9]、桃[10]、番茄[11]等植物中克隆得到,在枣中未见GMP基因的相关报道。邹礼平[12]在研究番茄AsA生物合成与代谢相关基因克隆与调控时发现GMP 基因在果实中的表达高于其他器官。Badejo等[13]研究金虎尾GMP基因的表达模式发现,GMP 基因在果实中的表达水平高于其他器官且在青熟果中表达量最高,随着果实的成熟,其在 mRNA 水平上的表达也降低。因此,本研究拟以“骏枣”为材料,从中克隆GMP基因并进行生物信息学分析,以期通过生物技术的方法提高枣AsA的含量,这对于增加枣产品的营养品质和增强枣树本身抗逆性,都具有重要意义。
1 材料与方法
1.1 材料与仪器
实验材料 取自山西省国家枣种质资源圃,品种为“骏枣”,采样时间为2013年6月,在田间采集新鲜果实后迅速放入冰盒,带回实验室液氮速冻后存于-70℃冰箱备用。
感受态大肠杆菌DH5α、PMD-19T Vector 购自宝生物工程有限公司产品;凝胶纯化试剂盒(EZ-10 Spin柱式DNA胶回收试剂盒)、引物合成及测序 由上海生工生物工程有限公司完成;TransScript First-strand cDNA synthesis super Mix AT301 购于全试金公司 其余试剂为国产分析纯试剂。
DYY-34型琼脂糖水平电泳槽 北京六一仪器厂;TC-XP型基因扩增仪 杭州博日科技;高速冷冻离心机 Sigma3K15型;PSH-3C型酸度计;电子天平 赛多丽斯精度1/1000g;SZ-自动双重纯水蒸馏器 上海亚荣生化仪器厂;凝胶成像系统、蛋白质电泳系统、电泳槽、湿转仪 美国Bio-Rad公司;电热恒温培养箱 天津市泰斯特仪器有限公司,型号D1-15000AB。
1.2 实验方法
1.2.1 GMP基因的cDNA克隆 枣果实总RNA的提取参照改良的CTAB法[14],参考TransScript First-strand cDNA synthesis super Mix AT301(TransGen Biotech,China)使用说明合成cDNA 第1链。以合成的cDNA第1链为模板,根据已报道的苹果(AAV49507.1)、桃(BAH03301)、草莓(XM_004307527.1)等GDP-D-甘露糖焦磷酸化酶的保守区设计一对简并引物,GMP-F:5′-ATGAA GGCACTTATTCTYGTYGGDG-3′;GMP-R:5′-TYACATDACAATYTCYGGCTTCAAA-3′,进行PCR扩增,94℃预变性5min;94℃变性1min,退火温度55℃ 1min,72℃延伸1min,40个循环;72℃终延伸10min。
将克隆获得的产物切胶回收,与pMD19-T载体连接后转化大肠杆菌DH5α,在含有Ampicillin抗性的固体LB培养基上37℃过夜培养,挑取单菌落,在Ampicillin抗性的液体LB培养基上37℃摇菌6h,经菌液PCR验证后送公司测序。
1.2.2 枣L-半乳糖-1-磷酸磷酸酶基因cDNA序列的生物信息学分析 将所测定的序列应用DNAMAN进行比对和拼接,并将其翻译成蛋白质;用ProtParam计算蛋白质的相对分子量和理论等电点;通过ExPASy Proteomics Server系统中的软件在线预测二级结构;用NCBI网站的CDD(Conserved Domain Database)进行氨基酸序列结构域分析;利用NCBI数据库,进行Blast 序列相似性分析,查找同源的蛋白质序列,用MEGA 5绘制同源进化树。用Signal P3.0 Server(http://www.cbs.dtu. dk/services/Signal P)进行蛋白质序列中信号肽的预测分析。
2 结果与分析
2.1 枣果实总RNA的提取
本实验利用改良CTAB法提取获得的骏枣果实RNA,总RNA用1%琼脂糖电泳进行检测,结果见图1。由图1可以看出,获得的RNA其28S rRNA和18S rRNA两条带清晰完整,基本无拖尾,说明提取的RNA完整、无降解。同时,经检测,不同样品的核酸浓度均达到150ng/μL以上,且OD260/OD280介于1.9~2.0之间,说明RNA的含量和纯度可以满足后续实验要求。

图1 提取获得的 RNA 电泳检测结果Fig.1 Electrophoresis result of extracted RNA
注:M为DL 2000 marker分子量标准。
2.2 枣GMP基因完整开放阅读框的获得
利用本实验设计的GMP-F和GMP-R引物进行PCR扩增,先利用梯度PCR技术[15]筛选出最佳退火温度为55℃,随后进行PCR扩增获得了1086bp左右的片段,编码361个氨基酸,该产物与pMD-19T载体连接,转化大肠杆菌DH5α,筛选阳性克隆进行测序,得到1086bp的完整编码区序列(图2)。在 NCBI 进行 BLAST 比对,发现该序列和桃GMP基因(AB457581.1)相似性达到88%,和苹果(GQ149071.1)、草莓(XM_004307527.1)GMP基因相似性达到87%,初步证明本研究获得的序列为枣的GMP基因序列,NCBI登录号为KJ934995,命名为ZjGMP。

图2 枣GMP基因编码区扩增结果和推测的氨基酸序列Fig.2 Electrophoresis result of CDS and deduced amino acid sequence of ZjGMP
注:1为PCR扩增产物;M为DL 2000 marker分子量标准。
2.3 枣ZjGMP蛋白生物信息学分析
在线(http://web.expasy.org/compute_pi/)预测ZjGMP所编码的氨基酸序列蛋白分子质量为39.588ku,理论等电点为7.12;用GOR IV做了二级结构分析(图3),表明ZjGMP含有20.5% α-螺旋结构,27.15%扩展链,52.35%无规则卷曲,它们交替散布于整个蛋白质中。利用Blastp搜索枣GMP氨基酸序列保守功能区,发现该基因含有醛酮还原酶的保守结构域及LbetaH 家族保守区(图4),这些保守区在细胞壁多糖合成、蛋白质糖基化及蛋白转录后调控等过程中具有重要作用[16-18]。将已获得的枣核苷酸序列与GenBank中已登录的其它高等植物GMP核苷酸序列相比对,发现枣GMP与桃、葡萄、草莓、苹果GMP的相似性分别为88%、87%、87%和87%。用软件DNAMAN对枣ZjGMP推导的氨基酸序列与其他植物的GMP氨基酸序列进行保守序列比对,结果见图5。图5结果显示,本研究获得的ZjGMP蛋白序列与其他植物的具有很高的同源性,进一步表明该序列为枣的GMP基因序列。同时,利用枣和苹果、草莓、桃等植物GMP序列,构建了系统进化树(图6),从该进化树可以看出,枣ZjGMP蛋白与桃、苹果和草莓的亲缘关系较近。另外,经信号肽扫描(SignalP 3.0)结果表明,该基因不存在信号肽序列,编码的产物为非分泌型蛋白。

图3 ZjGMP基因氨基酸的二级结构预测Fig.3 Predicted second structure of amino acid of ZjGMP gene
注:h、e、c分别表示α-螺旋、扩展链 和无规则卷曲氨基酸残基。
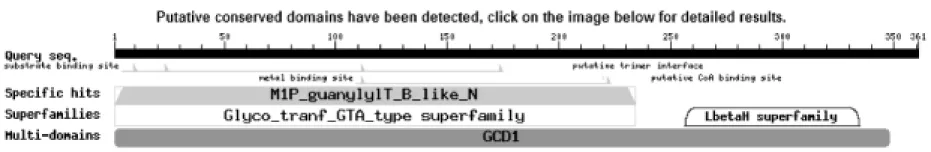
图4 ZjGMP蛋白结构域预测Fig.4 Conserved domains of ZjGMP

图5 ZjGMP和其他植物GMP基因蛋白保守结构比对Fig.5 Homology comparison of amino acid sequences alignment of ZjGMP with other plants
注:猕猴桃(Actinidia delicious)野茶树(Camellia sinensis) 温州蜜柑(Citrus unshiu)苹果(Malus domestica) 烟草(Nicotiana tabacum)碧桃(Prunus persica) 枣(Ziziphus jujuba)。

图6 枣ZjGMP基因与其他植物 GMP基因之间的分子进化树Fig.6 Phylogentic tree of ZjGMP and GMP genes from other plants
3 结论
在高等植物中已经证实L-半乳糖途径是抗坏血酸的主要合成途径,而GMP基因是该途径中第一个关键酶,目前已在桃、番茄和苹果等植物中克隆得到了GMP基因,并进行了较深入的研究,本研究采用同源克隆法首次获得了枣GMP基因,该基因cDNA序列含有1086bp的完整开放阅读框,编码361个氨基酸残基,与数据库中已知的桃、苹果及草莓等植物的GMP基因具有很高的同源性,对该序列保守区进行预测分析发现,ZjGMP基因存在一个左手平行的β-螺旋结构即LbetaH 家族保守区,该保守区包括三个不完全串联重复的六肽重复模型,说明其具有酰基转移酶的活性,具有这种结构的亚族也表现出离子转运或者翻译起始的活性,这与GMP基因的催化产物GDP-D-甘露糖作为细胞壁合成和蛋白质糖基化的原料相符合。GMP基因不但对抗坏血酸合成起着关键作用,而且对植物的正常生长发育也都有重要的作用。利用MEGA 5对其核苷酸序列与其他8个物种的GDP-D-甘露糖焦磷酸化酶进行了比对,构建了进化树,分析了与其他8个物种之间的亲缘关系。
本研究首次得到了枣抗坏血酸GDP-D-甘露糖焦磷酸化酶基因的完整开放阅读框,对其所编码蛋白的结构特征分类进行了研究,为进一步基因功能及分子育种研究奠定了基础。
[1]Sarkar N,Srivastava P K,Dubey V K. Understanding the language of vitamin C[J]. Current Nutrition & Food Science,2009,5(1):53-55.
[2]Davey M W,Montagu M V,Inzé D,et al. Plant L-ascorbic acid:chemistry,function,metabolism,bioavailability and effects of processing[J]. Journal of the Science of Food and Agriculture,2000,80(7):825-860.
[3]安华明,陈力耕,樊卫国,等. 高等植物中维生素 C 的功能,合成及代谢研究进展[J]. 植物学通报,2005,21(5):608-617.
[4]刘孟军,汪民.中国枣种质资源[G].北京:中国林业出版社,2009.
[5]Wheeler G L,Jones M A,Smirnoff N. The biosynthetic pathway of vitamin C in higher plants[J]. Nature,1998,393(6683):365-369.
[6]Gatzek S,Wheeler G L,Smirnoff N. Antisense suppression of l-galactose dehydrogenase in Arabidopsis thaliana provides evidence for its role in ascorbate synthesis and reveals light modulated l-galactose synthesis[J]. The Plant Journal,2002,30(5):541-553.
[7]Smirnoff N,Conklin P L,Loewus F A. Biosynthesis of ascorbic acid in plants:a renaissance[J]. Annual review of plant biology,2001,52(1):437-467.
[8]Linster C L,Gomez T A,Christensen K C,et al. Arabidopsis VTC2 encodes a GDP-L-galactose phosphorylase,the last unknown enzyme in the Smirnoff-Wheeler pathway to ascorbic acid in plants[J]. Journal of Biological Chemistry,2007,282(26):18879-18885.
[9]Conklin P L,Pallanca J E,Last R L,et al. L-ascorbic acid metabolism in the ascorbate-deficient Arabidopsis mutant vtc1[J]. Plant Physiology,1997,115(3):1277-1285.
[10]Imai T,Ban Y,Terakami S,et al. l-Ascorbate biosynthesis in peach:cloning of six l-galactose pathway-related genes and their expression during peach fruit development[J]. Physiologia plantarum,2009,136(2):139-149.
[11]Zou L P,LI H X,Ouyang B,et al. Cloning,Expression,and Mapping of GDP-D-mannose Pyrophosphorylase cDNA from Tomato(Lycopersiconesculentum)[J]. Acta Genetica Sinica,2006,33(8):757-764.
[12]邹礼平. 番茄抗坏血酸生物合成与代谢途径中相关酶基因的克隆与调控[D]. 武汉:华中农业大学,2005.
[13]Badejo A A,Jeong S T,Goto-Yamamoto N,et al. Cloning and expression of GDP-d-mannose pyrophosphorylase gene and ascorbic acid content of acerola(MalpighiaglabraL.)fruit at ripening stages[J]. Plant Physiology and Biochemistry,2007,45(9):665-672.
[14]刘中成. 枣的总RNA提取及mRNA 差异显示技术体系的建立[D].保定:河北农业大学,2005.
[15]张传义,孟玉平,孙海峰,等.苹果AFL1基因原核表达载体的构建及其在大肠杆菌中的表达[J].山西农业科学,2008,36(7):14-16.
[16]Reiter W D,Vanzin G F. Molecular genetics of nucleotide sugar interconversion pathways in plants[M]. Plant Cell Walls. Springer Netherlands,2001:95-113.
[17]Wilson I B H. Glycosylation of proteins in plants and invertebrates[J]. Current opinion in structural biology,2002,12(5):569-577.
[18]Oxley D,Bacic A. Structure of the glycosyl-phosphatidylinositol anchor of an arabinogalactan protein fromPyruscommunissuspension-cultured cells[J]. Proceedings of the National Academy of Sciences,1999,96(25):14246-14251.
Cloning and bioinformatic analysis ofGDP-D-mannose pyrophosphorylase gene fromZiziphusjujuba
CHEN Ying-ying1,ZHAO Zhi-hui1,BU Jiao-di2,ZHAO Jin2,*,LIU Meng-jun1,*
(1.Research Center of Chinese Jujube,Agricultural University of Hebei,Baoding 071001,China;2.College of Life Science,Agricultural University of Hebei,Baoding,071001,China)
GDP-D-mannose pyrophosphorylase is an enzyme ininitial committed step of AsA biosynthesis,which has not been reported in Chinese jujube. In this paper,an 1086bp open reading frame cDNA encoding GMP was cloned from ‘junzao’ by homologous gene cloning method on the basis of the homologous genes ofMalusdomestica,PrunuspersicaandFragariavesca,etc. in GenBank. The sequence was namedZjGMP(accession number KJ934995)and encoded 361 amino acids,with molecular weight 39.588ku and theoretical isoelectric point 7.12. Similarity analysis showed that the protein had highly similar to theZjGMPofPrunuspersica,Vitisvinifera,FragariavescaandMalusdomesticawith similar of 88%,87%,87% and 87% respectively;phylogenic analysis showed that GMP from jujube had a closer relationship with that fromPrunuspersica,MalusdomesticaandFragariavesca.
Ziziphusjujuba;GDP-D-mannose pyrophosphorylase;cloning;bioinformatic analysis
2014-06-12
陈莹莹(1987- ),女,在读硕士生,研究方向:果树活性物质与功能性食品。
*通讯作者:刘孟军(1966-),男,博士,研究方向:干果种质资源与分子辅助育种。 赵锦(1977-),女,博士,研究方向:植物种质资源利用。
国家科技支撑项目(2013BAD14B03);河北省科技支撑计划(11230606D-6);河北省青年拔尖人才计划。
TS201.3
A
1002-0306(2015)05-0140-04
10.13386/j.issn1002-0306.2015.05.021
