亚硒酸钠对海洛因吸食者T淋巴细胞增殖及其线粒体功能的影响
2015-03-24付青梅张永春张永创卜英博
付青梅,张永春,张永创,卜英博,谢 淼,王 茜
亚硒酸钠对海洛因吸食者T淋巴细胞增殖及其线粒体功能的影响
付青梅,张永春,张永创,卜英博,谢 淼,王 茜
目的 探讨亚硒酸钠对海洛因吸食者T淋巴细胞的保护作用及其与线粒体解偶联相关指标的关系。方法 使用不同海洛因吸食年限人员外周血,提取T淋巴细胞;四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)法检测细胞生长情况,荧光分光光度法检测细胞内活性氧(reactive oxygen species,ROS)、细胞线粒体膜电位(mitochondrial membrane potential,△Ψm),用紫外分光光度计测线粒体通透性转运孔(mitochondrial permeability transition pore,MPTP)。结果 随着吸食海洛因的时间增加,T淋巴细胞的增殖活性下降,差异有统计学意义(P<0.05);随着海洛因吸食年限的增加,T淋巴细胞线粒体MPTP增加、△Ψm下降、ROS升高(P<0.05);亚硒酸钠可逆转上述改变,且存在量效关系(P<0.05)。结论 长时间吸食海洛因所造成的氧化应激状态,通过线粒体途径对T淋巴细胞的功能和增殖情况有不利影响;亚硒酸钠可以通过其抗氧化作用,降低ROS水平来逆转上述过程,对T淋巴细胞具有保护作用。
亚硒酸钠;T淋巴细胞;线粒体;线粒体通透性转运孔;活性氧;细胞线粒体膜电位
目前,国内外部分研究提示,海洛因对机体的主要影响是吸食者的尿硒浓度明显低于健康人群[1]。硒在细胞抗氧化系统中占有重要位置,具有保护细胞膜结构、维持生物功能、增强机体免疫力、预防疾病等重要作用,硒能够增强淋巴细胞的抗氧化性,使免疫细胞免受损害。还可提高机体合成IgG、IgM等抗体的能力,提高机体免疫功能,且维生素E和硒的化合物能够降低海洛因成瘾大鼠的氧自由基含量,增强其抗氧化功能[2]。线粒体作为细胞能量供应的核心细胞器,在细胞发挥其功能和调节细胞凋亡中起关键作用[3]。本研究选择亚硒酸钠作为干预因素,对海洛因吸食者外周血T淋巴细胞进行浸染,观察亚硒酸钠对T淋巴细胞是否具有保护作用,且与线粒体解偶联相关指标是否具有相关性,为下一步系统研究积累一定技术和实验依据。
1 材料与方法
1.1 材料 从戒毒中心随机选择100名男性青中年海洛因吸食者的外周血,亚硒酸钠(Sigma-Aldrich公司,批号:NC586234759)、无钙、镁离子的平衡盐溶液(D-Hank’s液,pH 7.2~7.4)、淋巴细胞分离液(天津市TBD生物技术发展中心)、RPMI1640培养基(GIBCO)、小牛血清(华西医科大学)、尼龙棉(上海化纤九厂)、MTT(Sigma公司)、詹纳斯绿B(索莱宝公司)、Rh123(索莱宝公司)、DCFH-DA活性氧检测试剂盒(碧云天生物技术研究所)。
1.2 方法
1.2.1 分组 100名海洛因吸食者根据入院前的综合检查情况,排除其他疾病,根据海洛因的吸食时间,将受试对象分为2、5、8年3个组别,实验前告知所有受试对象该研究的目的和意义,并选择20名健康成年男性的外周血作为对照。
1.2.2 外周血单个核细胞(peripheral blood mononuclear cell,PBMCs)的分离 采用密度梯度离心法[4]。取新鲜上述组别外周血,用D-Hank液稀释2~3倍,充分混匀后用无菌毛细吸管吸取5~6 ml稀释的白细胞悬液沿管壁小心缓慢地加入事先已装有3 ml淋巴细胞分离液的10 ml离心管内,水平式转头,2000 r/min离心,20 min,绝大多数PBMCs悬浮于血浆与分层液的界面上,为灰白色状,将此层移入另一试管。用5倍以上体积的D-Hank液充分洗涤,1600 r/min,离心8 min,弃上清;1000 r/min,离心10 min,弃上清液去除混杂的血小板,所得单个核细胞重悬于含100 ml/L胎牛血清蛋白(FCS)的RPMI1640培养基中。
1.2.3 PBMCs中淋巴细胞和单核巨噬细胞的分离 采用玻璃器黏附法[5]。将分离的PBMCs细胞数调至2×106/ml置于120 mm玻璃培养瓶内,充分摇晃,混匀,于50 ml/L CO2孵箱中37 ℃静置60~90 min后,以毛细吸管小心轻吸未黏附之细胞悬液,即为去除单核细胞的淋巴细胞悬液。
1.2.4 T淋巴细胞的分离纯化 采用尼龙棉柱滤过法[6]。尼龙棉以0.2 mol/L HCl浸泡6 h,再用大量蒸馏水反复冲洗,晾干。称取尼龙棉50 mg将其仔细撕开装填入10 ml注射器内,高压灭菌。尼龙棉柱高度为6 cm,可有效地过滤(2~3)×107个细胞。用D-Hank液和含200 ml/L FCS的RPMI1640培养基洗柱各2次,以平衡pH、温度、排除空气,37 ℃放置1 h。上柱前,先将平衡液放出,加入细胞数为2×107/ml的淋巴细胞悬液0.5 ml,平放尼龙棉柱,以细长的毛细滴管伸入柱内界面加入培养液0.5 ml封口,将柱于37 ℃静置孵育1 h。用预温的培养液淋洗柱2~3次,流速控制在1 ml/min,收集最初的10 ml流出液,1300 r/min,离心10 min,计数细胞并调整细胞数,此即分离的纯化T淋巴细胞。
1.2.5 T淋巴细胞的培养 将分离的T淋巴细胞培养于含200 ml/L FCS、2 mmol/L谷氨酰胺、20 mmol/L N-2-羟乙基哌嗪-N′-2-乙烷磺酸(HEPES)、100 U/ml 青霉素、100 U/ml链霉素的RPMI1640完全培养基中,调整细胞数为1×106/ml。
1.2.6 MTT法检测细胞生长 将分离所得的T淋巴细胞按2×105个/ml接种于24孔细胞培养板中;加入上述培养基1.5 ml培养4 h后,部分转入96孔板中,104个/孔,培养24 h后使用不同浓度的亚硒酸钠(0.02、0.1、0.500 μmol/L)侵染,生理盐水作为对照。干预48 h后小心吸取孔内培养基,每孔加入80 μl无血清培养基和20 μl MTT溶液(5 μg/L),继续培养4 h。小心吸取孔内液体,每孔加入150 μl二甲基亚砜,低速震荡10 min后,用酶标仪检测490 nm处的吸光度值。吸光度值反映细胞增殖活性,其高低与细胞增殖活性成正比。
1.2.7 线粒体的提取及形态学鉴定 T淋巴细胞接种于25 cm2细胞培养瓶中,培养致细胞汇合度为90%。细胞分组干预完成后,消化离心收集细胞,使用含250 mmol/L蔗糖的细胞裂解液裂解细胞,4 000 r/min离心10 min,取上清,10 000 r/min离心15 min,弃上清,收集沉淀为线粒体(注:提取线粒体步骤均于冰上进行)。将刚提取的线粒体均匀涂于载玻片上,再滴1滴0.02%詹纳斯绿B染液。覆盖玻片浸染10 min,用高倍镜(10×40)观察线粒体形态。实验重复3次。
1.2.8 MPTP开放度检测 细胞分组及刺激及线粒体的制备同上。使用测定介质(230 mmol/L甘露醇,70 mmol/L蔗糖,3 mmol/L Hepes,pH7.4)调整线粒体蛋白含量约为1 mg/ml。使用752 N型紫外分光光度计测定540 nm波长处吸光度值。MPTP开放造成线粒体膨胀,线粒体吸光度值减少越多,说明MPTP的开放程度越大,相反,线粒体吸光度值减少越小,说明MPTP的开放程度越小。
1.2.9 △Ψm的检测 细胞分组及刺激及线粒体的制备同上,向线粒体中加入测定介质P(4.2787 g蔗糖,0.0034 g KH2PO4,0.0260 g HEPES,0.0567 g琥珀酸钠溶于双蒸馏水中,定容至50 ml,过滤除菌,4 ℃保存)。调整线粒体蛋白含量,使各组含量基本一致。加入Rh 123染色液(DMSO配制,浓度为1 mg/ml),使其终浓度为5 μg/ml,37 ℃避光孵育30 min,使用Cary Eclipse荧光分光光度计测激发光为480 nm,发射光为525 nm的荧光强度,△Ψm与荧光强度呈负相关。
1.2.10 ROS的DCFH-DA荧光探针检测 细胞分组处理后收集细胞,加入终浓度为10 μmol/L的DCFH-DA,于37 ℃培养箱中孵育30 min。孵育结束后,用无血清培养基洗细胞3次,以充分去除未进入细胞内的DCFH-DA,再次收集细胞后,PBS重悬,用荧光分光光度汁测定2′,7′-二氯荧光黄(DCF)的荧光强度。检测条件:激发波长488 nm,发射波长525 nm,激发和发射波长的光栅宽度均设为5 nm。ROS含量与荧光强度呈正相关。

2 结 果
2.1 亚硒酸钠对T淋巴细胞增殖活性的影响 与各自对照组相比,随着亚硒酸钠浓度的增加细胞光密度(optical density, OD)值逐渐增加,差异有统计学意义(P<0.05);组间比较,相同剂量亚硒酸钠作用于不同年限吸毒组后,较之对照组,细胞OD值均降低,差异有统计学意义(P<0.05)。说明亚硒酸钠可以上调T淋巴细胞增殖活性;而长时间吸食海洛因可使T淋巴细胞增殖活性减低(表1)。
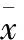
表1 亚硒酸钠对T淋巴细胞增殖活性的影响 (μmmol/L;±s)
注:与空白对照组比较,①P<0.05;相同剂量亚硒酸钠组与对照组比较,②P<0.05
2.2 线粒体形态学鉴定 詹纳斯绿B是线粒体的专一性染色剂,其染色原理是线粒体中细胞色素氧化酶使染料保持氧化状态呈蓝绿色,而在周围的细胞质中染料被还原,成为无色状态。经詹纳斯绿B染色后,提取的线粒体呈现圆形、椭圆形和杆状的蓝绿色物质(图1)。
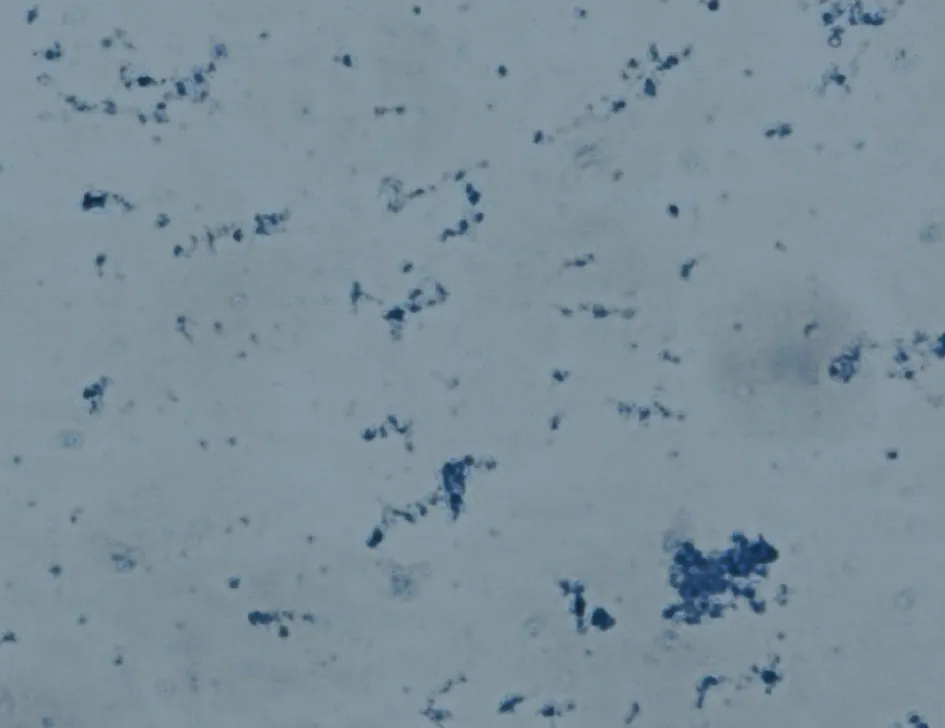
图1 线粒体的詹纳斯绿B染色(10×40)
2.3 MPTP开放度检测 与各自对照组相比,随着亚硒酸钠浓度的增加细胞OD值逐渐增加,差异有统计学意义(P<0.05);组间比较,相同剂量亚硒酸钠作用于不同年限海洛因吸食组后,较之对照组,细胞OD值均降低,差异有统计学意义(P<0.05)。说明亚硒酸钠可以使细胞线粒体MPTP开放度减低,对细胞线粒体起到一定保护作用;而长时间吸食海洛因可使细胞线粒体MPTP开放度增加(表2)。
2.4 △Ψm的检测 随着亚硒酸钠浓度的增加,较之各自对照组,细胞荧光强度降低,差异均有统计学意义(P<0.05)。组间比较,相同剂量亚硒酸钠组中,亚硒酸钠作用于于不同年限吸毒组后,较之亚硒酸钠所干预的正常组,细胞荧光强度增高,差异有统计学意义(P<0.05)。说明亚硒酸钠可以使细胞线粒体膜电位升高,对细胞线粒体起到一定保护作用;而吸食海洛因可使细胞线粒体膜电位降低(表3)。
2.5 细胞内ROS含量 与各自对照组相比,随着亚硒酸钠剂量的增加,细胞DCF荧光强度逐渐减低。相同剂量亚硒酸钠干预的不同组间比较,随着海洛因吸食时间的增加,细胞DCF荧光强度呈现增高趋势。说明亚硒酸钠可以使细胞ROS含量降低;而吸食海洛因可使细胞内ROS含量升高(表4)。

表2 亚硒酸钠对各组细胞MPTP的影响 (μmmol/L;±s)
注:与空白对照组比较,①P<0.05;相同剂量亚硒酸钠组与对照组比较,②P<0.05
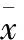
表3 亚硒酸钠对各组细胞线粒体膜电位的影响 (μmmol/L;±s)
注:与空白对照组比较,①P<0.05;相同剂量亚硒酸钠组与对照组比较,②P<0.05
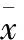
表4 亚硒酸钠对各组细胞内ROS的影响 (μmmol/L;±s)
注:与空白对照组比较,①P<0.05;相同剂量亚硒酸钠组与对照组比较,②P<0.05
3 讨 论
海洛因成瘾者易发各种微生物的感染,且感染后不易治愈。其艾滋病发生率、肿瘤发生率和转移率均明显高于普通人群,提示海洛因依赖者免疫功能紊乱或遭到严重损伤。相关研究提示,海洛因可以导致机体细胞免疫功能出现异常[7]。Simonovska 等[8]在对海洛因致成瘾者体液免疫的研究中指出,海洛因对成瘾者体液免疫功能有损伤作用,早期的报告中亦指出药物滥用能抑制外周血T细胞的E-花环形成,毒品依赖者外周血T细胞减少,丝裂原诱导的T细胞增殖能力下降[9]。线粒体是细胞的能量中心,细胞内大约90%的氧在线粒体被消耗,正常情况下绝大部分的氧在线粒体内被电子传递链传来的电子还原为水,3%~4%的氧被电子传递链漏出的电子单价还原,形成超氧阴离子,成为细胞内ROS的主要来源,生理条件下线粒体内存在有效的抗氧化机制,自由基可被抗氧化酶和抗氧化物清除[10]。但线粒体是机体承受体外有害因素打击的靶点,当其功能受到影响后,正常的氧化应激平衡被打破,此时机体就会受到氧化应激损伤[11],且线粒体功能的正常与否直接影响到细胞的增殖和凋亡[12],增殖和凋亡的总体表现为对细胞增殖活性的影响。然而,T淋巴细胞是细胞免疫的核心细胞,因而可影响细胞免疫功能。
线粒体作为细胞能量供应的核心,对不同细胞发挥其功能密切相关,其功能的紊乱也将对各细胞发挥其功能造成影响。有人对海洛因的损伤机制研究时发现,海洛因进入人体内后与体内的某些酶、受体蛋白结合产生性质活泼的氮自由基和其他类型自由基引发氧自由基反应和脂质过氧化反应而造成病理性损伤[13,14];硒能够增强淋巴细胞的抗氧化性,使免疫细胞免受损害[15]。因此,本研究以线粒体作为研究目标点,以亚硒酸钠作为实验干扰条件,选择与线粒体解偶联功能密切相关的Δψm、MPTP、ROS作为研究对象,以期从线粒体解偶联功能层面研究海洛因对免疫功能的影响。
本研究发现,随着亚硒酸钠剂量的增加,T淋巴细胞增殖活性逐渐增加。而相同剂量的亚硒酸钠干预组中,T淋巴细胞的增殖活性随着吸食海洛因的时间增加而下降,差异有统计学意义(P<0.05)。进一步提取T淋巴细胞线粒体后检测细胞内线粒体相关指标发现:随着毒品吸食年限的增加,T淋巴细胞线粒体MPTP增加、△Ψm下降、ROS升高。而用不同浓度的亚硒酸钠干预4组T淋巴细胞后发现,随着亚硒酸钠浓度的增加,细胞增殖活性增加,T淋巴细胞线粒体MPTP下降、△Ψm升高、ROS下降。综合分析出现以上实验结果,其原因可能是长期吸食毒品,其通过影响细胞内线粒体的相关功能,对机体免疫系统造成损害,使以T淋巴细胞为主的免疫细胞能量供应受损,甚至释放细胞色素C,启动线粒体介导的细胞凋亡途径,使T淋巴细胞功能和数量下降,进而使机体免疫功能受损。具体过程可能为长期吸食毒品所造成的机体氧化应激,该应激状态可导致细胞内活性氧含量增加,活性氧在正常情况下是一种外源性刺激的生理调节剂。然而,活性氧的过度增加可引起细胞的氧化损伤[16],当细胞内活性氧水平明显增加到一定程度时,可诱导线粒体膜渗透性转换孔开放,进而线粒体膜电位下降,线粒体膜电位的下降又发生于经线粒体诱导的凋亡途径中[17],使细胞增殖活性下降。下降的线粒体膜电位还可引起线粒体内细胞色素C释放,细胞色素C与胱天蛋白酶原9及胱天蛋白酶原9协同因子结合,形成凋亡小体,从而活化胱天蛋白酶3,活化的胱天蛋白酶3可清除细胞内许多与凋亡相关的蛋白质,最终引起细胞凋亡[18],并使T淋巴细胞增殖活性降低。
硒是谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)的重要组分,每个酶分子含有4个硒原子。GSH-Px是抗过氧化物的重要组成部分,其主要功能是阻止过氧化物和自由基的形成[19]。可见,硒最主要的生物学功能是构成谷胱甘肽过氧化物酶的重要成分,催化还原型谷胱甘肽变成氧化型谷胱甘肽,使有毒的过氧化物变成无毒的羟基化物。正是由于含硒的GSH-Px能催化H2O2还原,使活性氧减少。从而逆转上述过程,最终使细胞增殖活性上升。
本研究结果表明,长时间吸食海洛因所造成的氧化应激状态,通过细胞线粒体途径对T淋巴细胞的增殖有不利影响。而亚硒酸钠可以通过其抗氧化作用,降低ROS水平来逆转上述过程,对T淋巴细胞具有保护作用。本研究由于科研经费限制,未能检测与线粒体功能密切相关的细胞凋亡水平,使得结果有一定局限性。在今后的研究中将进一步做凋亡方面的检测,且本研究还处于细胞研究阶段,对细胞免疫功能的影响还有待于动物实验的进一步研究。
[1] Soykut B, Eken A, Erdem O,etal.Oxidative stress enzyme status and frequency of micronuclei in heroin addicts in Turkey[J]. Toxicol Mech Methods, 2013,23(9):684-688.
[2] Cemek M, Büyükokurogˇlu M E, Hazman O,etal. The roles of melatonin and vitamin E plus selenium in prevention of oxidative stress induced by naloxone-precipitated withdrawal in heroin-addicted rats[J]. Biol Trace Elem Res,2011,142(1):55-66.
[3] Lu N, Wei L, Gong D. VI-16, a newly synthesized flavonoid, induces apoptosis through the mitochondrial pathway in human hepatoma cells[J]. Oncol Rep, 2012,27(3):873-879.
[4] 巴德年.当代免疫学技术与应用[M].北京:北京医科大,学中国协和医科大学联合出版社,1998.156-158.
[5] 沈关心,周汝麟.现代免疫学实验技术[M].武汉:湖北科学技术出版社,1998.290.
[6] Schwartz R H,Jackson L,Paul W E.T lymphocyte-enriched murine peritoneal exudate cells.I.A reliable assay for anti-gen-induced T lymphocyte proliferation[J].J Immunol,1975,115(5):1330-1338.
[7] Riss G L, Chang D I, Wevers C.Opioid maintenance therapy restores CD4+T cell function by normalizing CD4+CD25(high) regulatory T cell frequencies in heroin user[J].Brain Behav Immun,2012,26(6):972-978.
[8] Simonovska N, Bozinovska C, Chibishev A,etal.Changes of some humoral immunologic indicators and clinical manifestations of cryoglobulinemia in heroin addicts[J]. Georgian Med News, 2012 ,(212):45-53.
[9] Wang W, Zhang R, Xing Y,etal.Changes and the implications of CD4+,CD25+,CD127(low), regulatory T cells in drug addicts during natural drug withdrawal[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2013,29(10):1072-1075.
[10] Mahanta R, Gogoi A, Chaudhury P N,etal.Association of oxidative stress biomarkers and antioxidant enzymatic activity in male infertility of north-East India[J]. J Obstet Gynaecol India,2012,62(5):546-550.
[11] Kumar A, Vashist A, Kumar P,etal.Protective effect of HMG CoA reductase inhibitors against running wheel activity induced fatigue, anxiety like behavior, oxidative stress and mitochondrial dysfunction in mice[J]. Pharmacol Rep,2012,64(6):1326-1336.[12] Hwang A B, Jeong D E, Lee S J.Mitochondria and organismal longevity[J]. Curr Genomics,2012,13(7):519-532.
[13] 周 亮,林敏仕,尹 恝.线粒体呼吸链复合物Ⅰ缺陷与海洛因海绵状白质脑病的关系[J]. 南方医科大学学报,2013, 33(9): 1357-1361.
[14] 冯红丽,李重阳,俞诗源,等.海洛因对仔鼠和母鼠肺中SOD、CAT活力和MDA含量及组织结构的影响[J]. 解剖学报,2009,40(2):288-294.
[15] 王红连,张东升,张凌裳.硒化灵芝多糖制备及免疫学相关研究[J].食品科学,2009, 30(17):316-318.
[16] Han S Y,Li H X,Ma X,etal.Protective effects of purified safflower extract on myocardial Ischemia in vivo and in vitro[J].Phytomedicine,2009,16(8):694-702.
[17] Wang C C,Liu T Y,Cheng C H,etal.Involvement of the mitochondrion-dependent pathway and oxidative stress in the apoptosis of murine splenocytes induced by areca nut extract[J].Toxicol In Vitro,2009,23(5):840-847.
[18] Na J Y, Kim S, Song K,etal.Anti-apoptotic Activity of Ginsenoside Rb1 in Hydrogen Peroxide-treated Chondrocytes: Stabilization of Mitochondria and the Inhibition of Caspase-3[J]. J Ginseng Res,2012,36(3):242-247.
[19] 左文涛,俞诗源,王 昱,等.X线对仔鼠胃组织结构及总抗氧化能力、谷胱甘肽过氧化物酶和谷胱甘肽还原酶活性的影响[J].解剖学报, 2011, 42(4):521-526.
(2014-08-11收稿 2014-12-23修回)
(责任编辑 岳建华)
Effects of sodium selenite on T lymphocyte proliferation and mitochondrial functioninvitro
FU Qingmei, ZHANG Yongchun, ZHANG Yongchuang,BU Yingbo,XIE Miao,and WANG Qian.
Guizhou Province Hospital of Chinese People’s Armed Police Forces, Guiyang 550005, China
Objective To study whether or not there is protective effect of sodium selenite on T lymphocytes of heroin addicts, and if it correlates with mitochondrial uncoupling related indicators. Methods T lymphocytes extracted from peripheral blood of people who abuse heroin in different periods. Cell proliferation was detected by MTT, the levels of ROS,△Ψm were detected by fluorescence spectrophotometer, MPTP was measured by ultraviolet spectrophotometer. Results With the increased duration of heroin-abuse, T lymphocyte proliferation activity decreased significantly(P<0.05); T lymphocyte mitochondrial MPTP increased, △Ψm decreased, ROS increased(P<0.05). Sodium selenite can reverse these changes,and there is a dose-effect relationship(P<0.05). Conclusions Oxidative stress caused by prolonged heroin abuse has an adverse effect on the function and proliferation of T lymphocytesviathe mitochondrial pathway. Sodium selenite has a protective effect on T lymphocytes by its antioxidant effect, which reduces the level of ROS to reverse the above process.
sodium selenite; T lymphocytes; mitochondria; mitochondrial permeability transition pore; reactive oxygen species; mitochondrial membrane potential
贵州省科技术基金项目(黔科合J字[2012]2322号)
付青梅,本科学历,主任医师,E-mail:fqmdyx@163.com
550005贵阳,武警贵州总队医院
张永春,E-mail: anshunzyc@hotmail.com
R392.12
