阻塞性睡眠呼吸暂停低通气综合征对骨组织的影响
2015-03-24段智娟李园园
段智娟,李园园,朱 旭,杨 芸
论 著
阻塞性睡眠呼吸暂停低通气综合征对骨组织的影响
段智娟,李园园,朱 旭,杨 芸
目的 通过比较阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome ,OSAHS)患者与单纯鼾症者的骨密度(bone mineral density ,BMD),探讨OSAHS对骨组织的影响。方法 选取126例男性鼾症患者,行多导睡眠监测(poly somno graphy ,PSG),根据呼吸暂停低通气指数(apnea hypopnea index ,AHI),分为单纯鼾症组(32例)、轻度OSAHS组(29例)、中度OSAHS组(35例)、重度OSAHS组(30例),采用双能X线吸收法(DXA)测定所有个体的部位BMD和T-BMD(T-BMD),分别将轻、中、重OSAHS组与单纯鼾症组比较。结果 重度OSAHS组各部位BMD(P:0.006-0.045)和T-BMD(P=0.037)均低于单纯鼾症组和轻度OSAHS组,差异有统计学意义;重度OSAHS组的L1-4整体BMD测量值均低于单纯鼾症组(P=0.008)和轻度OSAHS组(P=0.026),差异具有统计学意义;中度OSAHS组和重度OSAHS组的T-BMD测量值均明显低于单纯鼾症组(P=0.002和P=0.000),差异具有统计学意义; 126例AHI和T-BMD行相关和回归分析,AHI与T-BMD呈高度负相关(r=-0.283),经F显著性检验,F=10.831,P=0.001;差异具有统计学意义。结论 OSAHS是骨质疏松的危险因素,随着病情加重,BMD逐渐下降。
阻塞性睡眠呼吸暂停低通气综合征;骨密度;骨质疏松
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome ,OSAHS)和骨质疏松症均是威胁老年人身体健康的常见疾病。OSAHS所引起的反复间歇性缺氧、氧化应激和相关炎性反应因子,均能影响骨细胞功能并可成为骨质疏松的危险因素[1,2]。进一步研究发现,经过连续3个月持续气道正压通气(continuous positive airway pressure,CPAP)治疗后,相关炎性反应因子明显下降,同时骨代谢可明显改善[3]。目前,BMD测量是诊断骨质疏松症的主要定量依据,数字化双能X线吸收法(digital dual-energy X-ray absorptiometry ,DXA)是国际学术界公认的BMD检查方法,其测定值已被公认为骨质疏松症诊断的“金标准”。本研究采用DXA测定OSAHS患者BMD,旨在探讨OSAHS对骨组织代谢的影响。
1 对象与方法
1.1 对象 选择2011-02至2012-02在我院耳鼻喉科住院的鼾症患者126例,均为男性。排除标准:(1)慢性肝、肾、心功能不全、甲状腺和甲状旁腺功能异常、生长激素缺乏、Cushing综合征、慢性胃肠疾病、骨关节病、血液系统肿瘤、肿瘤骨转移或骨肿瘤、有腰椎或髋部骨折史及各种遗传性、体质性骨病等;(2)服用影响骨代谢药物者,包括类固醇激素、雌激素、利尿药、抗惊厥药、甲状旁腺激素、维生素D类、降钙素、氟化物、二磷酸盐等;(3)长期使用骨质疏松治疗药物者。
1.2 分组 根据2011年中华医学会呼吸病学分会阻塞性睡眠呼吸暂停低通气诊治指南[4],行多导睡眠呼吸监测。睡眠监测提示每晚睡眠过程中(7 h)呼吸暂停及低通气反复发作30次以上或AHI≥5次/h,且以阻塞性呼吸事件为主,即可诊断为OSAHS。轻度:AHI 5~15次/h,夜间最低血氧饱和度85%~89%;中度:AHI>15~30次/h,夜间最低血氧饱和度80%~84%;重度:AHI>30次/h, 夜间最低血氧饱和度<80%。根据AHI分数分为:单纯鼾症组32例,年龄40~71岁,平均(53.59±12.30)岁;轻度OSAHS组29例,年龄41~68岁,平均(54.28±10.24)岁;中度OSAHS组35例,年龄45~72岁,平均(52.17±11.39)岁;重度OSAHS组30例,年龄39~73岁,平均(54.30±12.74)岁。各组间年龄、性别、体重指数、饮食习惯、周有氧运动时间、不良嗜好差异均无统计学意义,具有可比性。
1.3 方法
1.3.1 睡眠呼吸监测 采用北京怡和嘉业技术研究中心生产的“YH-1000多导睡眠记录器”。检查前受试者不得服用对睡眠有影响的药物,检查当天不饮用酒、浓茶、咖啡及兴奋性饮料,不得服用安眠类药物,2周内无呼吸道感染,于晚11:00时起进行不少于7 h睡眠呼吸检查。监测结果由计算机自动分析后,进行人工分析校正。
1.3.2 BMD测定设备 采用美国GE公司生产的“Lunar Prodigy”型双能X线BMD分析仪。分别测量腰椎前后位L1-4及其整体(L1、L2、L3、L4、L1-4)、左侧股骨近端包括左侧股骨颈(FN)、Ward三角、大粗隆(GT)、左髋部总体(T-hip)的部位BMD和T-BMD,记录相关数据。
1.4 统计学处理 采用SPSS19.0软件进行数据处理。所有计量资料经正态性检验,组间比较采用独立样本t检验,各变量间相关分析采用Pearson相关分析。计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 各部位BMD和T-BMD比较 轻度OSAHS组与单纯鼾症组相比,各部位BMD和T-BMD均无统计学意义;中度OSAHS组与单纯鼾症组骨密度相比,中度OSAHS组L1、L2、T-hip、FN及GT的BMD测量值低于单纯鼾症组,差异具有统计学意义(P<0.05),而其他部位骨密度无统计学意义,重度OSAHS组各部位BMD和T-BMD均低于单纯鼾症组,差异具有统计学意义(P<0.05)。其中,L2和GT的BMD测量值与单纯鼾症组相比,差异有统计学意义(P<0.01,表1)。

表1 单纯鼾症组分别与轻、中、重度OSAHS组骨密度(BMD)测量结果的比较
2.2 各组 L1-4BMD和T-BMD对比 L1-4BMD和T-BMD对比两个点在单纯鼾症组、轻度、中度、重度OSAHS组间进行F检验, 单纯鼾症组、轻、中、重度OSAHS组L1- L4BMD组间测量结果的比较F=2.853,P=0.040,四组间均数的差异有统计学意义(P<0.05)。两两比较:重度OSAHS组L1-4BMD低于轻度OSAHS组(P=0.026);重度OSAHS组L1-4BMD明显低于单纯鼾症组(P=0.008,表2)。
单纯鼾症组、轻、中、重度OSAHS组T-BMD组间测量结果比较,F=6.037,P=0.001,四组间均数的差异有统计学意义,做两两比较:重度OSAHS组T-BMD低于轻度OSAHS组(P=0.019),中度OSAHS组T-BMD明显低于单纯鼾症组(P=0.002);重度OSAHS组T-BMD明显低于单纯鼾症组(P=0.000,表3)。
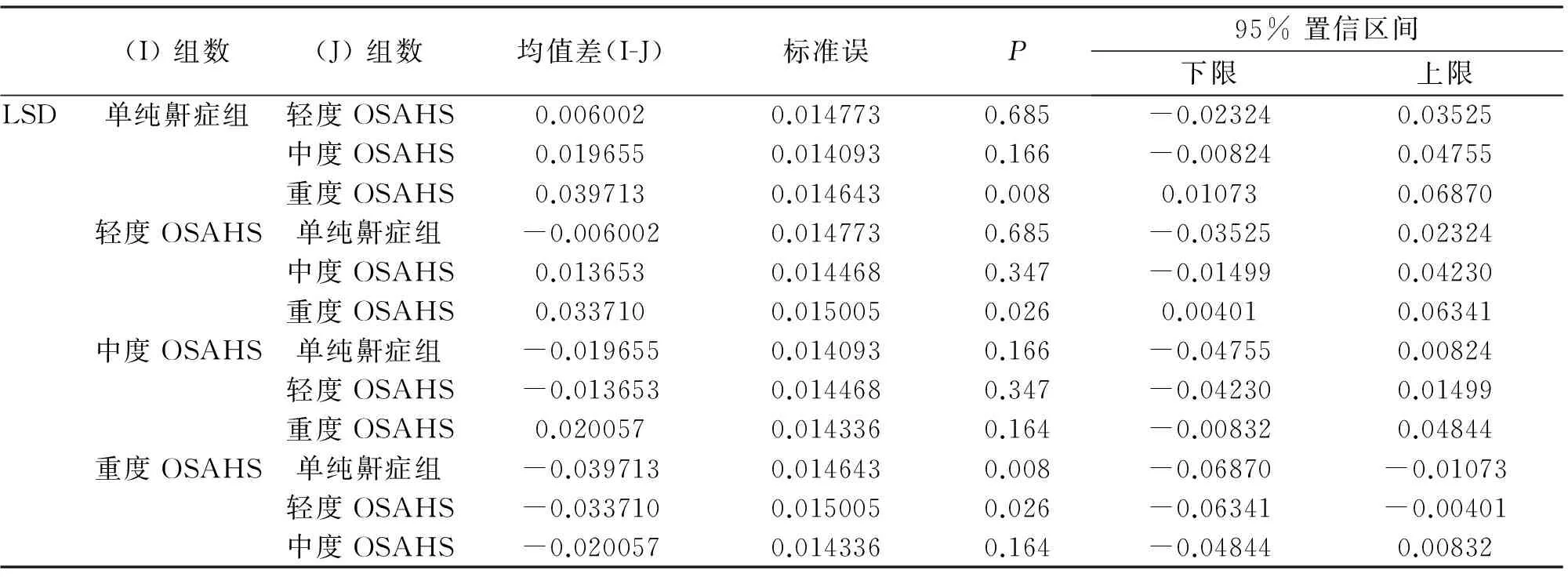
表2 单纯鼾症组、轻、中、重度OSAHS组L1-4BMD组间测量结果的比较

表3 单纯鼾症组、轻、中、重度OSAHS组T-BMD组间测量结果的比较
2.3 回归分析 AHI和T-BMD行相关回归分析,双侧 Pearson 检验,差异有统计学意义(P<0.01,r=-0.283),低通气指数与T-BMD度呈高度负相关,经F显著性检验,差异有统计学意义(P<0.01,F=10.831),回归方程为 Y(T-BMD)=1.172-0.001X (低通气指数)。
3 讨 论
骨质疏松症是一种以骨量低下、骨量结构破坏、导致骨脆性增加,易发生骨折为特征的全身性骨病。目前,全世界约有2亿骨质疏松患者,且患病率呈逐年增加趋势[5]。因此,如何早期诊治,预防骨质疏松发生,减少致残,已成为广泛关注的社会问题。随着对OSAHS认识程度逐渐加深,研究发现OSAHS不仅对患者呼吸、循环、血液等系统有严重影响,并且此疾病反复的睡眠片段化和慢性间歇低氧引发的低氧血症、交感神经活性增强、氧化应激和炎性反应等多因素均可以不同程度、不同环节的导致骨代谢异常。
关于OSAHS引起骨代谢异常及骨密度下降的病理机制尚不明确,可能通过以下途径影响骨组织。OSAHS患者夜间反复发生上气道阻塞、呼吸暂停及睡眠节律紊乱所致的低氧血症可直接影响骨组织的功能[6]。现已发现缺氧可明显抑制成骨细胞增殖,使骨源性碱性磷酸酶(反映成骨细胞的活性或功能状况的成骨细胞表型标志物)活性及矿化结节形成数量明显降低,从而导致骨形成受阻,并且缺氧促进成骨细胞凋亡。在抑制成骨细胞代谢的同时,缺氧还引起破骨细胞的形成并增强其吸收活性[7]。临床上与缺氧相关的疾病,如贫血症、COPD等,已多次被证实与骨量减少有关[8],通过治疗改善COPD患者的肺功能及纠正贫血后,可延缓或减少骨量丢失[9]。
本研究通过测定不同程度的OSAHS患者BMD,在平衡了性别、年龄、体重指数、饮食习惯、周有氧运动时间等干扰因素下,与单纯鼾症组比较发现,重度OSAHS组各部位T-BMD均低于单纯鼾症组,差异有统计学意义(P<0.05);中度OSAHS组L1、L2、T-hip、FN及GT的BMD测量值低于单纯鼾症组,差异具有统计学意义(P<0.05)。随机选取L1-4BMD和T-BMD两个点在单纯鼾症组、轻度、中度、重度OSAHS组间进行F检验及组间两两比较显示:重度OSAHS组BMD值均低于单纯鼾症组和轻度OSAHS组,中度OSAHS组BMD值低于单纯鼾症组。126例AHI和T-BMD行相关和回归分析表明,低通气指数与T-BMD呈高度负相关(r=-0.283)。本研究结果证实,OSAHS是骨质疏松症的危险因素,并且随着病情加重,OSAHS患者各部位的BMD逐渐下降。
需要注意的是,OSAHS所引起的缺氧不完全同于COPD所致的长期慢性持续性缺氧,而是表现为睡眠状态下反复的间歇性缺氧,缺氧和复氧反复发作可出现氧化应激和相关炎性反应因子,会导致机体骨代谢产生比持续缺氧更不利的影响[10],这种氧饱和度的反复变化类似于缺血再灌注损伤,产生过多的过氧化物,最终会导致氧化应激的发生[11]。Mdoy等[12]研究发现,氧化应激能抑制骨髓基质细胞系M2-10B4及成骨细胞前体细胞系MC3T3-E1的分化,同时能诱导成骨细胞的死亡;另外,破骨细胞和氧化应激之间的关系则更为密切,Yang等[13]认为,活性氧自由基可以氧化钙结合位点以及酸化破骨细胞周围的微环境,引起骨代谢异常,导致骨量减少或骨质疏松的发生、发展。
综上所述,通过测定OSAHS患者骨密度并与单纯鼾症者相比,中重度OSAHS患者BMD水平明显下降,且随着病情的加重,骨量流失增加,表明OSAHS是骨质疏松的危险因素之一。在临床工作中,应该对中重度OSAHS患者常规行BMD检查,对已发生骨量减少或骨质疏松的患者,需要规范补钙、补充维生素D及其他抗骨质疏松治疗,同时积极进行CPAP治疗,快速改善患者的缺氧状态,不断改善患者的生活质量。
[1] Papaioannou A, Parkinson W, Ferko N,etal. Prevalence of vertebral fractures among patients with chronic obstructive pulmonary disease in Canada[J]. Osteoporos Int, 2003, 14:913-917.
[2] Raisz L G. Pathogenesis of osteoporosis: concepts, conflicts, and prospects [J]. Clin Invest, 2005,115:3318-3325.
[3] Seifart C,Dempfle A,Plagens A,etal. TNF-alpha,TNF-beta,IL-6,and IL-10 promoter polymorphisms in patient’s with chronic obstructive pulmonary disease[J]. Tissue Antigens, 2005,65:93-100.
[4] 中华医学会呼吸病分会睡眠呼吸病学组.中华医学会糖尿病学分会.阻塞性睡眠呼吸暂停与糖尿病专家共识[J]. 中华结核和呼吸杂志, 2010,33(6):326-330.
[5] Reginster J Y, Burlet N. Osteoporosis: a still increasing prevalence[J]. Bone, 2011, 38(2):4-9.
[6] Arnett T R, Gibbons D C, Utting J C,etal. Hypoxia is a major stimulator of osteoclast formation and bone resorption[J].Cell Physiol,2013,196:2-8.
[7] 顾九军,刘兴炎,盛俊东,等,缺氧对大鼠成骨细胞增殖及凋亡的影响[J].临床军医杂志, 2007, 35(2):171-173.
[8] Papaioannou A, Parkinson W, Ferko N,etal. Prevalence of vertebral fractures among patients with chronic obstructive pulmonary disease in Canada[J].Osteoporos Int, 2009, 14:913-917.
[9] Ionescu A A, Schoon E. Osteoporosis in chronic obstructive pulmonary disease[J].Eur Respir Suppl,2010,46:64-75.
[10] Ryan S, Taylor C T, McNicholas W T. Selective activation of inflammatory pathways by intermittent hypoxia in obstructive sleep apnea syndrome[J].Circulation, 2005,112:2660-2667.
[11] Yamauchi M, Kimura H. Oxidative stress in obstructive sleep apnea: putative pathways to the cardiovascular complications[J].Antioxid Redom Signal,2008,10(4):755-768.
[12] Mody N, Parhami F, Sarafian TA,etal. Oxidative stress modulates osteoblastie differentiation of vaseular and bone cells[J].Free Radie Biol Med,2011, 31(4):509-519.
[13] Yang S, Madyastha P, Bingel S,etal. A new superoxide-generating oxidase in murine osteoclasts[J].Biol Chem,2009, 276(8):5452-5458.
(2015-01-05收稿 2015-04-10修回)
(责任编辑 郭 青)
A clinical study of bone mineral density in patients with obstructive sleep apnea hypopnea syndrome
DUAN Zhijuan,LI Yuanyuan, ZHU Xu,and YANG Yun.
Department of soldier, Yunnan Provincial Crops Hospital, Chinese People’s Armed Police Forces, Kunming 650111, China
Objective To study the impact of obstructive sleep apnea hypopnea syndrome(OSAHS) on bone issue. We compared the bone mineral density (BMD) between the patients with OSAHS and those who are simply snoring patients. Methods 126 male snoring patients are underwent the polysomnography(PSG). According to the apnea hypopnea index (AHI),they were divided into snoring group (32 cases),mild OSAHS group (29 cases), moderate OSAHS group(35 cases),and severe OSAHS group (30 cases); part BMD and total body BMD were determed. We compared mild, moderate and severe OSAHS groups with the simply snoring group, respectively. Results 1. Part BMD and total body BMD in the severe OSAHS group were lower than those in the snoring group, and the difference was statistically significant(P<0.05). 2. Part BMD in the moderate OSAHS group was lower than in the snoring group,and the difference was statistically significant (P<0.05). 3.Comparing mild OSAHS group with the snoring group, there was no significant difference(P>0.05). Conclusion OSAHS is a risk factor of osteoporosis. The BMD in OSAHS patients decreases gradually with the aggravating of the illness.
obstructive sleep apnea-hypopnea syndrome;bone mineral density;osteoporosis
段智娟,硕士,主治医师,E-mail: jackychen123a@163.com
650111 昆明,武警云南总队医院军人病区
朱 旭,E-mail:wjzhuxu@126.com
R58.1
