一种新型硫杂杯[4]芳烃冠醚衍生物的合成与配合性能
2015-03-23杨发福
赵 夏, 杨发福
(1.银川能源学院 石油化工系, 银川 750105; 2.福建师范大学 化学与材料学院, 福州 350007)
一种新型硫杂杯[4]芳烃冠醚衍生物的合成与配合性能
赵 夏1*, 杨发福2
(1.银川能源学院 石油化工系, 银川 750105; 2.福建师范大学 化学与材料学院, 福州 350007)
在普通杯芳烃中引入硫、氮原子可以改善普通杯芳烃的配合性能.在弱酸的催化下,使用硫杂杯[4]芳烃四酰肼衍生物3与芳醛衍生物4反应, 高产率地合成了新型的含酰胺和席夫碱单元的硫杂杯[4]芳烃冠醚衍生物5,所合成的新化合物的结构经1H NMR、元素分析、ESI-MS等证实.同时探讨了新型硫杂杯[4]芳烃衍生物5与系列α-氨基酸的配合性能,结果表明所合成的硫杂杯芳烃冠醚对氨基酸分子表现出有效的配合能力和选择性.
硫杂杯[4]芳烃; 合成; 冠醚; 氨基酸
基于杯芳烃衍生物在化学传感器、色谱分离、客体识别、材料科学和生物化学等领域的应用,以杯芳烃为平台构筑的新型主体分子一直颇受关注[1-6].目前一个新的研究方向是用S、N、P等杂原子代替杯芳烃主体骨架中的亚甲基形成性能更为优良的杂环杯芳烃[7-8].在杯芳烃上缘和下缘引入官能团后所产生的各类杯芳烃衍生物中,杯芳烃冠醚是最令人瞩目的一类.众所周知,冠醚是研究起步较早的第一代主体分子,冠醚作为催化剂及载体在工业中的应用研究也较为成熟[9].基于此,文中首先在杯芳烃的骨架中引入S原子,合成了硫杂杯[4]芳烃,然后在硫杂杯[4]芳烃下缘引入冠醚官能团,得到的硫杂杯芳冠醚不仅仅是冠醚与硫杂杯芳烃的简单结合,两类单元之间还存在相互协同作用,充分发挥了二者的优势,使其对客体的识别能力大大优越于普通杯芳烃和冠醚.通过氨基酸萃取实验探讨了硫杂杯[4]衍生物5对于氨基酸的配合性能.由于其桥联基团是柔性的冠醚链,其空腔大小具有一定弹性,同时在配合过程中,杯芳烃骨架中硫原子参与,使得所合成的硫杂杯芳烃冠醚对氨基酸分子表现出有效的配合能力和选择性[10].合成路线如图1所示.
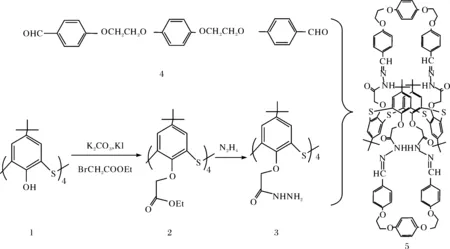
图1 化合物5的合成路线
1 实验部分
1.1 仪器与试剂
1.1.1 仪器 Bruker-ARX500(500M Hz)型核磁共振仪(CDCl3作溶剂,TMS为内标);Varian紫外光谱仪;Vario EL III 自动元素分析仪;Reichert 7905熔点仪(温度未校正);DECAX-30000 LCQ Deca XP ESI-MS质谱仪(甲醇作溶剂).
1.1.2 主要化学试剂的制备与纯化 吡啶:分析纯,加KOH回流8 h,收集115.5oC的馏分;碳酸钠:500oC高温活化后使用;水合肼重蒸后使用;所使用的其他试剂均为分析纯.
1.2 实验部分
1.2.1 硫杂杯[4]芳烃四乙酸乙酯衍生物2的合成 加入50 mL无水丙酮、1.5 g(2 mmol)硫杂杯[4]芳烃、1 mL溴乙酸乙酯、0.8 g碘化钾、3.0 g碳酸钾于100 mL的二口瓶中,通入氮气保护,搅拌回流14 h,TLC检测原料消失.减压蒸馏至溶剂剩余5 mL左右,加入30 mL氯仿溶解,后加入30 mL10%的HCl,使用分液漏斗分出有机层,加入20 mL蒸馏水萃取,分离出有机层.用无水MgSO4干燥,过滤后减压浓缩至5~6 mL,加入适量无水乙醇析出沉淀.过滤,烘干后得白色粉末1.7 g, 为硫杂杯[4]芳烃四乙酸乙酯衍生物2,产率80%.1H NMR (500 MHz, CDCl3)δ: 1.09 (s, 36H, C(CH3)3), 1.29 (t, 12H,J=7.0 Hz, C2H5), 4.23 (q, 8H,J=7.0 Hz, C2H5), 5.18 (s, 8H, OCH2O), 7.31 (s, 8H, PhH); MSm/z(%): 1087.6 (MNa+, 100); Anal. calcd for C56H72O12S4∶C 63.14, H 6.71, found C 63.16, H 6.77.
1.2.2 硫杂杯[4]芳烃四乙酰肼衍生物3的合成 加入40 mL甲苯和甲醇的混合物(体积比为1∶1)、1 mL水合肼(含量80%)、1.07 g(1 mmol)硫杂杯[4]芳烃四乙酸乙酯衍生物2于三口瓶中,通入氮气保护,搅拌回流14 h.TCL检测原料点消失,减压蒸馏至溶剂剩余5 mL左右,加入少量蒸馏水,析出沉淀.过滤,沉淀用甲醇和水重结晶得白色晶体,为杯[4]芳烃二酰肼衍生物3,共0.86 g, 产率 86%.m.p.210~212oC, IR(KBr): 3416.14(N-H), 1679.91 (C=O), 1432.45(C-N) cm-1;1H NMR (500 MHz, CDCl3)δ: 1.29 (s, 36H, C(CH3)3), 4.61 (s, 8H, OCH2O), 3.51 (bs, 8H, NH2), 7.41 (bs, 4H, NHCO), 7.45 (s, 8H, PhH); MSm/z(%): 1031.7 (MNa+, 100); Anal. calcd for C48H64N8O8S4∶C 57.11, H 6.32, N 11.08; found C 57.14, H 6.40, N 11.11.
1.2.3 新型含冠醚的硫杂杯[4]衍生物5的合成 在氮气保护下,将1.95 g(4.8 mmol)的化合物4和2.06 g(2 mmol)的化合物3溶于40 mL氯仿/甲醇(体积比1∶1)的溶液中,再加入5滴冰醋酸,搅拌回流30 h.TLC检测原料反应完毕,减压蒸出大部分溶剂,加入适量甲醇,在冰箱中放置过夜使沉淀充分析出.过滤出沉淀,使用适量甲醇洗涤三次,干燥,得化合物5,共3.2 g,产率为91%.m.p. 221~223℃;1H NMR (500 MHz, CDCl3)δ: 1.08 (s, 36H, C(CH3)3), 3.12 (bs, 4H, NH), 3.89 (m, 16H, OCH2CH2O), 4.81 (s, 8H, ArOCH2), 6.23~8.16 (m, 32H, ArH), 9.64 (s, 4H,-CH=N); MSm/z(%): 1749.9 (M+, 100); Anal. calcd for C96H100N8O16S4∶C 65.84, H 5.57, N 6.21; found C 65.90, H 5.72, N 6.41.
1.2.4 硫杂杯芳烃衍生物5对氨基酸的萃取实验 用硫杂杯[4]衍生物5和氯仿配制成5×10-4mol/L的氯仿溶液,氨基酸加入蒸馏水配成5×10-4mol/L的水溶液.取上述溶液各4 mL,加入具塞的磨口10 mL试管中,剧烈震荡3 h,放置24 h后,用注射器取2 mL上层溶液和2 mL茚三酮于试管中混合均匀,在100℃水浴中加热10 min.冷却后稀释定容到10 mL,用紫外分光光度计测定558 nm左右处的透光率T,根据Lamber-Beer定律式(1)计算出溶液中萃取率R.
A=-lgT,
R=(A0-A)/A0,
(1)
式中,A是被硫杂杯[4]衍生物5萃取后氨基酸水溶液的吸光度,A0是未被萃取前氨基酸水溶液的吸光度.
2 结果与结论
在合成衍生物2时,采用溴乙酸乙酸与硫杂杯[4]芳烃反应,主要生成的是四取代产物,使用氯乙酸乙酯反应得到的主产物是三取代衍生物,后来又通过改变试验条件来对比产物,发现无论条件如何改变,采用溴乙酸乙酸反应时,其主产物是四取代产物,而采用氯乙酸乙酯反应得到的主产物是三取代产物,这说明溴乙酸乙酯和氯乙酸乙酯的活性不同.化合物5的合成过程中,使用氯仿/甲醇(体积比1∶1)的溶剂主要作用是可以同时让化合物3和化合物4较好的溶解,冰醋酸作为催化剂,可以加快反应速度,反应的产率也较高.
所合成的新化合物均经元素分析、1H NMR谱、质谱分析证明它们为图1中所示的结构.衍生物2,3,5的谱图中均出现丰度100的分子离子基峰.在化合物2和化合物3的核磁谱图中叔丁基分裂为1∶1的两个单峰,说明其结构为1,3-交替取代且采取锥式构象.而化合物5中没有桥连亚甲基,杯芳烃骨架里的ArH和桥联官能团中的ArH信号交叠,吸收峰较多,无法判断它们的分裂方式,因此难以推测它们采取的具体构象.
在杯芳烃中引入桥联硫原子以代替原来的桥联亚甲基,可以增加新的配位作用位点.未经修饰的母体硫杂杯芳烃分子的构象活动多变,在大多数溶剂中的溶解性很差,络合客体的能力也比较弱.对其上缘或下缘进行修饰后,其在有机溶剂中的溶解性大大提高,在水中也具有一定的溶解度,同时对客体的选择配合能力也大幅度提高.文中在硫杂杯芳烃的下缘引入含氮杂原子的冠醚官能团,多种官能团和杯芳烃骨架中的硫原子发生协同配合作用,使化合物5对氨基酸产生良好的配合性能.其萃取试验结果如图2所示.从图2可以看出硫杂杯[4]衍生物5对氨基酸的配合试验中选择性较强.硫杂杯[4]衍生物5对脂肪族氨基酸的萃取率比较高,而对芳香族的氨基酸萃取率较差,尤其是新化合物对苏氨酸的萃取率高达67%.推测其原因是苏氨酸分子内具有羟基,而羟基与硫杂杯[4]衍生物5分子中的羟基能形成分子间氢键,同时硫杂杯[4]衍生物5所形成的空腔的大小与苏氨酸的体积相似,因此硫杂杯[4]衍生物5对苏氨酸表现出较好的萃取选择性,苏氨酸/色氨酸最高选择性可达到14.1.
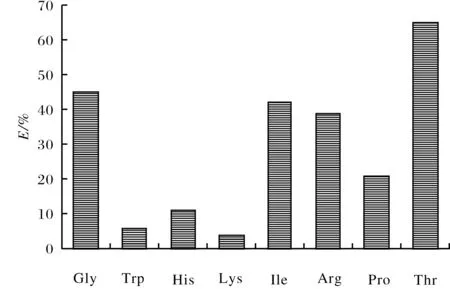
图2 化合物5对氨基酸的百分萃取率
[1] Kumar Manoj,Kumar Rajesh,Bhalla Vandana,et a1. Thiacalix[4]arene based fluorescent probe for sensing and imaging of Fe3+ions [J]. Dalton Transactions, 2012, 41(2):408-412.
[2] 顾金英, 朱明莉, 施宪法. 治疗铜中毒的新型高效络合剂对叔丁基硫杂杯[4]芳烃[J].高等学校化学学报, 2012, 33(10):2229-2234.
[3] Gupta Vinod Kumar, Sethi B, Sharma R A, et a1. Mercury selective potentiometric sensor based on low rim functionalized thiacalix [4]-arene as a cationic receptor[J]. Journal of Molecular Liquids, 2013, 177: 114-118.
[4] Torgov V G, Us T V, Korda T M, et a1. Extraction of palladium with thiacalix[4]arenes from nitric acid nitrate-nitrite solutions[J]. Russian Journal of Inorganic Chemistry, 2012, 57(12):1621-1629.
[5] 田德美, 李海兵. 糖杯芳烃基因载体GGC[4]的合成及性能研究[J].华中师范大学学报:自然科学版, 2007, 41(4):574-577.
[6] 叶汉英, 林 琳, 吴采樱. 杯[4]芳烃聚硅氧烷分子识别热力学特性研究[J]. 湖北大学学报:自然科学版, 2002, 24(4):338-341.
[7] Tabakci M,Memon S,Yilmaz M,et a1. Synthesis and evaluation of extraction ability of calix[4]-crown-6 cone conformer and its oligomeric analogue[J].Peactive & Functional Polym, 2004, 58(1):27-34.
[8] Narumi F,Hattori T,Matsumura N,et a1. Synthesis of an inherently ehiral O-bridged thiacallx[4]crown carboxylic acid and its application to a chiral solvating agent [J]. Tetrahedron, 2004, 60(36):7827-7833.
[9] 杨发福, 陈远荫. 大环杯芳烃冠醚的研究现状与展望[J].合成化学, 2003, 11(3): 203-208.
[10] 赵 夏. 新型杯芳烃氮、硫杂衍生物的合成与性能研究[D].福州: 福建师范大学, 2007.
Synthesis and characterization of novel thiacalix[4] crowns derivatives
ZHAO Xia1, YANG Fafu2
(1.Department of Petrochemical Engineering, Yinchuan Energy Institute, Yinchuan 750105;2.College of Chemistry and Materials, Fujian Normal University, Fuzhou 350007)
The performance of ordinary calixarene can be improved with introducing of sulfur, nitrogen atom. Treatment of thiacalix[4]arene hydrazides derivative 3 with aryl aldehyde derivatives 4, the novel thiacalix[4]crowns derivatives 5 containing amides and schiff-base units were synthesized in high yields with the weak acid catalyst. The new compounds were characterized by elemental analyses, ESI-MS,1H NMR spectra. At the same time, we studied the coordination properties of novel thiacalix [4]arene derivatives 5 and series of alpha amino acids.The results showed that the thiacalixarene crown have an effective coordination ability and selectivity on amino acids.
thiacalix[4]arene; synthesis; crown ethers; amino acids
2014-10-08.
国家自然科学基金项目(20402002); 福建省自然科学基金项目(E0220002, 2009J019); 银川能源学院科学研究资助项目(2013-KY-Z-05).
1000-1190(2015)01-0083-04
O623
A
*通讯联系人. E-mail: zhaoxia19831982@126.com.
