褐飞虱核糖体蛋白S6激酶基因NlRPS6KA2的克隆及其表达分析
2015-03-23陆潮峰郝培应俞晓平
陆潮峰,郝培应,俞晓平
(中国计量学院 生命科学学院,浙江省生物计量及检验检疫技术重点实验室,浙江 杭州 310018)
褐飞虱核糖体蛋白S6激酶基因NlRPS6KA2的克隆及其表达分析
陆潮峰,郝培应,俞晓平
(中国计量学院 生命科学学院,浙江省生物计量及检验检疫技术重点实验室,浙江 杭州 310018)
根据转录组提供的RPS6KA2核心序列信息,应用RACE技术获得了一个编码褐飞虱核糖体蛋白S6激酶的基因NlRPS6KA2的全长cDNA,编码的蛋白含706个氨基酸,具有保守的S_TKc和S_TK_X结构域.荧光定量PCR测定结果表明,NlRPS6KA2基因在褐飞虱若虫和雄虫中表达量均较低,但在怀卵雌虫中大量表达.同时,褐飞虱从感性水稻品种TN1到抗性水稻品种RHT的适应过程中,该基因表达量呈现明显的下降趋势,在适应后有所回升.研究结果为进一步研究NlRPS6KA2基因在褐飞虱中的功能和阐明褐飞虱致害性变异机制提供了依据.
褐飞虱;NlRPS6KA2基因;荧光定量PCR;致害性变异
褐飞虱NilaparvatalugensStål(Hemiptera: Delphacidae)以水稻为食,严重威胁亚洲国家的水稻产量[1-2].褐飞虱不仅能吸食水稻韧皮部中的营养导致水稻枯萎,严重时还会产生虱烧;褐飞虱会传播病毒导致水稻减产,如草状矮缩病、齿叶矮缩病等;同时,褐飞虱产卵会破坏水稻疏导组织导致水分流失[3-4].目前,种植抗性水稻品种作为一种防治褐飞虱的有效手段已被广泛推广应用[5],但持续大规模种植带来了褐飞虱致害性变异的问题,导致抗性水稻品种抗性失效[6].因此,研究褐飞虱如何适应抗性水稻对阐明褐飞虱致害性变异机制至关重要.
胰岛素信号通路在生物体中的作用保守且非常重要,能调节细胞的生长、代谢、分裂、分化以及细胞寿命等,还能调节生物体中蛋白质和脂类等的新陈代谢[7-10].该通路被证实能调控昆虫器官的大小、细胞大小及生长、激活蜕化类固醇生产等[11-13].TATAR[14]研究发现,该通路在受到抑制时能够使果蝇生长发育受到影响,使其体型变小,卵巢发育推迟和寿命延长.TELEMAN[15]研究发现该通路受到抑制时会使果蝇体重降低或引起死亡.在蚊子中,SIM和DENLINGER[16]发现该通路受到抑制时能使蚊子的初级卵泡停止发育,使蚊子处于类似于滞育的状态.这些研究说明,在胰岛素信号通路受到抑制时昆虫的生长和发育也受到抑制,同时能导致死亡.在前期研究中发现,当褐飞虱从感性水稻品种TN1(Taichung native 1)到抗性水稻品种Rathu Heenati(RHT)上时,褐飞虱的生长发育受到抑制,具体表现在生物量合成减少、生长缓慢和存活率降低[17].因此,我们推测胰岛素信号通路与褐飞虱致害性变异间有可能存在着某些联系,该通路的研究对阐明褐飞虱致害性变异会有所帮助.
本研究通过分析课题组前期获得的褐飞虱转录组数据,经RACE法克隆全长得到一个编码核糖体蛋白S6激酶的基因,Blast发现该基因为RPS6KA2,命名为NlRPS6KA2(KP890676);
通过荧光定量PCR测定NlRPS6KA2在褐飞虱不同龄期和不同性别中的表达,分析NlRPS6KA2在褐飞虱生长发育过程中的作用.研究结果为进一步研究NlRPS6KA2基因在褐飞虱中的功能奠定了基础.
1 材料和方法
1.1 供试褐飞虱
供试褐飞虱采集于浙江省杭州稻田(30°N,120°E),种群分别在感虫水稻品种TN1和抗性水稻品种RHT上连续饲养50代以上,恒温室饲养温度(26±2)℃,相对湿度为(80±5)%,光周期为16 L:8 D.本研究饲养了7个褐飞虱种群用于相关实验:Tn表示长期饲养在TN1上的褐飞虱;RF1表示从TN1转移到RHT上的第1代褐飞虱;RF2表示第2代;RF3表示第3代;RF4表示第4代;RF5表示第5代;Rh表示长期饲养在RHT上的褐飞虱.
1.2 褐飞虱NlRPS6KA2基因的克隆
根据前期褐飞虱转录组序列信息获得一个编码核糖体蛋白S6激酶的基因RPS6KA2基因核心序列信息,命名为NlRPS6KA2,并采用RACE法克隆基因全长.分别设计外引物5O-RPS6KA2和3O-RPS6KA2(表1),以及内引物5I-RPS6KA2和3I-RPS6KA2(表1).用Trizol法提取褐飞虱的总RNA,根据BD SMARTTMRACE cDNA Amplification Kit(Clontech, USA)试剂盒说明书合成5′-RACE和3′-RACE的模板.采用巢式PCR对目的基因的2端进行扩增,反应体系50 μL: PCR Mix 25 μL,10 μmol/L正反引物各2 μL,模板2 μL,ddH2O 19 μL.外围PCR反应条件:94 ℃ 4 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 3 min,30个循环;72 ℃ 10 min;4 ℃保存.内围PCR所用的模板为第一轮PCR得到的产物.内围PCR反应条件:94 ℃ 4 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 3 min,30个循环;72 ℃ 10 min;4 ℃保存.PCR扩增得到的产物经1%琼脂糖凝胶电泳检测,割胶回收,连接到PMD-18T(TaKaRa, Japan),转化到JM109感受态细胞中,PCR鉴定阳性克隆菌株送到上海桑尼生物科技有限公司测序.测序结果用DNAMAN软件和原序列比对验证.

表1 基因克隆和荧光定量PCR的引物
1.3 褐飞虱NlRPS6KA2基因表达分析
分别对上述所提到7个种群褐飞虱按照1-2龄若虫、3-4龄若虫、5龄若虫、初羽化雌成虫、怀卵雌成虫、雄成虫等进行分别取样,用荧光定量PCR进行NlRPS6KA2基因表达量分析.用Trizol法提取总RNA,用PrimeScript RT Reagent Kit with gDNA Eraser(Takara, Japan)反转录试剂盒合成用于荧光定量PCR的cDNA模板.荧光定量PCR特异性引物为QRPS6KA2-F和QRPS6KA2-R(表1),荧光片段经过测序和原序列比对,以β-actin基因为内参[18],以1~2龄的Tn褐飞虱种群的NlRPS6KA2基因表达量为参照,检测NlRPS6KA2基因在不同褐飞虱种群的相对表达量.荧光定量PCR参考马艳等[19]的反应体系及方法,其中退火温度改为51 ℃.
2 结果与分析
2.1 褐飞虱NlRPS6KA2基因的cDNA全长克隆及序列分析
根据所得到的5端和3端测序结果,用DNAMAN进行序列拼接得到NlRPS6KA2基因全长为2491 bp,该基因3端具有典型的polyA结构.Blast X(http://blast.ncbi.nlm. nih. gov/Blast.cgi)比对发现,克隆所得到的基因与其他物种的编码核糖体蛋白S6激酶RPS6KA2同源性很高(80%以上),因此命名为NlRPS6KA2.经ORF Finder(http://www.ncbi.nlm.nih.gov/projects/gorf/)分析发现,该基因编码一个长度为2121 bp的开放阅读框(ORF),编码706个氨基酸(图1).经蛋白相对分子质量及等电点预测工具(http://web.expasy.org/compute_pi/)预测发现该蛋白相对分子质量为79630 u(79.63 kDa),等电点为8.49.通过蛋白结构域预测站网(http://smart. embl-heidelberg.de/)预测发现该蛋白具2个丝氨酸苏氨酸蛋白激酶接触催化位点(S_TKc)结构和1个丝氨酸/苏氨酸型蛋白激酶S_TK_X结构,与豌豆蚜(Acyrthosiphonpisum),人体虱(Pediculushumanuscorporis)以及柑橘木虱(Diaphorinacitri)等昆虫具有相同的结构域(图2).

图1 褐飞虱NlRPS6KA2基因全长cDNA序列及氨基酸序列Figure 1 Nucleotide sequence and amino acid sequence of NlRPS6KA2 from N. lugens

图2 褐飞虱、豌豆芽、人体虱和柑橘木虱核糖体蛋白S6激酶结构图Figure 2 Second structure of Ribosomal protein S6 kinase from N. lugens, A. pisum, P. humanus corporis and D. citri.
利用NCBI上已公布的同翅目、膜翅目、虱目、双甲目等相近的9种生物核糖体S6激酶氨基酸序列,应用MRGA6软件构建系统进化树.进化树分析表明褐飞虱与豌豆芽和柑橘木虱的同源性比较近.
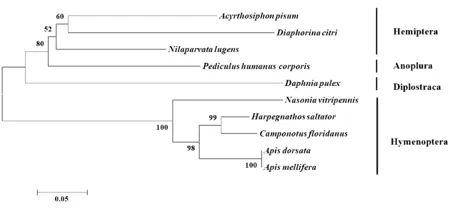
注:生物名称及其RPS6KA2的GenBank登录号:褐飞虱Nilaparvata lugens(KP890676);碗豆蚜Acyrthosiphon pisum(XP_008185477.1);人体虱Pediculus humanus corporis(XP_002432758.1);柑橘木虱Diaphorina citri(XP_008475555.1);蚤状溞Daphnia pulex(EFX78935.1);印度跳蚁Harpegnathos saltator(XP_011138915.1);大蜜蜂Apis dorsata(XP_006614005.1);意蜂Apis mellifera(XP_394955.3);佛罗里达弓背蚁Camponotus floridanus(XP_01 1251733.1);蝇蛹金小蜂Nasonia vitripennis(XP_001601498.1)图3 褐飞虱及其他生物核糖体蛋白S6激酶的进化树Figure 3 Phylogenetic relationship of Ribosomal protein S6 kinase from N. lugens and other organisms
2.2 褐飞虱NlRPS6KA2基因表达变化分析
Tn褐飞虱种群的荧光定量PCR检测结果表明,NlRPS6KA2基因在褐飞虱雌雄虫的所有龄期均有不同程度表达,在怀卵雌虫中的表达量最高,在其他发育阶段和雄成虫中表达量都很低(图4).这一结果与RIEHLE和BROWN[12]在研究埃及伊蚊(Aedesaegypti)中的结果类似,他们发现该通路中的另一个基因Akt(蛋白激酶B)只在胚胎早期和卵巢中表达.

图4 不同发育阶段和不同性别褐飞虱NlRPS6KA2表达量的变化Figure 4 NlRPS6KA2 expression level in different developmental stages and different genders in N. lugens
对7个种群怀卵雌性褐飞虱的荧光定量PCR检测表明,NlRPS6KA2基因在褐飞虱从感性水稻品种TN1到抗性水稻品种RHT上处于下调的过程,而在褐飞虱适应这种抗性后该基因表达量表现为上调(图5).这与前面所说该通路受到抑制时会影响昆虫的生长、发育、体型和存活等,而在褐飞虱从TN1到RHT适应的过程中正好与此相吻合,因此推迟胰岛素信道通路可能与褐飞虱的致害性变异相关.

图5 7个种群怀卵褐飞虱NlRPS6KA2表达量的变化Figure 5 NlRPS6KA2 expression level of seven populations in gravid N. lugens
3 结 语
本研究在褐飞虱中克隆了一个合成核糖体蛋白S6激酶的基因NlRPS6KA2,发现其结构在许多生物中都具有相同的结构域,并且同源性很高,达到了80%以上.经荧光定量PCR检测发现,该基因在褐飞虱雌雄虫的各个时期均有表达,其中在怀卵褐飞虱中表达量最高,是其他时期的23~82倍,证明该基因可能与褐飞虱卵巢的发育有关.研究结果为进一步研究NlRPS6KA2基因在褐飞虱中的功能奠定了基础,为了解褐飞虱致害性变异机制提供了新思路.
[1] BOTTRELL D G, SCHOENLY K G. Resurrecting the ghost of green revolutions past: the brown planthopper as a recurring threat to high-yielding rice production in tropical Asia[J].Journal of Asia-Pacific Entomology,2012,15(1):122-140.
[2] WANG Yanhua, CHEN Jin, ZHU Yucheng, et al. Susceptibility to neonicotinoids and risk of resistance development in the brown planthopper,Nilaparvatalugens(Stål)(Homoptera: Delphacidae)[J].Pest Management Science,2008,64(12):1278-1284.
[3] PARK D S, LEE S K, LEE J H, et al. The identification of candidate rice genes that confer resistance to the brown planthopper (Nilaparvatalugens) through representational difference analysis[J].Theoretical and Applied Genetics,2007,115(4):537-547.
[4] NAULT L R, RODRIGUEZ J G. The leafhoppers and planthoppers[M].New York: Wiley,1985:500.
[5] LIU Su, LIANG Qingmei, ZHOU Wenwu, et al. RNA interference of NADPH-cytochrome P450 reductase of the rice brown planthopper,Nilaparvatalugens, increases susceptibility to insecticides[J].Pest Management Science,2015,71(1):32-39.
[6] CHENG Chinghua. Interactions between biotypes of the brown planthopper and rice varieties[J].Journal of Agricultural Research of China,1985,34(3):299-314.
[7] GAROFALO R S. Genetic analysis of insulin signaling inDrosophila[J].Trends in Endocrinology & Metabolism,2002,13(4):156-162.
[8] JACINTO E, HALL M N. Tor signaling in bugs, brain and brawn[J].Nature Reviews Molecular Cell Biology,2003,4(2):117-126.
[9] BRAZIL D P, HEMMINGS B A. Ten years of protein kinase B signaling: a hard Akt to follow[J].Trends in Biochemical Sciences,2001,26(11):657-664.
[10] LAWLOR M A, ALESSI D R. PKB/Akt a key mediator of cell proliferation, survival and insulin responses[J].Journal of Cell Science,2001,114(16):2903-2910.
[11] SCANGA S E, RUEL L, BINARI R C, et al. The conserved PI3′K/PTEN/Akt signaling pathway regulates both cell size and survival inDrosophila[J].Oncogene,2000,19(35):3971-3977.
[12] RIEHLE M A, BROWN M R. Molecular analysis of the serine/threonine kinase Akt and its expression in the mosquitoAedesaegypti[J].Insect Molecular Biology,2003,12(3):225-232.
[13] UMEMIYA-SHIRAFUJI R, TANAKA T, BOLDBAATAR D, et al. Akt is an essential player in regulating cell/organ growth at the adult stage in the hard tickHaemaphysalislongicornis[J].Insect Biochemistry and Molecular Biology,2012,42(3):164-173.
[14] TATAR M, KOPELMAN A, EPSTEIN D, et al. A mutantDrosophilainsulin receptor homolog that extends life-span and impairs neuroendocrine function[J].Science,2001,292(5514):107-110.
[15] TELEMAN A A. Molecular mechanisms of metabolic regulation by insulin inDrosophila[J].Biochemical Journal,2010,425:13-26.
[16] SIM C, DENLINGER D L. Insulin signaling and FOXO regulate the overwintering diapause of the mosquitoCulexpipiens[J].Proceedings of the National Academy of Sciences,2008,105(18):6777-6781.
[18] CHEN J, ZHANG D, YAO Q, et al. Feeding-based RNA interference of atrehalosephosphatesynthasegene in the brown planthopper,Nilaparvatalugens[J].Insect Molecular Biology,2010,19(6):777-786.
[19] 马艳,郝培应,陆潮峰,等.褐飞虱表皮蛋白基因NlICP的克隆及功能研究.昆虫学报,2013,56(11),1244-1251. MA Yan, HAO Peiying, LU Chaofeng, et al. Molecular cloning and function analysis of cuticular protein geneNlICPin the rice brown planthopper,Nilaparvatalugens(Hemiptera: Delphacidae)[J].Acta Entomologica Sinica,2013,56(11):1244-1251.
Cloning and expression analysis of a ribosomal protein s6 kinase geneNlRPS6KA2 fromNilaparvatalugensStål(Hemiptera: Delphacidae)
LU Chaofeng, HAO Peiying, YU Xiaoping
(Zhejiang Provincial Key Laboratory of Biometrology and Inspection and Quarantine, College of Life Sciences, China Jiliang University, Hangzhou 310018, China)
The full-length cDNA ends ofNlRPS6KA2 gene to code ribosomal protein s6 kinase inNilaparvatalugenswere amplified by RT-PCR according to the RNA-seq analysis of transcriptome; and it encoded a protein of 706 amino acid residues, with two S_TKc and one S_TK_X conservative domains. The real-time quantitative PCR analysis showed that theNlRPS6KA2 gene was slightly expressed in nymphs and males, but was strongly expressed in gravid females. It also showed that the expression level ofNlRPS6KA2 was down-regulated in the progress of brown planthopper (BPH) adaption from variety TN1 to variety RHT, and the expression level ofNlRPS6KA2 was slightly up-regulated when BPH was adjusted to RHT. This study was contributes to the further study about this gene’s function inNilaparvatalugens. It also puts forward new ideas to explain the virulence changes.
Nilaparvatalugens;NlRPS6KA2; real-time quantitative PCR; the virulence changes

1004-1540(2015)02-0216-05
10.3969/j.issn.1004-1540.2015.02.017
2015-03-05 《中国计量学院学报》网址:zgjl.cbpt.cnki.net
国家自然科学基金资助项目(No.31171860,30900944),国家重点基础研究发展计划(“973”计划)项目(No.2012CB114100,2010CB126200),浙江省公益性技术应用研究计划项目(No.2012C22041).

Q965
A
