环肽Astin C在Caco-2细胞单层模型中吸收机制的研究
2015-03-23梁丽娟张朝凤许翔鸿
梁丽娟,黄 璐,成 思,张朝凤,许翔鸿,张 勉
(中国药科大学 生药学研究室,江苏 南京 211198)
环肽Astin C在Caco-2细胞单层模型中吸收机制的研究
梁丽娟,黄 璐,成 思,张朝凤,许翔鸿,张 勉*
(中国药科大学 生药学研究室,江苏 南京 211198)
目的:研究环肽astin C在Caco-2细胞单层模型中的吸收机制。方法:研究astin C在Caco-2细胞单层模型中的双向转运,考察时间、药物浓度对astin C吸收的影响。采用高效液相色谱法检测astin C的浓度,计算其表观渗透系数(Papp)。结果:在Caco-2细胞单层模型中,astin C的吸收随着时间和浓度的增加药物吸收呈近似线性增加;Papp(A→B)明显大于 Papp(B→A),存在方向差异性;astin C不是P-gp的底物。结论:Astin C在Caco-2细胞单层模型中的主要转运机制是AP侧膜转运蛋白所介导的主动转运。
Astin C;Caco-2细胞单层模型;主动转运
Astin C是一类含有氯代脯氨酸(Pro)、L-α-氨基丁酸(Abu)、L-丝氨酸(Ser)、L-β-苯丙氨酸(β-Phe)和 L-allo-苏氨酸(allo-Thr)残基的环五肽类化合物(图1)。目前只从菊科植物紫菀AstertataricusL.f. 的根及根茎中分离得到[1-2]。Astin C具有抗肉瘤180细胞的活性,化合物剂量为5 mg/kg 且连续给药5天,S180细胞的生长率为46%,显示出中等强度的抗肿瘤活性[3~5]。此外,astin C可显著抑制Con A诱导的T细胞增殖(IC50=12 μM),但对于表面活化因子CD25和CD96的表达无影响;astin C可促进T细胞中Caspase 9和Caspase 3前体及PARP的裂解,下调Bcl-2但增加Bad的表达,从而诱导T细胞凋亡;体内实验表明astin C(2.4 mg/kg·d)能明显改善TNBS诱导的小鼠结肠炎[6-8]。但关于astin C药代动力学研究,尤其是吸收机制方面的研究目前尚未见报道。Caco-2细胞单层模型作为研究小肠上皮细胞药物吸收和代谢的体外模型,已广泛用于药物吸收机制的研究和口服药物的筛选[9-10]。本实验采用Caco-2细胞单层模型研究astin C的吸收机制,考察时间、药物浓度对astin C转运的影响,为进一步的药代动力学的研究提供参考依据。

图1 Astin C的结构
1 材料
1.1 药品与试剂
Astin C(本课题组前期研究制备,纯度≥98%),DMEM培养基、非必需氨基酸、胰蛋白酶(Gibco公司),胎牛血清(Hyclone,批号:SV30087),MTT(AMERSCO,批号:0793);水为超纯水,甲醇为色谱纯,其他试剂均为分析纯。
1.2 仪器
二氧化碳培养箱(型号:3111);低温离心机(KUBOTA 3700);倒置显微镜(OLYMPUS,型号:CKX31);酶联免疫检测仪(Epoche Biotek),万分之一分析天平(Mettler Toledo,型号:AL104);96孔细胞培养板(美国Costar);25 cm2、75 cm2细胞培养瓶(美国Corning公司)、Transwell细胞培养板(聚碳酯膜直径12 mm,孔径0.4 μm,美国Corning公司);高效液相色谱仪(Agilent 1260)。
1.3 Caco-2细胞株
Caco-2细胞株购自中国科学院典藏培养物保藏委员会细胞库中国科学院上海生命科学研究院细胞资源中心。
2 方法
2.1 细胞培养
Caco-2细胞培养液为DMEM高糖培养基,其中含有10%胎牛血清、1%非必需氨基酸及100 U/mL青霉素和100 U/mL链霉素双抗液,于37℃、含5%CO2环境中培养。用于astin C的跨膜转运研究时,取对数生长期的细胞调整密度为1×105个 /mL,接种在12孔Transwell板上,培养约21 d后,当Transwell孔上Caco-2细胞单层的跨膜电阻(TEER)>300 Ω/cm2,细胞形成紧密单层,可用于跨膜转运实验。
2.2 MTT法检测astin C对Caco-2细胞的抑制作用
取对数生长期的Caco-2细胞,接种至96孔培养板,每孔加200 μL细胞悬液,接种密度为1×105个/mL,培养24 h后换液。实验组加入浓度分别为90、120、150、180 μmol·L-1的astin C培养液,每浓度5孔。同时设置空白组和对照组。培养6 h后,每孔加0.5 mg/mL的MTT 200 μL,继续培养4 h,移去上清,每孔加入DMSO 200 μL,轻摇10 min,在497 nm波长处用酶标仪测定吸光度(A)值。计算细胞存活率(细胞存活率=实验组A值/对照组A值)。
2.3 Astin C的跨膜转运实验
取符合转运条件的Caco-2细胞单层模型,进行跨膜转运实验。用37℃的空白HBSS溶液冲洗Transwell孔3遍,第三次冲洗时将细胞与HBSS共同置于37℃培养箱中孵育30 min。用pH 7.4的HBSS溶液配制浓度为120、150、180 μmol/L的astin C溶液,过滤除菌。从顶端(apical side, AP侧)到底端(basolateral,BL侧)的转运:将药物溶液0.5 mL加到Transwell孔的AP侧作为供给池,同时将pH 7.4 的空白HBSS溶液1.5 mL加入BL侧作为接收池;从BL侧到AP侧的转运:将药物溶液1.5 mL加到Transwell孔的BL侧作为供给池,同时将pH 7.4 的空白HBSS溶液0.5 mL加入AP侧作为接收池。分别于30、60、90、120 min从接收池(AP侧或BL侧)吸取接收液0.2 mL,同时补加37℃、pH 7.4的空白HBSS溶液0.2 mL。每组平行3个孔。
2.4 样品处理及色谱条件
将吸取的转运样品经0.45 μm滤膜过滤后,用HPLC法测定astin C的含量。HPLC检测条件:色谱柱为ZORBAX Extend-C18(2.1 mm×50 mm,1.8 μm);流动相为乙腈-0.01%甲酸水(26 ∶74);流速为0.2 ml/min;进样量为2 μL;柱温为30℃;检测波长为210 nm。
2.5 数据分析
药物透过Caco-2细胞单层的表观渗透系数Papp(apparent permeability coefficients)按下式计算:Papp=ΔQ/(Δt·A·C0),其中,ΔQ(μmol)为Δt(s)内的转运量,A(cm2)为聚碳脂膜的面积为1.12 cm2,C0(μmol/L)为药物初始浓度。对两组的比较采用t检验,均以mean±SD表示,P<0.05为显著性差异。
3 结果
3.1 Astin C对Caco-2细胞的抑制作用
MTT实验结果(图2)表明,astin C在浓度为90、120、150、180 μmol/L时,Caco-2细胞存活率均在90%以上,未出现突然下降的情况,表明该浓度范围的astin C对细胞均无毒副作用。
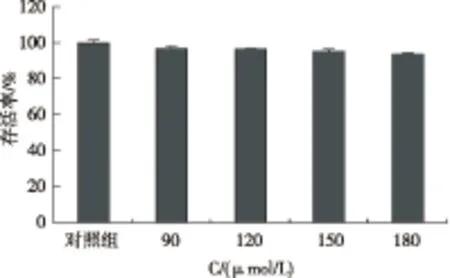
图2 Astin C对Caco-2细胞存活率的影响(n=5, mean±SD)
3.2 时间和浓度对astin C转运的影响
Astin C从AP侧到BL侧、从BL侧到AP侧的转运量随时间和浓度的变化趋势见图3。实验结果显示,当浓度一定时,astin C的双侧累积转运量在2 h内随时间的延长而呈近似线性增加;当转运时间相同时,astin C的双侧累积转运量随浓度(120、150、180 μmol/L)的增加而增加。方差分析结果表明,不同浓度astin C,跨膜转运存在显著性差异,两两比较结果显示,各浓度组间差别具有统计学意义(P<0.05);不同时间点astin C AP侧到BL侧、BL侧到AP侧的透过量均存在显著性差异(P<0.05);任一时间点与前一时间点比较均具有显著性差异(P<0.05)。以上结果表明,astin C在Caco-2细胞单层模型上的双向转运,具有相同的吸收特征,呈现显著的时间、浓度依赖性。但从AP到BL侧的转运速度明显快于BL到AP侧的转运速度。
通过比较双侧转运的Papp(表1)发现,AP侧到BL侧的Papp随浓度的增大而增大,而BL侧到AP侧随浓度的增加Papp的变化则不大,且各浓度Papp在两个方向的比值Papp(BL→AP)/Papp(AL→BL)均小于1,提示摄取作用大于外排作用,存在方向差异性。
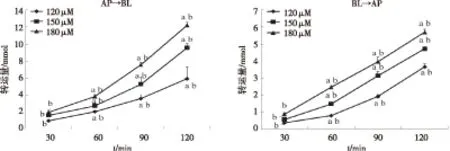
图3 时间、浓度对astin C 从AP侧到BL侧、BL侧到AP侧转运的影响 (n=3, mean±SD)
注:“a”表示与前一时间点比较P<0.05,“b”表示与任一浓度组之间比较P<0.05。

表1 Astin C在不同浓度时双向转运Papp值(n=3, mean±SD)
4 讨 论
环肽astin C是从菊科植物紫菀(AstertataricusL.f.)中分离得到的稀有氯代环五肽类化合物的代表。前期研究发现该肽类化合物具有一定的抗肿瘤活性和免疫抑制活性,但也具有一定的毒性[11-12];为了合理地开发利用,本研究通过建立Caco-2细胞单层模型,研究astin C的跨膜转运特征,探讨其小肠吸收的机制,为药代动力学研究提供参考依据。
Caco-2细胞单层模型用于药物吸收机制研究的过程中,通常用表观渗透系数Papp来评价受试药物经肠道吸收的能力。本研究结果显示,三个浓度(120、150、180 μmol/L)的astin C从AP到BL侧的表观渗透系数Papp为6×10-6~9×10-6cm/s,均大于1×10-6cm/s,说明astin C是一种吸收中等的药物,推断其吸收率在20%~70%之间[13];同时,astin C的双向转运均具有时间、浓度依赖性;且Papp(A→B)明显大于Papp(B→A)(三个浓度120、150、180 μmol/L的Papp(A→B)/Papp(B→A)分别为1.62、2.03、2.14),即AP侧到BL侧的转运速度明显快于BL侧到AP侧的转运速度,表明astin C可能被小肠AP侧膜的转运蛋白所转运[14-15]。由于载体介导主动转运的共同特征是对温度敏感,当温度下降时,载体的活性逐渐减弱或者失活。因此在下一步研究中,应考察温度对astin C吸收的影响,从而验证载体介导的主动转运方式是否参与其吸收过程。P-糖蛋白(P-gp)位于Caco-2细胞AP侧,其作用是将细胞内药物外排至细胞外侧,因而不利于药物的吸收[16]。通常根据Papp(B→A)/Papp(A→B)的比值来判断所研究药物是否P-gp的底物。Astin C在高、中、低三种浓度时的Papp(B→A)/Papp(A→B)比值均小于1,说明astin C不是P-gp的底物,不受P-gp外排作用的影响[14-15]。
由于Caco-2 细胞模型与整体吸收具有良好的相关性,已被广泛应用于药物吸收机制的研究、药物体内吸收的预测、新药设计及药物生物利用度和安全性的的评价。与动物实验相比,Caco-2细胞模型具有显著优点:同源性好,模型建立周期短,可以同时进行双向转运实验,并且从细胞水平提供肠吸收和代谢的信息。但由于Caco-2细胞来源于结肠,缺乏小肠上皮中的粘液层及肠道菌群代谢酶,因此该模型不能完全模拟药物在小肠中的吸收过程。所以,下一步的研究应在细胞模型研究的基础上设计整体动物实验,深入探讨astin C的体内吸收和代谢过程。
[1] Tan N H, Zhou J. Plant cyclopeptides[J]. Chemical reviews, 2006, 106(3): 840-895.
[2] Morita H, Nagashima S, Takeya K, et al. Structures and conformation of antitumour cyclic pentapeptides, astins A, B and C, fromAstertataricus[J]. Tetrahedron,1995, 51(4): 1121-1132.
[3] Kosemura S, Ogawa T, Totsuka K. Isolation and Structure of Asterin, a new halogenated cyclic penta-peptide fromAstertataricus[J]. Tetrahedron letters, 1993, 34(8): 1291-1294.
[4] Morita H, Nagashima S,Takeya K, et al. Astins A and B, antitumor cyclic pentapeptides fromAstertataricus[J]. Chemical & pharmaceutical bulletin, 1993,41(5): 992.
[5] Morita H, Nagashima S, Uchiumi Y, et al. Cyclic peptides from higher plants.XXVIII. Antitumor activity and hepatic microsomal biotransformation of cyclic pentapeptides, astins, fromAstertataricus[J]. Chemical & Pharmaceutical bulletin, 1996, 44(5): 1026-1032.
[6] Shen Y, Luo Q, Xu H, et al. Mitochondria-dependent apoptosis of activated T lymphocytes induced by astinC, a plant cyclopeptide, for preventing murine experimental colitis [J]. Biochemical pharmacology, 2011, 82(3): 260-268.
[7] 沈燕, 徐会敏, 曾广智,等.环肽Astin C触发线粒体凋亡通路诱导T淋巴细胞凋亡[C]. 第十届全国抗炎免疫药理学学术会议论文集. 2010.
[8] 许文彦,赵思蒙,曾广智,等. 一些重要天然活性环肽化学和生物活性研究进展[J]. 药学学报,2012, 47(3): 271-279.
[9] Yang H T, Wang G J. Caco-2 cell monolayers model and its application in pharmacy[J]. Acta Pharm Sin, 2000, 35(10): 797-800.
[10] Liao S, Xie J W. Application of Caco-2 cell model in drug in vitro research[J]. Chin J New Drugs, 2005, 14(4): 416-419.
[11] Terao K, Ito E, Tatsuno T. Liver injures induced by cyclochlorotine isolated from Penicillium islandicum[J]. Archives of toxicology, 1984, 55(1): 39-46.
[12] Cole R J, Cox R H. Handbook of toxic fungal metabolites[M]. Academic Press, 1981.
[13] 杨秀伟, 杨晓达, 王莹,等. 中药化学成分肠吸收研究中Caco-2细胞模型和标准操作规程的建立[J]. 中西医结合学报, 2007, 5(6): 634-641.
[14] Lalloo AK, Luo FR, Guo A, et al. Membrane transport of camptothecin: facilitation by human P-glycoprotein (ABCB1) and multidrug resistance protein 2 (ABCC2). BMC Med, 2004, 2: 16.
[15] Foger F, Kopf A, Loretz B, et al. Correlation of in vitro and in vivo models for the oral absorption of peptide drugs[J]. Amino Acids, 2008, 35: 233-241.
[16] Nakagami T, Yasui-Furukori N, Saito M, et al. Effect of verapamil on pharmacokinetics and pharmacodynamics of risperidone: in vivo evidence of involvement of P-glycoprotein in risperidone disposition[J]. Clin Pharmacol Ther, 2005, 78: 43-51.
Absorption Mechanism of Astin C in Caco-2 Cell Monolayer Model
Liang Lijuan, Huang Lu, Cheng Si, Zhang Chaofeng, Xu Xianghong, Zhang Mian*
(Research Department of Pharmacognosy, China Pharmaceutical University, Nanjing 211198, China)
Objective: To study the absorption mechanism of the astin C, a cyclopeptide, in Caco-2 cell monolayer model. Method: Caco-2 cell model was established to investigate the bidirectional transport of astin C. The influences of time and drug concentration on the absorption of astin C was observed. Drug concentration was measured by HPLC and the apparent permeability coefficients(Papp) was calculated. Results: The absorption of asitn C in Caco-2 cell monolayer was nearly linear increased in a time and concentration dependent manner. The value of Papp(A→B)was much greater than that of Papp(B→A) indicating astin C was not a substrate of P-gp. Conclusion: The absorption of astin C in Caco-2 cell monolayers is an active transportation mediated by transporter in the AP side.
Astin C;Cac-2 cell monolayer model;active transportation
2014-08-18
国家自然科学基金资助项目(30772702)。
梁丽娟(1990—),女,硕士研究生。研究方向:中药药理。 E-mail:lianglijuan1990@163.com
*通讯作者:张勉(1962—),女,教授、博士生导师。研究方向:生药活性成分与质量标准。 E-mail:mianzhang@126.com
10.3969/j.issn.1006-9690.2015.02.008
R965
A
1006-9690(2015)02-0029-04
