桃儿七愈合组织的诱导及植株再生
2015-03-23张耀宏康永祥
景 宁,康 晋,张耀宏,康永祥
桃儿七愈合组织的诱导及植株再生
景 宁1,康 晋2,张耀宏3,康永祥1
(1.西北农林科技大学 林学院,陕西 杨凌 712100;2.杨凌职业技术学院 信息工程学院,陕西 杨凌712100;3.国家林业局西北林业调查规划设计院,陕西西安710048)
以桃儿七Sinopodophyllum hexandrum成熟种胚为材料,研究了不同种类和浓度的细胞分裂素(噻苯隆TDZ和6-苄氨基腺嘌呤6-BA)和生长素(萘乙酸NAA和吲哚乙酸IAA)对桃儿七愈合组织诱导和不定芽分化及无菌苗生根的影响,建立了完整组织培养再生体系。结果表明:在添加0.5 mg·L-1TDZ+500 mg·L-1水解酪蛋白(CH)的MS (Murashige和Skoog)培养基中,成熟种胚愈合诱导率最高,为97.8%,显著高于其他处理。在添加0.5 mg·L-1TDZ的继代培养基中,出现球形胚和心形胚,但继代培养褐化严重,添加谷胱甘肽160 mg·L-1能显著抑制褐化现象。在附加1.5 mg·L-16-BA+0.2 mg·L-1NAA+500 mg·L-1CH的分化及增殖培养基中,不定芽诱导率最高,为53.3%,且增殖芽数最高为5.2。在添加0.5 mg·L-1NAA,0.5mg·L-1IAA等2种处理均可诱导生根,以MS+0.5 mg·L-1IAA生根率最高,为22.4%。图1表3参13
植物学;桃儿七;组织培养;愈合组织;不定芽;褐化
桃儿七Sinopodophyllum hexandrum小檗科Berberidaceae桃儿七属Sinopodophyllum,多年生草本,“太白七药”之一,具有祛风除湿,止咳止痛,活血解毒的功效,用于治疗风湿关节痛,心胃痛,风寒咳嗽,月经不调等症状。桃儿七根茎中含有的鬼臼毒素是合成GP7,VP-16(etoposide),VM-26(teniposide)和NK611等抗癌药物的起始物质[1]。桃儿七残存于东亚,生长地域受限,呈零星分布,由于根状茎与果实入药、种子萌发率低、生长发育迟缓和人工栽培较为困难,以及过度采挖,使得自然繁殖十分困难,随着植被的破坏而导致其生境的改变,植株日益减少,分布区日渐缩减,造成资源急剧减少。因此,进行桃儿七离体培养和快速繁殖研究不仅能够保存种质资源,还能够解决其繁殖问题,加快繁殖速度,这在理论和实践上均具有重要意义。桃儿七的组织培养前人已做了部分研究,国外已有报道[2-5],中国在此方面虽有报道[6-9],但仅停留在愈合组织和无菌苗的诱导及芽生芽组织培养途径,尚未建立由愈合组织诱导不定芽再生根的完整组织培养体系。同时,组织培养过程中存在愈合组织生长缓慢,诱导率低,生长停滞,分化能力较弱,继代培养不稳定,极易褐化等问题,使得桃儿七组织培养过程受阻。本研究以桃儿七成熟种胚为外植体,对愈合组织的诱导、褐化、不定芽的分化及生根问题进行研究,以期建立器官发生途径完整的植株再生体系,为工厂化大规模生产提供理论依据,同时也为其他草本类植物再生体系的建立提供参考。
1 材料与方法
1.1 试验材料
试验材料为2012年8月在太白山采集的桃儿七成熟果实,并放入4℃冰箱保存备用。
1.2 试验方法
1.2.1 无菌材料的建立 剥取桃儿七果实中的种子,流水冲洗1 h,于超净工作台上用体积分数为70%的乙醇消毒30 s,质量浓度为1.0 g·L-1的氯化汞(HgC12)消毒25 min,再用无菌水冲洗3~5次。无菌条件下,用解剖刀剥取种胚,水平接种于诱导培养基中。
1.2.2 愈合组织诱导和继代 以 M S(Murashige and Skoog)为基本培养基, 单独添加 0(ck),0.1,0.2,0.5,1.0,2.0 mg·L-1噻苯隆(TDZ),研究它对愈合组织诱导的影响。培养7 d时开始观察生长情况。培养条件:光培养。将生长良好的愈合组织切成约1 cm3左右的小块,接于附加0.5 mg·L-1TDZ 的MS培养基中培养,诱导愈合组织再分化。培养条件:暗培养。
1.2.3 不定芽的分化和增殖 将切成小块的愈合组织转接至以MS为培养基的分化培养基中,同时添加1.0,1.5,2.0 mg·L-16-苄氨基腺嘌呤(6-BA)和0.2,0.5,1.0 mg·L-1萘乙酸(NAA)的不同配比,进行不定芽的分化与增殖。培养条件:暗培养7 d后进行光培养。
1.2.4 根的诱导 丛生芽长至2 cm时,切割成单芽转入以MS为基本培养基,分别添加0.5 mg·L-1吲哚乙酸(IAA)和0.5 mg·L-1NAA的生根培养基中诱导根的分化。培养条件:暗培养7 d后转至光培养。60 d后统计生根率。以上所有培养基均添加琼脂6 g·L-1,蔗糖30 g·L-1,pH 5.8及水解酪蛋白(CH)500 mg· L-1。光培养条件为(25±1)℃,补充光照14 h·d-1,光照强度1 500~2 000 lx。接种5瓶·处理-1,培养物3个·瓶-1,重复3次。实验数据采用SPSS 17.0进行统计分析。
2 结果与分析
2.1 TDZ对桃儿七愈合组织诱导的影响
桃儿七胚接种在含TDZ的MS培养基上,7 d后种胚明显膨大伸长,14 d时,伸长的胚轴表面有较紧实颗粒状愈合组织生成,继续培养愈合组织生长迅速,并逐渐变得较疏松且呈淡绿色(图1A)。培养50 d时统计诱导率(表1)。结果表明:桃儿七愈合组织的诱导必须依赖于植物生长调节物质,在不含植物生长调节物质的培养基中不能诱导愈合组织的形成。在不同质量浓度的TDZ处理下,桃儿七愈合组织诱导率存在极显著差异,随着TDZ质量浓度增加,诱导率呈先升高后降低的趋势。愈合组织诱导率变异幅度为44.5%~97.8%。TDZ质量浓度为 0.1 mg·L-1时,诱导率最低,为44.5%;TDZ质量浓度增加至0.5 mg·L-1时,愈合诱导率最高,达97.8%,显著高于其他处理;随着质量浓度继续增加,愈合组织诱导率呈下降趋势。上述结果表明:诱导桃儿七外植体形成愈合组织的过程中,在培养基中添加适宜质量浓度的TDZ能诱导愈合组织的形成,但质量浓度过高反而会起抑制作用。
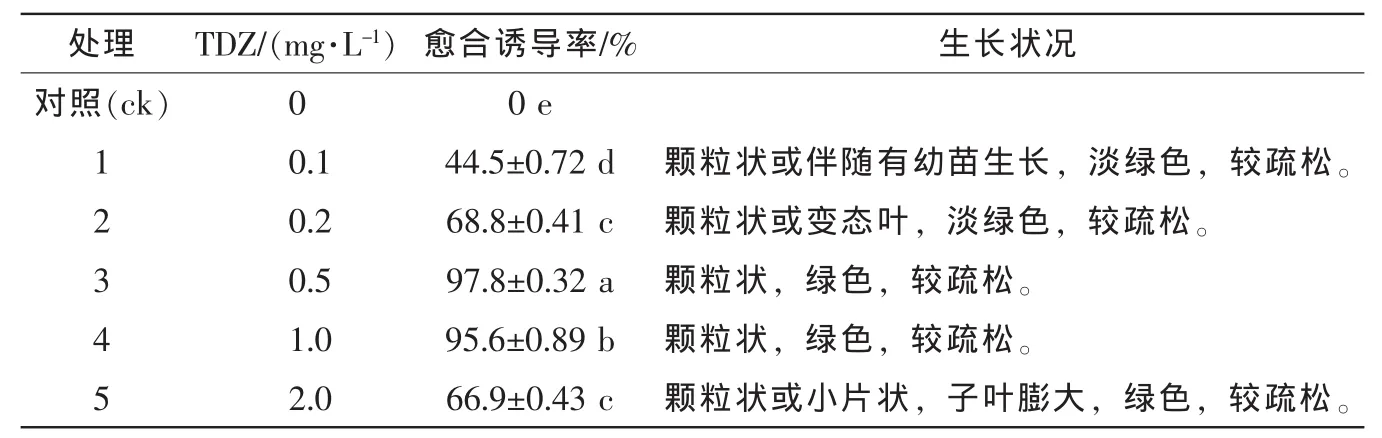
表1 噻苯隆对愈合诱导的影响Table 1 Effect of TDZ concentration on callus induction
2.2 TDZ对桃儿七愈合组织继代的影响
将诱导出的愈合组织接种到含0.5 mg·L-1TDZ的MS培养基上进行增殖培养,每40 d继代1次。实验结果发现:TDZ能够诱导体细胞胚胎发生。培养20 d左右,愈合组织切口边缘形成簇生的愈合组织。培养40 d左右,周围出现松散的大颗粒状乳白色的胚性愈合组织,连接极为松散,很容易从愈合组织上剥离,继续培养逐渐出现球形胚和心形胚(图1B)。再继续培养60 d左右发现愈合组织产生的体细胞胚停滞生长,并逐渐死亡,未见鱼雷和子叶期体细胞胚的出现。
2.3 添加物对桃儿七愈合组织继代阶段褐化的影响
愈合组织的诱导过程未出现褐化现象,但在愈合的继代阶段却极易褐化。因此解决褐化现象是桃儿七组织培养成功的关键问题。为了降低褐化率,在培养基中添加不同质量浓度谷胱甘肽(GSH)和聚乙烯吡咯烷酮(PVP),观察它们对褐化的影响,40 d后统计褐化率(表2)。实验结果表明:GSH和PVP都能降低褐化率,随着GSH质量浓度增加,褐化率降低。添加20 mg·L-1GSH的培养基,10 d后未出现明显褐化现象,15 d左右部分愈合开始褐化,30 d时,愈合组织周围培养基变褐色。160 mg·L-1GSH时,培养20 d后,个别愈合组织开始出现褐化,但程度较轻,褐化率为13.7%,抑制褐化效果显著高于其他处理,能够很好地抑制褐变,且愈合组织生长健壮。2 000 mg·L-1PVP时,褐化率为16.3%,抑制褐化作用不如GSH,同时也会抑制愈合组织生长。因此,本实验最佳抑制褐化的方案是添加160 mg·L-1GSH。

表2 不同添加物及其质量浓度对愈合组织褐化的影响Table 2 Effect of different additives and concentration on the browning of callus
2.4 不同种类植物生长调节物质及其质量浓度对桃儿七不定芽分化的影响
将桃儿七种胚诱导的愈合组织接种在添加不同质量浓度6-BA及NAA的MS培养基上(表3),50 d分化培养,处理8和处理9愈合组织表面开最先出现绿色小芽点,之后20 d其他处理出现芽点。70 d时,处理8先分化出不定芽,继续培养,各处理均可分化出不定芽。处理1和处理2不定芽瘦弱,处理9有玻璃化现象。在原有培养基上增殖,实验结果表明:不同处理下芽分化率和增殖芽数存在极显著差异,分化及增殖与6-BA和NAA质量浓度有关。当1.0 mg·L-16-BA时,随着NAA质量浓度增加,芽分化率和增殖芽数呈上升趋势;当6-BA质量浓度为1.5 mg·L-1时,随着NAA质量浓度增加,芽分化率和增殖芽数呈下降趋势;当6-BA质量浓度为2.0 mg·L-1时,随着NAA质量浓度增加,芽分化率和增殖芽数先升高后下降。在添加1.0 mg·L-16-BA, 0.2 mg·L-1NAA的培养基上,芽诱导率及增殖芽数最低,分别为23.2%和1.0。在添加2.0 mg·L-16-BA,0.5 mg·L-1NAA的培养基上,芽分化率为60.4%,增殖芽数为5.2,显著高于其他处理,且芽生长健壮,丛生芽数量多(图1C)。
2.5 生根培养
将不定芽切下转至生根培养基中进行生根培养。25 d后,添加IAA的处理基部膨大,有突起,根开始长出。30 d时,添加NAA的处理开始长根,60 d时统计生根率。实验结果表明:这2种培养基均能诱导根的生成(图1D),但生根时间及生根率不同。添加0.5 mg·L-1IAA的培养基生根率最高,为22.4%,只有1条不定根,较短且粗。添加0.5 mg·L-1NAA的培养基,生根率为16.7%,只有1条根,短基部肿大,且有愈合组织长出。
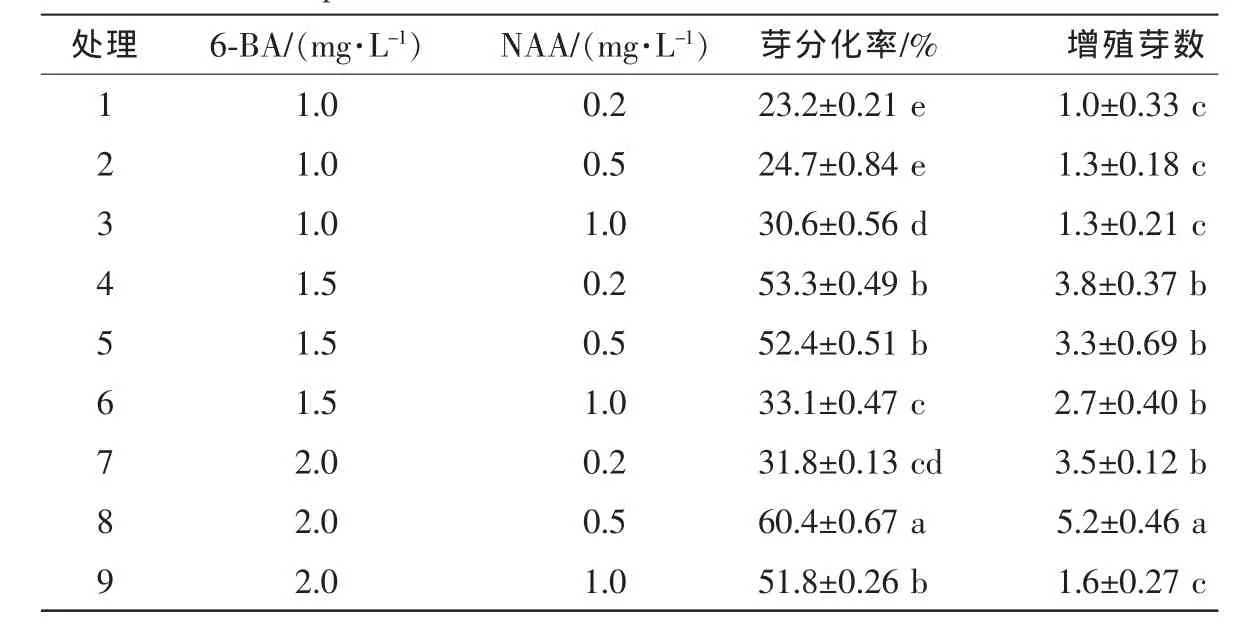
表3 不同质量浓度6-苄氨基嘌呤与萘乙酸对芽分化及增殖的影响Table 3 Effect of different concentrations 6-BA and NAA on bud differentiation and multiplication

图1 桃儿七组织培养再生过程Figure 1 Regeneration process of Sinopodophyllum hexandrum from tissue culture
3 结论与讨论
影响愈合组织诱导及生长的因素有多种,如外植体类型、培养条件、培养基、pH值、植物生长调节物质等,其中植物生长调节物质对愈合诱导极为重要[10]。我们研究了TDZ对愈合组织诱导的影响。结果表明:桃儿七愈合组织诱导的最适培养基为MS+0.5 mg·L-1TDZ+500 mg·L-1CH,愈合诱导率为97.8%,高于漆燕玲等[7]的实验结果(36.67%),解决了桃儿七愈合诱导率低的难题。TDZ作为一种高效细胞分裂素,近年来被广泛用于植物组织培养中,具有很强的细胞分裂素活性,许多难以再生的植物应用TDZ可获得体细胞胚和再生植株[11]。TDZ在桃儿七愈合组织的诱导中起关键作用,低质量浓度TDZ易诱导出芽, 而高质量浓度过高会抑制愈合组织的产生。在添加0.5 mg·L-1TDZ继带培养,可以诱导出胚性愈合组织,观察为球形期和心形期,但在心形期出现生长停滞,有关体细胞胚胎发生途径还有待进一步研究。
桃儿七愈合组织继代过程极易褐化,致使组织培养无法继续进行,这是桃儿七无性繁殖的一大难题。前人研究认为组织培养过程中褐变是由于培养物含有丰富的多酚化合物,在多酚氧化酶的作用下发生酶促褐变反应生成有毒的醌类物质[12]。谷胱甘肽(GSH)能对多酚氧化酶产生抑制效应,对褐变反应抑制效果明显,且能起促进生长分化[13]。前人采用PVP和活性炭等吸附剂降低桃儿七褐化率[8],但吸附剂同时会吸收培养基中的营养,影响愈合组织生长。我们采用GSH能显著降低褐化率,质量浓度为160 mg·L-1时,抑制褐化效果最优,且愈合增殖快,生长良好。本研究添加不同质量浓度6-BA和NAA进行增殖实验,均有不定芽形成,当2.0 mg·L-16-BA和0.5 mg·L-1NAA时,芽诱导率最高,增殖芽数多且生长健壮。但在生根过程中,生根率较低,生根效果仍不理想。这也是今后研究的重点。
[1] GIRI A,NARASU M L.Production of podophyllotoxin from Podophyllum hexandrum:a potential natural product for clinically useful anticancer drugs[J].Cytotechnology,2000,34(1/2):17-26.
[2] van UDEN W,PRAS N,VISSER J F,et al.Detection and identification of podophyllotoxin produced by cell cultures derived from Podophyllum hexandrum Royle[J].Plant Cell Rep,1989,8(3):165-168.
[3] NADEEM M,PALNI L M S,PUROHIT A N,et al.Propagation and conservation of Podophyllum hexandrum Royle: important medicinal herb[J].Biol Conserv,2000,92(1):121-129.
[4] ARUMUGAM N,BHOJWANI S S.Somatic embryogenesis in tissue cultures of Podophyllum hexandrum[J].Can J Bot, 1990,68(3):487-491.
[5] SULTAN P,SHAWL A S,RAMTEKE P W,et al.In vitro propagation for mass multiplication of Podophyllum hexandrum:a high value medicinal herb[J].Asian J Plant Sci,2006,5(2):179-184.
[6] 杨晖,王治业,陆栋,等.桃儿七的组织培养[J].植物生理学通讯,2006,42(1):79. YANG Hui,WANG Zhiye,LU Dong,et al.Tissue culture of Sinopodophyllum emodi(Wall.)Ying[J].Plant Physiol Commun,2006,42(1):79.
[7] 漆燕玲,栗孟飞,孙萍,等.桃儿七成熟胚的离体培养研究[J].生物学杂志,2008,25(4):39-41. QI Yanling,LI Mengfei,SUN Ping,et al.In vitro culture of maturated embryo of Podophyllum hexandrum royle[J].J Biol,2008,25(4):39-41.
[8] 叶耀辉,张文雪,张寿文,等.珍稀藏药桃儿七组织培养研究[J].江西农业大学学报,2011,33(6):1144-1148. YE Yaohui,ZHANG Wenxue,ZHANG Shouwen,et al.A study on the tissue culture of the rare tibetan medicine Sinopodophyllum hexandrum[J].Acta Agric Univ Jiangxi,2011,33(6):1144-1148.
[9] 郭琪,张军,赵小锋,等.濒危药用植物桃儿七的离体培养研究[J].植物研究,2012,32(4):484-487. GUO Qi,ZHANG Jun,ZHAO Xiaofeng,et al.In vitro culture of endangered medicinal plant Sinopodophyllum hexandrum Royle[J].Bull Bot Res,2012,32(4):484-487.
[10] PARIS R,PRATESI D,NEGRI P.In vitro morphogenic ability of mature or embryonic apricot tissues[J].Acta Hortic,2004,663:487-490.
[11] 陈云凤,张春荣,黄霞,等.TDZ对植物体细胞胚胎发生的作用[J].植物生理学通讯,2006,42(1):127-133. CHEN Yunfeng,ZHANG Chunrong,HUANG Xia,et al.Effect of TDZ on somatic embryogenesis of plant[J].Plant Physiol Commun,2006,42(1):127-133.
[12] 兰小中,李春燕,鲍隆友.西藏八角莲的组织培养条件筛选[J].西藏科技,2006(3):56-58. LAN Xiaozhong,LI Chunyan,BAO Longyou.Tibet Dysosma tsayuensis Ying’s tissue culture condition screening[J]. Tibet Sci Technol,2006(3):56-58.
[13] 赵坚华,郑玉淑,李官浩,等.苹果梨中多酚氧化酶抑制剂的抑制效果研究[J].食品科学,2010,31(2):277-279. ZHAO Jianhua,ZHENG Yushu,LI Guanhao,et al.Single and combined inhibitory effects of inhibitors against polyphenol oxidase from Pingguoli pear(Pyrus bretchneideri Rehd cv.Pingguoli)fruits[J].Food Sci,2010,31(2):277-279.
Callus induction and plant regeneration in Sinopodophyllum hexandrum
JING Ning1,KANG Jin2,ZHANG Yaohong3,KANG Yongxiang1
(College of Forestry,Northwest A&F University,Yangling 712100,Shaanxi,China;2.Information Technology Institute,Yangling Vocational&Technical College,Yangling 712100,Shaanxi,China;3.Northwest Institute of Forest Inventory,Planning and Design,State Forest Administration,Xi’an 710048,Shaanxi,China)
To protect and exploit the endangered medicinal plant Sinopodophyllum hexandrum,a rapid regeneration system of tissue cultue was established.The effects of cytokinins [thidiazuron (TDZ)and 6-benzylaminopurine(6-BA)]and auxins[naphthalene acetic acid(NAA)and indole-3-acetic acid(IAA)]on callus induction,adventitious bud induction,and rooting were studied.Using mature embryos of Sinopodophyllum hexandrum as explants Murashige and Skoog medium (MS)+0.5 mg·L-1TDZ was used to induced embryogenic callus from primary callus so that embryogenic callus developed into globular embryoid and heart-stage embryoid.Results showed differences in percentages for mediums causing callus induction for S.hexandrum with TDZ concentrations of 0.5 mg·L-1TDZ and 500 mg·L-1casein hydrolysate(CH)having the best callus induction rate of 97.8%.To avoid brownness of callus a medium of 160 mg·L-1glutathione(GSH)was used.The optimum medium for adventitious bud differentiation and proliferation was MS+1.5 mg·L-16-BA+0.2 mg·L-1NAA+500 mg·L-1CH with the highest induction rate of 53.3%and 5.2 multiple shoots.Two treatments of 0.5 mg·L-1NAA and 0.5 mg·L-1IAA induced roots,but the most suitable medium was MS+0.5 mg·L-1IAA having a rooting rate of 22.4%.The rapid propagation system of Sinopodophyllum hexandrum has been preliminar-ily established,which provide theory foundation for biotechnology breeding and technical guidance for largescale production[Ch,1 fig.3 tab.13 ref.]
botany;Sinopodophyllum hexandrum;tissue culture;callus;adventitious buds;browning
S718.3;Q945.5
A
2095-0756(2015)01-0162-05
浙 江 农 林 大 学 学 报,2015,32(1):162-166
Journal of Zhejiang A&F University
10.11833/j.issn.2095-0756.2015.01.024
2014-01-24;
2014-04-02
国家林业公益性行业科研专项(200904004)
景宁,从事植物组织培养研究。E-mail:jingning1202@163.com。通信作者:康永祥,教授,博士生导师,从事森林植物学研究。E-mail:kangchenj@yahoo.com.cn
