PIK3R1 对多发性骨髓瘤细胞侵袭转移的影响及其机制初探*
2015-03-22西安交通大学医学院第一附属医院血液科西安710061
西安交通大学医学院第一附属医院血液科(西安 710061)
吴 迪 刘亚林 王梦昌▲
PIK3R1 对多发性骨髓瘤细胞侵袭转移的影响及其机制初探*
西安交通大学医学院第一附属医院血液科(西安 710061)
吴 迪 刘亚林 王梦昌▲
目的:观察应用RNA干扰(RNAi)技术敲低PIK3R1表达后在体外对人类多发性骨髓瘤细胞系RPMI8226细胞侵袭的抑制作用。方法:将重组质粒表达载体pGenesil-1.1-PIK3R1转染至RPMI8226细胞。Realtime PCR和Western blot分别检测转染前后目的基因mRNA和蛋白的表达水平,酶联免疫吸附试验(ELISA)检测细胞外基质金属蛋白酶(MMP)-2、MMP-9的浓度变化。Transwell实验评价肿瘤细胞侵袭能力的变化。结果:pGenesil-1.1-PIK3R1可以有效抑制PIK3R1 mRNA及蛋白的表达,MMP-2、MMP-9表达下调,基质金属蛋白酶组织抑制因子(TIMP)-2表达上调,ELISA证实细胞外MM9-2、MMP-9浓度在治疗组明显减低。Tramwell穿过细胞数:对照组(115.5±3.9)和无义序列组(112.8±6.0), pGenesil-1.1-PIK3R1转染组(73.7±4.0)。结论:靶向PIK3RI的RNAi技术可以序列特异性地抑制PI3KR1表达,在体外明显抑制RPMI8226细胞的侵袭能力。
多发性骨髓瘤(MM)是发生于B细胞终末阶段浆细胞的恶性血液系统肿瘤,至今仍不可治愈。这主要与MM患者髓外浸润的发生密切相关。MM患者的髓外浸润事件常常与骨髓瘤细胞增强的侵袭活性、复杂的细胞遗传学异常伴随发生。基因的异常被认为是多发性骨髓瘤疾病致病的重要因素。然而,目前使骨髓瘤细胞具有增强的侵袭活性的分子机制尚不明确。研究发现PI3K/AKT信号转导通路与恶性肿瘤侵袭转移的关系密切[1-2],PIK3R1(phosphoinositide-3-kinase, regulatory subunit 1, p85 alpha)基因负责编码磷脂酰肌醇3-激酶(Phisphatidylinositol 3-kinase, PI3K)中85kD大小的调节亚基—p85α,p85α是PI3K家族中表达量最多的调节亚基,各种相关信号分子都需要与p85亚基结合后,才能激活PI3K,进而通过多种信号传导通路影响细胞生长、分化、黏附及细胞周期进程,促进肿瘤细胞增殖、侵袭、转移,并抑制肿瘤细胞凋亡[3-4]。目前,对于PIK3R1是否能够影响MM细胞的侵袭活性,PIK3R1以及PI3K信号转导通路在MM患者中的作用知之甚少。因此,本文应用质粒载体介导的PIK3R1 siRNA转染人类多发性骨髓瘤细胞系RPMI8226和纯化的原代多发性骨髓瘤细胞,使PIK3R1基因下调,从而观察PIK3R1对骨髓瘤细胞增殖、凋亡、细胞周期进程、侵袭活性的影响,并检测PI3K/AKT信号通路在MM细胞中的表达,以了解其可能的作用机制,为基因治疗多发性骨髓瘤提供理论依据。
材料与方法
1 材 料 人类多发性骨髓瘤细胞系RPMI8226 (本实验室保存)。pGenesil-1.1 购自Genesil生物技术公司。RPMI1640购自美国生命技术公司(Gibco/BRL),多克隆抗体购自美国Santa Cruz公司。酶联免疫吸附试验(ELISA)试剂盒购自上海森雄科技实业有限公司。Western blot所用试剂购自美国Sigma公司,逆转录试剂盒、Real-time PCR试剂盒购自日本TaKaRa公司。引物序列:人PIK3R1引物上游5'-AGCATTGGGACCTCACATTACACA-3', 下游引物5'- ACTGGAAACACAGTCCATGCACATA-3',内参照上游引物为5'- TCTCTGCTCCTCCTGTTC-3',下游引物5'-CTCCGACCTTCACCTTCC-3'。Transwell购自Costar公司。
2 方 法 ①质粒载体pGenesil-1.1-PIK3R1构建:(干扰序列:GTAAAGCATTGTGTCATA,位于编码区2040-2058)。根据Genebank报道的PIK3R1的mRNA序列(NM_181523.1),参考siRNA的设计原则[5],利用Ambion公司siRNA在线设计软件从PIK3R1核心蛋白基因起始密码子下游寻找符合设计特征的靶序列。经BLAST Search检索确认与PIK3R1以外的人类已知基因序列无同源性。此外设计合成了针对与人PIK3R1序列无关的序列作为阴性对照,目标基因序列为5'-GACTTCATAAGGCGCATGC -3',以及针对管家基因GAPDH的RNAi序列作为阳性对照, 目标基因序列为5'-GTGGATATTGTTGCCATCA -3'。针对靶序列分别合成1对寡核苷酸链顺序依次为CACC、19 nt正义序列、9 nt loop插入序列(5'-TTCAAGACG-3')、19 nt反义序列、转录终止信号(5个T)、SacI酶切位点。经质粒酶切、连接及鉴定,构建干扰质粒载体pGenesil-1.1-PIK3R1。②细胞培养:培养RPMI8226细胞于10 cm细胞培养皿中,采用含10%胎牛血清(FBS)的RPMI1640培养液,培养条件为37℃,5%CO2孵箱湿润培养。③实验分组与转染:实验分组:空白对照组(contro1)、无义序列组(HK)、重组质粒pGenesil-1.1-PIK3R1 (P+P)。转染:弃培养液,加入无血清培养液7~8ml,加完全培养液继续培养48~72h。重组质粒中有荧光蛋白真核表达框,因此可以通过荧光计算转染效率。计算转染率>95%可以进行后续实验。④Real-time PCR:转染后48h,提取细胞总RNA,逆转录为cDNA。Real-time PCR扩增体系50μl:SYBR Green 25μl,ROX 1μl,ddH2O 20μl,cDNA50ng,上游引物20pmol,下游引物20pmol。反应条件:StageI:95 ℃ 10 s(循环数1),Stage2:95℃ 5s, 60℃ 31s(循环数40)。另取不同的模板浓度(0.2、2、20、200ng)进行 PCR 反应,制定各基因的标准曲线,并测定各样本 PCR 反应液的熔解曲线,每样本做 3 个复管。用Bio-Rad iQ5自带软件求出各样本的CT值,2 -△△CT方法计算各基因的相对表达量。⑤Western blot:转染48~72h收集细胞,PBS冲洗2次, 加RIPA细胞裂解液裂解,超声破碎,细胞蛋白样品于100℃水浴5 min。将各组细胞样品的蛋白浓度调整一致后,各取20μl上样进行SDS-PAGE,电泳完毕后,将凝胶中的蛋白转移至PVDF膜上,PVDF膜以含2%脱脂奶粉的TTBS室温封闭2 h,加PIK3R1多克隆抗体(工作浓度1∶200), 4℃孵育过夜,山羊抗小鼠二抗(1∶2000)室温孵育2h, ECL试剂于暗室自显影,X线胶片曝光,于自动电泳凝胶成像分析系统下成像并分析结果。⑥酶联免疫吸附试验(ELISA):常规转染,继续培养48h后各提取培养液1ml,参照ELISA试剂盒说明,采用双抗体夹心ABC-ELISA法检测转染前后细胞培养上清中MMP-2、MMP-9浓度。分别将抗人MMP-2/MMP-9单抗包被于酶标板上,标准品与样品中的MMP-2/MMP-9与单抗结合,加人生物素化的抗人MMP-2 /MMP-9,形成免疫复合物连接在板上,辣根过氧化酶标记的Streptavidin与生物素结合,加入酶底物OPD,出现黄色,加终止液硫酸,颜色变深,在492nm处测OD值,MMP-2/MMP-9浓度与OD值成正比,通过绘制标准曲线求出标本中MMP-2/MMP-9浓度。⑦Transwell实验:在Transwell上室的聚碳酸酯膜(直径6.5mm)上先加入1:2 (matrigel:RPMI1640)的Matrigel 60~80μl,置37℃ 30 min使Matrigel聚合成凝胶。Transwell下室中加入10%FBS的完全培养基600μl;待检细胞无血清培养基制成单细胞悬液(设复孔3个);在上室孔中加入细胞l×105个/孔,细胞悬液体积150μl,常规培养24h拭去上面的Matrigel胶,苏木素染色,200倍显微镜下计数背面穿过的肿瘤细胞数,各选8个视野,计算平均值。
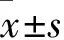
结 果
1 质粒构建结果 质粒pGenesil-1.1 的多克隆位点(MCS)如下:-MluI-hU6 promoter-Insert DNA-SacI-。送转化菌液去测序,经测序证实与设计的siRNA转录模板序列相同(见图1)。
2 Real-time PCR检测转染前后目的基因mRNA的表达(ΔCt值) PIK3R1(对照组11.993±0.163、HK组12.077±0.148、P+P组12.961±0.169),经分析P+P组与对照组和HK组比较差异均有统计学意义(P<0.01)。
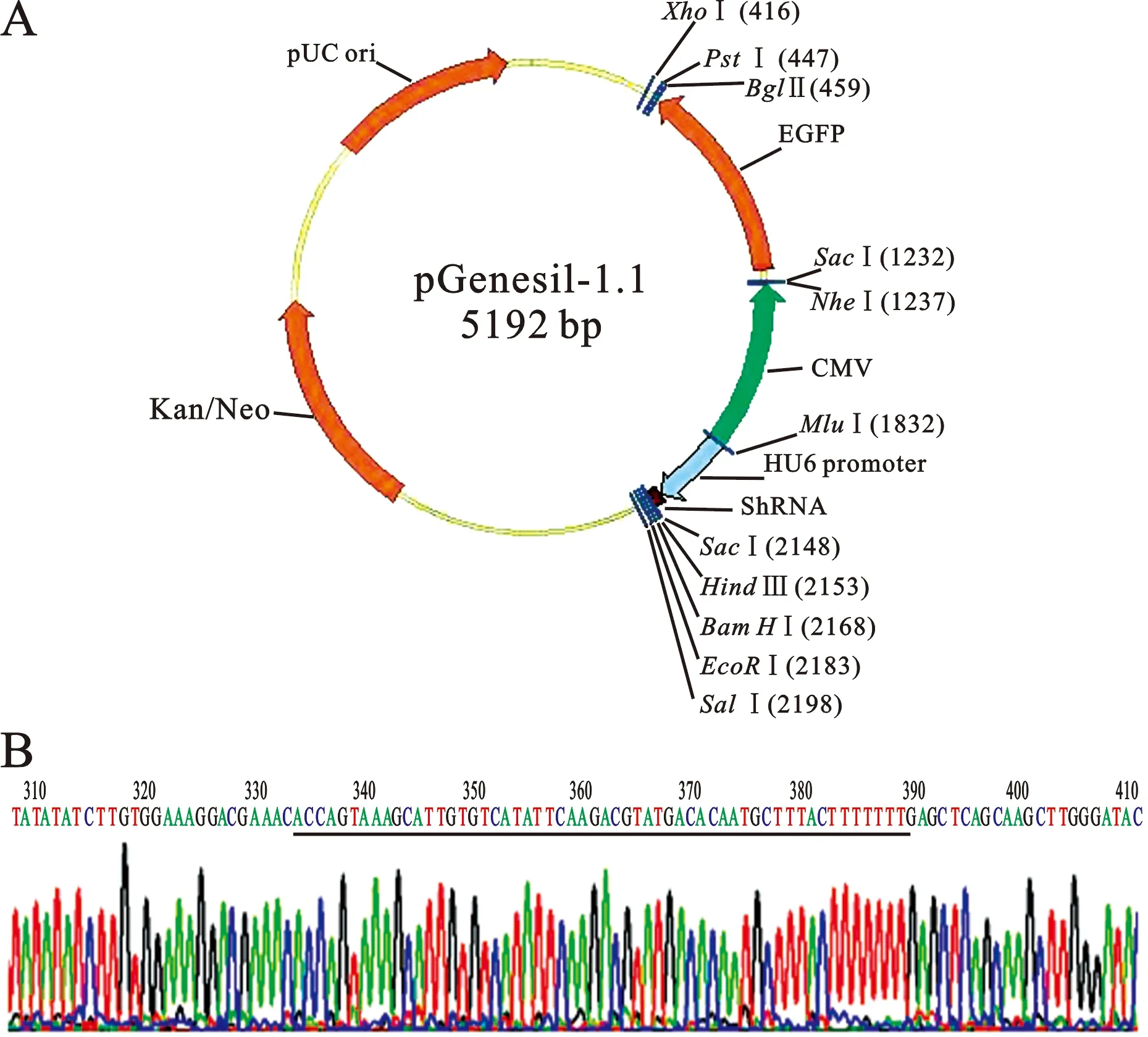
图1 质粒pGenesil-1.1模式图及重组质粒pGenesil-1.1-PIK3R1测序结果
3 Western blot检测转染前后目的基因及其相关因子的蛋白表达情况 见图2。HK组的目的蛋白条带灰度值为对照组的.PIK3R1(112.94±3.74)%;P+P组的目的蛋白条带灰度值为对照组的PIK3R1(29.06±16.17)%,表明转染后p85α的蛋白表达明显减低。P+P组的其他相关因子分别为对照组的MMP-2(28.38±7.37)%、MMP-9(42.26±9.46)%、TIMP-2(223.23±18.04)%。
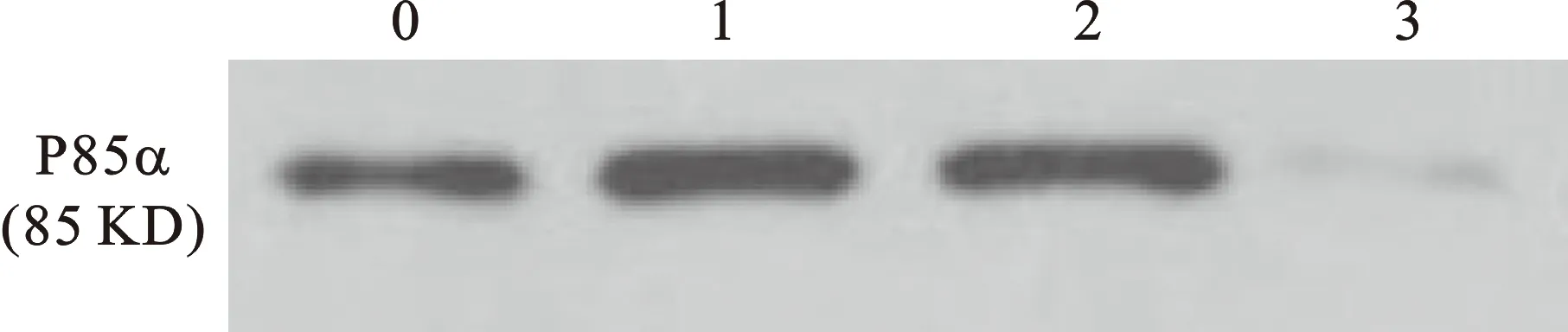
图2 p85α蛋白印迹结果
4 ELISA 根据标准曲线计算出各组培养液MMP-2浓度为对照组:(129.72±6.33)μg/L,HK组:(127.68±3.68) μg/L,转染组:(69.32±3.38)0μg/L;MMP-9浓度为对照组:(132.77±24.50) μg/L,HK转染组:(128.32±17.21) μg/L,A+P转染组:(39.94±6.07) μg/L。与对照组和HK组比较差异有统计学意义(P<0.01)。
5 Transwell实验 结果显示对照组、HK组穿过细胞数分别为(115.5±3.9)和(112.8±6.0),而P+P组为73.7±4.0)。经分析与对照组和HK组比较差异有统计学意义(P<0.01)。
讨 论
MM重要特征之一为骨髓中多部位受恶性浆细胞累及,并浸润其他器官,临床上,约有5%的MM患者进展为浆细胞白血病。由于现有的治疗手段使MM患者总的生存时间延长,因此临床上观察到MM患者髓外浸润的发生率升高[6]。虽然先进的治疗手段不断出现,但MM患者的预后仍然很差。众所周知,肿瘤细胞的侵袭能力不仅是恶性肿瘤的重要标志,还与较差的临床预后紧密相关。骨髓瘤细胞迁移是非常有害的病理过程,使细胞具有侵袭和播散能力。然而目前调节骨髓瘤细胞迁移至骨髓并侵袭其他部位的机制却知之甚少。如果这些机制能够被阐明,对于寻找新的治疗方法将有很大的帮助[7-8]。
PI3K是生长因子超家族信号传导过程中的重要分子,可被多种细胞因子和理化因素激活,调节多种细胞功能,如凋亡、增殖、代谢、生长转化、膜转运、分泌和趋化等,并在炎症、肿瘤、代谢和心血管疾病的发病机制中起重要作用[3-4]。PI3K由110kD大小的催化亚基和85kD、55 kD或50 kD大小的调节亚基构成,能够磷酸化磷脂酰肌醇上的肌醇环。PIK3R1基因负责编码调节亚基p85α,各种信号分子都需要与p85亚基结合后,才能激活PI3K,它的表达上调会引起PI3K的活性增强[5-6]。PI3K信号转导系统的基因突变、缺失,蛋白表达异常,与人类多种恶性肿瘤的发生发展、生物学行为和预后有密切关系。PIK3R1表达异常与多种血液系统恶性肿瘤密切相关[9],因此,我们选择探索下调PIK3R1的表达来抑制骨髓瘤细胞的侵袭转移的效果及可行性。
研究结果显示转染重组质粒表达载体pGenesil-1.1-PIK3R1后PIK3Rl的mRNA和蛋白表达均明显抑制,同时MMP-2、MMP-9蛋白表达水平亦下降,TIMP-2则表达上调。MMP-2、MMP-9是与肿瘤侵袭密切相关的细胞因子,它们通过降解细胞外基质促进瘤细胞的扩散和转移,TIMP则是MMPs的抑制剂,它可通过与MMPs的活化形式结合抑制基质金属蛋白酶的活性。本实验结果证实PIK3R1基因下调后TIMP-2表达上调,MMP-2、MMP-9表达下降,划痕及Transwell实验均证实瘤细胞的侵袭转移能力显著减弱。提示P13K/AKT不仅能直接调控MMP-2、MMP-9的表达,还可通过调节TIMP-2间接影响MMP-2、MMP-9的活性。
本研究结果表明,P13K信号转导通路异常激活可直接抑制MMP-2、MMP-9的表达,同时还能激活TIMP-2的表达,从而抑制MMP-2、MMP-9的活性,达到促进肿瘤细胞侵袭转移的目的。特异阻断MM中P13K信号转导通路的联合基因治疗能显著减弱MM肿瘤细胞的侵袭能力,有望成为MM基因治疗的新策略之一。
[1] Chen Y,Wang Z,Chang P,etal. The effect of focal adhesion kinase gene silencing on 5-fluorouracil chemosensitivity involves an Akt/NF-kappaB signaling pathway in colorectal carcinomas[J]. Int J Cancer,2010,127(1):195-206.
[2] Chen YL, Law PY, Loh HH. Inhibition of PI3K/Akt signaling:an emerging paradigm for targeted cancer therapy [J]. Curr Med Chem Anticancer Agents,2005,5(6):575-589.
[3] Franke TF. PI3K/Akt:getting it right matters [J]. Oncogene, 2008, 27:6473-6488.
[4] Engelman JA. Targeting PI3K signalling in cancer: opportunities, challenges and limitations [J]. Nat Rev Cancer, 2009,9(8):550-562.
[5] Elbashir SM, Lendeckel W, Tuschel T. RNA interference is mediated by 21- and 22-nucleotide RNAs [J]. Genes Dev, 2001,15(2):188-200.
[6] Lee SR,Kim SJ,Park Y,etal.Bortezomib and melphalan as a conditioning regimen for autologous stem cell transplantation in multiple myeloma[J].Korean J Hematol,2010,45 (3):183-187.
[7] de la Puente P, Muz B, Azab F,etal. Molecularly targeted therapies in multiple myeloma[J]. Leuk Res Treatment,2014,2014:976567.
[8] Kuroda J. Future therapeutic strategy for multiple myeloma through the targeting of cell signaling pathways[J].Rinsho Ketsueki,2014,55(3):295-303.
[9] Tang J, Zhu J, Yu Y,etal. A virtual screen identified C96 as a novel inhibitor of phosphatidylinositol 3-kinase that displays potent preclinical activity against multiple myeloma in vitro and in vivo[J]. Oncotarget,2014,5(11):3836-3848.
(收稿:2014-08-07)
Experimental study on targeting PIK3R1 by RNAi suppressing Multiple Myeloma invasion and metastasis in vitro
Department of Hematology,First Affiliated Hospital of Medical College of Xi’an Jiaotong University (Xi’an 710061)
Wu Di Liu Yalin Wxkl;'wertyuiop[ang Mengchang
Objective:To observe the inhibitory effects on the invasion and metastasis of Multiple Myeloma RPMI8226 cells line by small hairpin RNA targeting PIK3R1 in vitro. Methods:The recombinant plasmid vector expression vector which contained PIK3Rl shRNA was transfected into RPMI8226 cells. Real-time PCR and Western blot were used to detect the expression of P1K3Rl. ELESA was used to measure the change in the MMP-2 /MMP-9 expression.The invasion ability of the tumor cells was examined by Transwell tests.Resuits:pGenesil-1.1-PIK3R1 mediated shRNA targeting PIK3R1 dramatically down-regulated their expression in RPMI8226 cells. MMP-2 and MMP-9 were downregulated, and TIMP-2 was upregulated. The extracellular levels of MMP-2 and MMP-9 were decreased. Transwell showed that the number of cells invading through the matrigel in control, nonsense sequence.And pGenesil-1,1-PIK3R1 transfection groups were 115.5±3.9, 112.8±6.0, and 73.7±4.0 respectively. Conclusion:ShRNA targeting PIK3R1 down-regulated significantly their expression in a sequence-specific manner,and inhibited the invasion of Multiple Myeloma RPMI8226l cells in vitro.
Multiple myelom Neoplasm metastasis Gene therapy @PIK3R1
*陕西省科技攻关项目(2011k13-01-03)
▲通讯作者
多发性骨髓瘤 肿瘤转移 基因治疗 @PIK3R1
R733.3
A
10.3969/j.issn.1000-7377.2015.02.002
