MACC1基因干涉对食管癌细胞Eca109体外和体内增殖的影响
2015-03-22西安交通大学第二附属医院胸外科西安710004
西安交通大学第二附属医院胸外科(西安710004)
席俊峰△ 周 斌
MACC1基因干涉对食管癌细胞Eca109体外和体内增殖的影响
西安交通大学第二附属医院胸外科(西安710004)
席俊峰△周 斌
目的:探讨MACC1对食管癌细胞Eca109增殖的影响。方法:利用慢病毒载体介导的小发卡RNA(shRNA)干涉食管癌细胞Eca109中MACC1的表达。利用MTT法和平板克隆试验检测MACC1对食管癌细胞增殖的影响,利用流式细胞仪检测细胞周期的变化,最后利用裸鼠成瘤试验检测MACC1对食管癌细胞体内增值的影响。结果:成功建立MACC1干涉的食管癌细胞,MTT和平板克隆结果显示MACC1基因干涉后抑制食管癌细胞的增殖,并使食管癌细胞发生G1期阻滞。体内试验进一步证实MACC1干涉后抑制食管癌细胞在体内的增值。结论:干涉MACC1基因可抑制食管癌细胞的增殖。
MACC1是利用全基因组表达分析技术在结肠癌组织中发现的一个新基因[1]。研究结果显示,MACC1在很多肿瘤组织中高表达,并且与多种恶性肿瘤的发生、侵袭和转移密切相关,但其在食管癌细胞中的作用尚不清楚。本研究拟利用慢病毒建立MACC1干涉的Eca109细胞系,初步探讨MACC1基因对食管癌细胞增殖的影响。
材料与方法
1 材 料 人食管癌细胞系Eca109购自中国科学院细胞库。293T细胞由第四军医大学唐都医院胸外科钟代星博士提供。慢病毒干涉构建质粒pLKO.1-TRC control、pLKO.1- scramble shRNA、psPAX2、pMD2.G购自Addgene公司。兔抗人MACC1多克隆抗体购自abcam公司,小鼠抗人β-actin单克隆抗体购自博士德公司。RT-PCR试剂盒及引物购自Takara公司。脂质体2000和嘌呤霉素购自Invitrogen公司。
2 构建MACC1干涉的Eca109稳转细胞系 将两个MACC1 shRNA(shMACC1-1:AAGATTGGACTTGTACACTGC,shMACC1-2: AAGCTTGGAAAAGGCTGGAGG)分别导入到pLKO.1载体中[2]。按照脂质体2000说明将pLKO.1-shRNA、psPAX2、pMD2.G三种质粒按照比例转入到293T细胞内。12h后移除转染试剂,加入培养基继续培养48h并收集病毒液,0.45 μm滤器过滤。将病毒液滴入食管癌细胞Eca109中(大约70%密度),培养48h加入嘌呤霉素(1mg/ml)。经3周的筛选培养,挑出单个克隆并扩增,建立对照细胞系Eca109-SC和MACC1干涉的两组细胞系Eca109-S1和Eca109-S2。
3 RT-PCR检测各组细胞内MACC1 mRNA的表达 按Trizol试剂盒说明书分别提取各组细胞总RNA。RT-PCR反应按照试剂盒说明进行操作。MACC1引物序列:5’-CCTTCGTGGTAATAATGCTTCC-3’ ,5’-AGGGCTTCCATTGTATTGAGGT-3’。GAPDH引物序列: 5’-GCCTCAAGATCATCAGCAAT -3’,5’- AGGTCCACCACTGACACGTT -3’。反应条件为:94℃ 30s,56℃ 30s,72℃ 30 s,反应30个循环;最后72℃ 10 min,4℃保存。然后行agrose凝胶电泳,紫外灯下观察结果,并照相。
4 Western-blot检测各组细胞内MACC1 蛋白的表达 分别提取细胞的总蛋白。按照蛋白定量试剂盒说明书 BCA 法进行总蛋白定量,取 50μg蛋白质样品进行SDS-PAGE凝胶电泳后,将凝胶上的蛋白转移至 NC膜上,标记预染marker的位置。50mg/L 脱脂牛奶封闭,一抗为1∶500 稀释的抗MACC1 mAb,4℃,过夜,二抗室温孵育1h,暗室内加增强化学发光试剂 ( ECL ),X光片显影。
5 MTT检测各组细胞的增值情况 取对数生长期的Eca109-SC、Eca109-S1和Eca109-S2三种细胞分别加入到96孔板中,每孔约5×103细胞,培养基体积为200ml。每点设4个复孔,共铺7块96孔板。放置孵箱内常规培养,隔两天更换一次培养基。各组细胞接种后每24 h分别收集一次细胞样品,收集7 d;在酶联免疫仪上选择490nm波长测定吸光值。最后统计数据,绘制生长曲线。
6 平板克隆试验检测各组细胞克隆形成情况 取对数生长期的Eca109-SC、Eca109-S1和Eca109-S2三种细胞分别接种于直径为 6cm 的培养皿,每个皿接种的细胞数控制在200个左右,10ml 含每组设3个复孔。十字形晃动使细胞均匀分布。培养14d。以后每隔两天更换培养基一次。培养 14d后,当培养皿内出现肉眼可见的细胞克隆时中止培养,弃去培养基。PBS洗涤3次,加入5 ml甲醇固定15 min。弃去固定液,加入 2ml 姬姆萨应用液染色20min。用蒸馏水缓慢洗去姬姆萨染液,将培养皿放置于空气中干燥后倒置;用肉眼直接计数紫色的细胞克隆数并拍照。进行统计分析,绘制直方图。
7 流式细胞仪检测各组细胞周期的变化 取对数生长的Eca109-SC、Eca109-S1和Eca109-S2三种细胞,无血清DMEM 培养基24h,然后将培养基换成含10%胎牛血清的DMEM培养基继续培养,待细胞融合度80%~90%时收集细胞,做周期分析。细胞固定:胰酶将细胞消化下来后,用10%胎牛血清的DMEM培养基终止反应,800rpm,5min。然后PBS洗两次,70%乙醇1ml重悬细胞,充分吹匀,避免细胞形成团块。然后放置4℃冰箱过夜,离心弃去上清后用PBS洗涤细胞2次;用100 μl PBS重悬各组细胞,300 μl碘化丙啶染色液15 min。用FCM检测。细胞周期分析采用美国Becton.Diekinson公司的CellQuit Plot分析软件。
8 裸鼠成瘤试验 取对数生长期的Eca109-SC、Eca109-S1和Eca109-S2三种细胞,常规消化细胞、离心并计数,取5×106个细胞,再次离心收集细胞沉淀。用0.2ml生理盐水或者PBS重悬细胞,分别移至0.5ml的EP管内,封口膜封口。将裸鼠侧腹部皮肤消毒。用1ml注射器吸取细胞悬液,将其注射到裸鼠皮下。每天观察裸鼠一般状况及肿瘤生长情况,记录肿瘤生成的潜伏期,测量肿瘤的体积,接种细胞后第28 天,用颈椎脱臼法处死裸鼠,解剖取出瘤体。用微量天平称重,按以下公式计算肿瘤体积,肿瘤体积=长径×短径2/2,根据肿瘤体绘制肿瘤生长曲线。
9 统计学分析 使用SPSS 17.0版本统计软件对实验中所得到的数据进行统计分析。计量资料以均数±标准差表示,使用t检验,P<0.05为差异有统计学意义。
结 果
1 成功构建MACC1干涉的Eca109稳转细胞系 使用RT-PCR 方法检测MACC1 mRNA在Eca109-SC、Eca109-S1和Eca109-S2的表达,结果显示:与对照组相比,Eca109-S1和Eca109-S2细胞中MACC1 mRNA表达量显著减少(P<0.01)(图1A)。使用Western-blot方法检测MACC1蛋白在Eca109-SC、Eca109-S1和Eca109-S2的表达,结果显示:与对照组相比,Eca109-S1和Eca109-S2细胞中MACC1 蛋白表达量显著减少(P<0.01)(图1B)。

图1 各组细胞中MACC1 mRNA 和蛋白的相对变化
2 MACC1基因干涉抑制Eca109细胞的增殖 以Eca109-SC细胞为对照,利用MTT法检测Eca109-SC、Eca109-S1和Eca109-S2三种细胞的增值情况并绘制细胞生长曲线,结果显示,与对照组相比,Eca109-S1和Eca109-S2两组细胞生长明显受到抑制,具有统计学意义(P<0.05)。而Eca109-S1和Eca109-S2两组细胞之间未见明显差异(图2A)。平板克隆结果显示,经过14天的培养,Eca109- SC组克隆数为:126±12,Eca109-S1和Eca109-S2两组克隆数分别为:83±8和96±10,明显少于对照组,具有统计学意义(P<0.05)(图2B)。
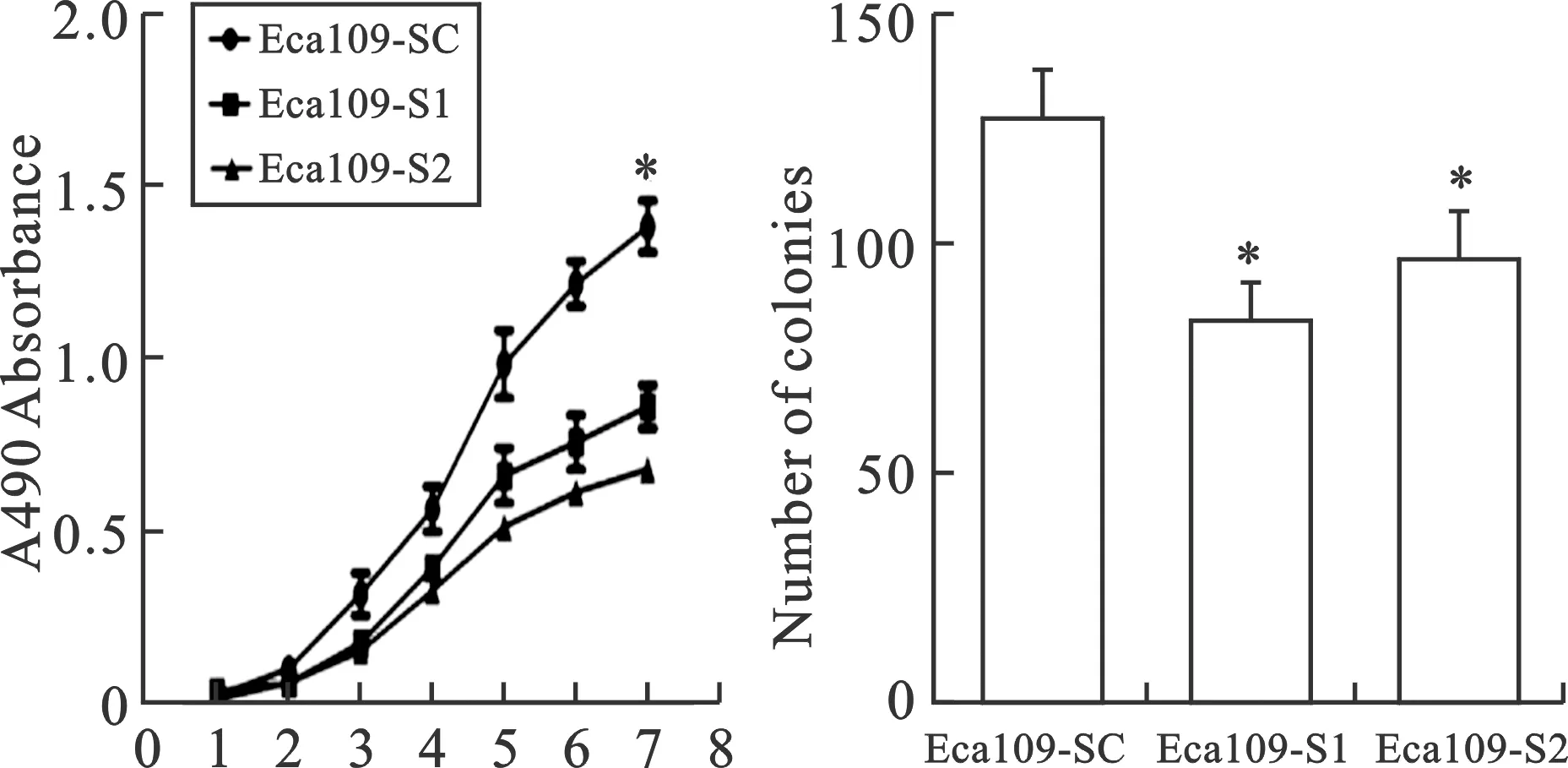
图2 MACC1干涉对食管癌细胞Eca109增殖的影响
3 流式细胞术(FCM)测定细胞周期变化 采用流式细胞术检测细胞周期,结果显示,与对照组Eca109-SC相比,Eca109-S1和Eca109-S2两组细胞G0/G1周期细胞明显增加(P<0.01),而G2/M期和S期细胞周期分部无明显差异。表明干涉MACC1后,细胞发生G1期阻滞,从而抑制了细胞的增值(图3)。
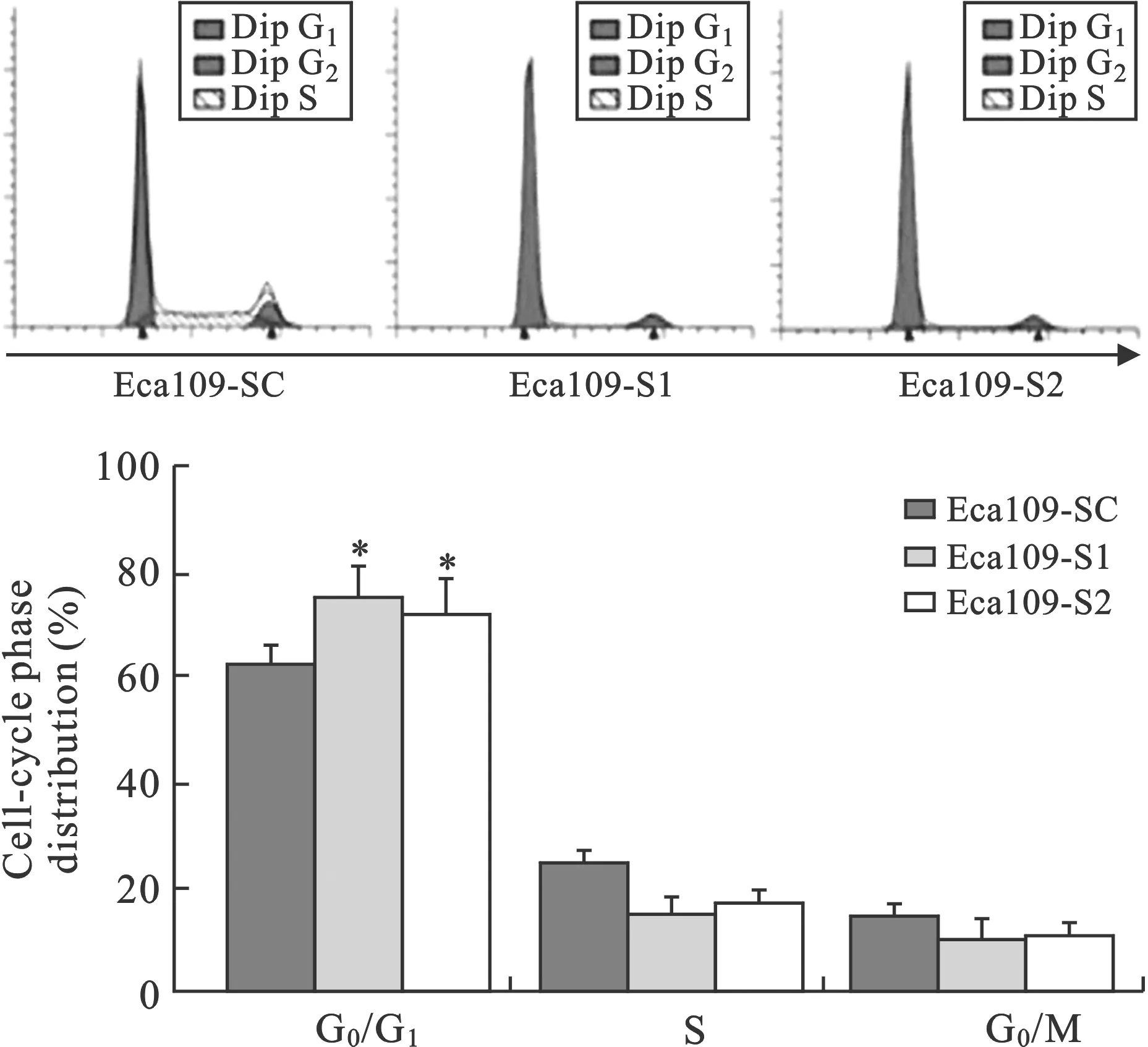
图3 MACC1干涉对食管癌细胞Eca109细胞周期的改变
4 MACC1基因干涉抑制Eca109细胞体内成瘤能力 种植Eca109-SC、Eca109-S1和Eca109-S2三组细胞的裸鼠,在接种后7d左右均形成可见的肿瘤结节,每3天使用游标卡尺测量肿瘤体积变化,Eca109-SC组肿瘤生长迅速,而Eca109-S1和Eca109-S2两组肿瘤相对较慢。接种四周后统一颈椎脱臼法处死裸鼠,解剖出肿瘤,测量体积并称重,结果显示,Eca109-S1和Eca109-S2两组肿瘤体积和重量明显小于对照组肿瘤体积和重量,具有统计学意义(P<0.05)(图4)。

图4 MACC1干涉对食管癌细胞Eca109体内成瘤的影响
讨 论
2009年Ulrike等[1]通过全基因组表达分析技术分析结肠癌的癌灶转移灶及正常结肠组织之间基因表达差异时发现一个新的基因-MACC1,发现MACC1是诊断结肠癌转移和预测结肠癌患者无病生存期的一个独立指标,并且证明MACC1通过HGF/c-Met信号转导通路促进肿瘤细胞的增值、浸润和转移。MACC1基因定位于人类7号染色体(7p21.1),由7个外显子和6个内含子构成,其cDNA序列中含2559个核苷酸序列。MACC1基因编码由852个氨基酸组成的蛋白质,其主要结构包括:SH3结构域、ZU5结构域、DD1区和DD2区结构片段[3]。进一步的实验研究表明,MACC1在多种实体肿瘤中表达增高,比如:胃癌、肝癌[4]、肺癌[5]和卵巢癌[6]等,并且能够很好地预测患者的预后。在胰腺癌患者的血清中,与健康人相比,MACC1的蛋白水平明显升高,并MACC1的蛋白水平与肿瘤的TNM分期,淋巴结转移和远处转移密切相关。在胰腺癌细胞中干涉MACC1的表达后,可明显抑制细胞的增值、转移以及EMT,而且MACC1可作为吉西他滨治疗胰腺癌效果的预测分子,提示MACC1可能有助于胰腺癌的个体化治疗[7]。王建军等[8]报道MACC1蛋白在食管癌组织
中的表达水平高于癌旁组织,MACC1蛋白的表达水平与食管癌的TNM分期和淋巴结转移及分化程度显著相关,提示MACC1的异常表达与食管癌的发生、发展密切相关。
本实验利用慢病毒载体成功构建MACC1基因干涉的Eca109稳转细胞系,为深入研究MACC1基因在食管癌的作用提供了试验基础。MTT试验和平板克隆试验结果显示食管癌细胞Eca109中MACC1基因干涉后,其生长速度以及克隆数明显下降,提示干涉MACC1基因可抑制食管癌细胞Eca109的增殖能力。细胞周期分析结果显示MACC1通过使食管癌细胞发生G1期阻滞,从而抑制细胞的增殖。体内试验进一步证实:干涉MACC1基因可抑制食管癌细胞Eca109在裸鼠体内的成瘤能力。综合上述研究,提示MACC1有可能成为食管癌基因治疗的一个新靶点。其分子机制还需要我们进一步研究。
[1] Stein U.MACC1, a newly identified key regulator of HGF-MET signaling, predicts colon cancer metastasis[J].Nat Med, 2009,15(1):59-67.
[2] Xu CS.MSP58 knockdown inhibits the proliferation of esophageal squamous cell carcinoma in vitro and in vivo[J]. Asian Pac J Cancer Prev, 2012,13(7):3233-3238.
[3] 蔡新生 ,闫朝光,王广春,等.MACC1基因在胃癌中的表达及临床意义[J]. 医药前沿, 2012(24):209.
[4] 刘清泉,刘青光,昝献峰,等.MACC1基因在肝细胞癌中的表达及临床意义[J].华中科技大学学报:医学版, 2010,39(1):22-24,28.
[5] Shimokawa H.Overexpression of MACC1 mRNA in lung adenocarcinoma is associated with postoperative recurrence[J]. J Thorac Cardiovasc Surg, 2011,141(4):895-898.
[6] Zhang R.Effects of metastasis-associated in colon cancer 1 inhibition by small hairpin RNA on ovarian carcinoma OVCAR-3 cells[J]. J Exp Clin Cancer Res, 2011,30:83.
[7] Wang G.MACC1:A potential molecule associated with pancreatic cancer metastasis and chemoresistance[J]. Oncol Lett, 2012, 4(4),783-791.
[8] 王建军,洪 强,胡丛岗,等.结肠癌转移相关基因1蛋白在食管癌组织中的表达及其意义[J].中华医学杂志,2013, 93(32):2584-2586.
(收稿:2014-03-10)
△陕西省榆林市第一医院
食管肿瘤 基因表达调控,肿瘤 细胞增殖 @MACC1基因
R735.1
A
10.3969/j.issn.1000-7377.2015.02.005
