鱿鱼(Squid)肝脏蛋白酶解物中ACE活性抑制肽的分离纯化及活性分析*
2015-03-22俞群娣
梁 佳 谢 超 林 琳 黄 菊 王 婷 俞群娣
(浙江省海产品健康危害因素关键技术研究重点实验室 浙江海洋学院食品与医药学院 舟山 316022)
鱿鱼产量巨大, 全世界有中国、挪威等超过 60个国家和地区从事鱿鱼捕捞加工生产, 而鱿鱼的消费和利用也以这些国家和地区为主(李桂芬, 2003)。在鱿鱼加工过程中产生大量的下脚料(袁亚辉等,2002)。主要包括内脏, 皮、头等废弃物, 这些物质通常被利用加工成鱼粉或者作为废弃物掩埋, 产品附加值低, 不利于鱿鱼加工行业的发展, 而且造成环境污染(王建中等, 1999; 陈意, 2006)。国外对鱿鱼加工下脚料的利用主要通过生物技术对其进行处理, 加工成各种高营养蛋白食品, 使其蛋白质资源充分利用(FAO, 1998)。在国内鱿鱼肝脏的利用仅有鱿鱼肝脏干粉的加工, 并且是用作饲料, 技术水平不高(秦玉青等, 2002; 赵红伟, 2003)。鱿鱼肝脏中分离提取的各种生物活性肽(程云辉等, 2001), 作为消化吸收效率更高的蛋白质水解产物, 不仅可应用于食品和饲料行业, 而且还可应用于疾病的防治, 为维护人类的健康作出贡献(Morimuraet al, 2002)。
由于鱿鱼肝脏中蛋白质分解后的氨基酸组成有较大的差别, 没有一个完整的模式可以探寻, 导致氨基酸小肽的分离难度较大。为此, 针对鱿鱼肝脏蛋白氨基酸的特点, 建立一套适合鱿鱼肝脏中降血压活性肽的分离技术就显得尤为必要(陈吉球, 1997; 吴建平等, 1998; 赵海珍等, 2004)。传统常用的分离技术主要包括膜分离技术, 微滤技术, 高效液相色谱技术等等(何海伦等, 2004)。而在进行抑制肽的分离提取方面, 一般采用几种方法相结合(文允镒, 1996; 薛向阳等, 2004)。从鱿鱼肝脏中可以提取出消化吸收率更高的蛋白质水解产物, 提取的活性肽可以用作癌症等疾病的治疗, 为人类的医药事业做出了巨大贡献(Erdöset al, 1987; Liet al, 2004)。本研究利用鱿鱼肝脏蛋白为原料, 采用各种分离纯化技术提取出降血压活性肽等物质, 为鱿鱼肝脏在保健食品和药品等方面的应用提供了理论依据(Linzet al, 1995; Voorset al, 1998), 研究成果将实现鱿鱼肝脏等废弃物得以综合利用, 减少大气环境污染, 具有重要的研究意义。
1 材料与方法
1.1 材料与仪器
原料与试剂: 冷冻鱿鱼肝脏, 由舟山兴业集团公司提供, 放置于低温冰箱冷冻保存, 保存温度为–18°C。ACE 酶、特丁基对苯二酚(TBHQ)、底物Hip-His-Leu、丙酮、硼酸盐缓冲液(pH 8.3)、TFA溶液、甲醇、茚三酮、浓盐酸、胃蛋白酶、乙腈等。
实验设备: 高效液相色谱仪 LC600(南京科捷分析仪器有限公司)、分析天平AL104、超滤器labscale、酶解罐、pH计、高温炉、冷冻离心机 CF16RX、紫外检测仪、超级恒温水浴锅等。
1.2 酶解条件的优化
在(36±1)°C, pH 2.0, 加酶量为 2%, 底物浓度为2.5%的条件下, 研究酶解时间对鱿鱼肝脏蛋白水解的效果, 测定ACE活性肽的含量。
酶解底物浓度的确定: 在温度为 36°C, pH 2.0,酶与底物的比为 2%的条件下, 研究酶解时间对鱿鱼肝脏蛋白水解的效果, 测定ACE活性肽的含量。
酶制剂添加量的确定: 在温度为 37°C, pH 2.0,底物浓度为 2.5%的条件下, 研究酶解时间对鱿鱼肝脏蛋白水解的效果, 测定ACE活性肽的含量。
1.3 酶解液的制备
将鱿鱼肝脏和水分按照1︰3的比例要求进行混合, 在混合过程中通入氮气, 防止其被氧化变质, 同时加入适量的抗氧化剂 BHA, 放入高压锅(121°C,0.5Mpa)中处理20min后, 在5000 r/min的条件下离心15min, 去掉最上层的鱼油后, 用丙酮进行处理, 真空干燥后获得鱿鱼肝脏蛋白, 后添加 2%的胃蛋白酶酶解20h, 酶解的条件为底物浓度2%、酶解温度36°C及酶解 pH 2.0。最后酶解终止, 以 90°C 条件保持15min为佳, 除去分子量高于20kDa以上的产物。收集水解产物后置于4°C冰箱中保藏。
1.4 抗压肽抑制活性的测定
参考Cheung和Cushman介绍的方法对抗压活性肽的抑制活性进行测定(Cushmanet al, 1971)。
ACE抑制率(%)=(对照品种马尿酸的峰面积–样品中马尿酸的峰面积)/对照品种马尿酸的峰面积×100%
1.5 蛋白酶解液水解度的测定
取酶解液稀释处理后加入缓冲溶液, 在水浴锅中加入处理20min, 在280nm下测光密度值。以蒸馏水做对比, 在上述波长下进行光密度的测定, 将去掉空白后的光密度带入标准曲线算出蛋白质含量, 水解度(DH%)的计算公式如下:
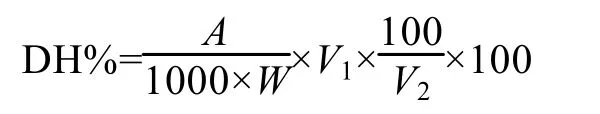
式中:A为蛋白质含量(mg),W为样品重量(g),V1为水解液的总体积(mL),V2为显色时所用稀释液体积(mL)。
1.6 降血压活性肽抑制肽的分离及抑制活性分析
采用超滤对酶解液中的分子进行处理, 主要截留分子量为20kDa以上的分子, 将收集到的超滤液保藏于4°C备用。然后采用Sephadex G-100对超滤液进行分离, 提取抗压活性肽, 并测定其活性。同样地,用上述凝胶柱对超滤冻干样品配成的溶液进行分离,蒸馏水洗脱, 流速为26滴/min, 在280nm波长下测定抗压肽的活性。最后将具有降血压活性肽的分子用DEAE阴离子交换柱分离。取适量超滤样品用蒸馏水洗脱, 用0—1 mol/L NaCl溶液线性洗脱, 流速26滴/min,并测定各降血压活性肽活性。最后取活性最高的活性肽用Sephadex LH-20继续分离, 洗脱液为30%的甲醇溶液, 流速16滴/min, 并测定各降血压活性肽活性。
2 结果与讨论
2.1 胃蛋白酶酶解鱿鱼肝脏蛋白的优化
2.1.1 底物浓度对蛋白酶解效果的影响 由图 1可知, 在底物浓度为 1.0%—2.5%的范围时, 随着底物浓度的增加, 蛋白酶水解度也逐渐增大, 而当底物浓度在2.5%—10.0%的范围时, 底物浓度的上升反而使得蛋白酶水解度降低, 可能的原因是, 底物的增多使得蛋白酶像被包裹起来一样, 与底物接触就越发变得困难, 从而降低了水解度。从图1中还可以看出,底物浓度对 ACE的抑制率并没有太大的影响, 同时考虑水解度和对 ACE的抑制率, 将底物浓度确定为2.5%。

图1 底物浓度对水解度和ACE抑制活性的影响Fig.1 Influence of substrate concentration density on hydrolysis degree and ACE inhibitory activity
2.1.2 酶解时间对酶解效果的影响研究 反应时间为 2—22h时, 随着酶解时间的增加, 蛋白水解度也逐渐增大(图2), 超过22h后, 随着酶解时间的延长,蛋白水解度的增加趋势有所降低, 增加得更慢了; 从图 3中还可以看出, 酶解时间对 ACE的抑制率没有显著性的影响, 同时考虑水解度和 ACE的抑制率,将酶解时间确定为22h。
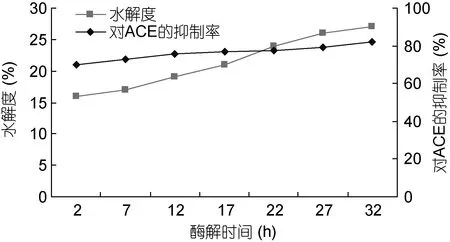
图2 酶解时间对水解度和ACE抑制活性的影响Fig.2 Influence of enzymolysis time on hydrolysis degree and ACE inhibitory activity
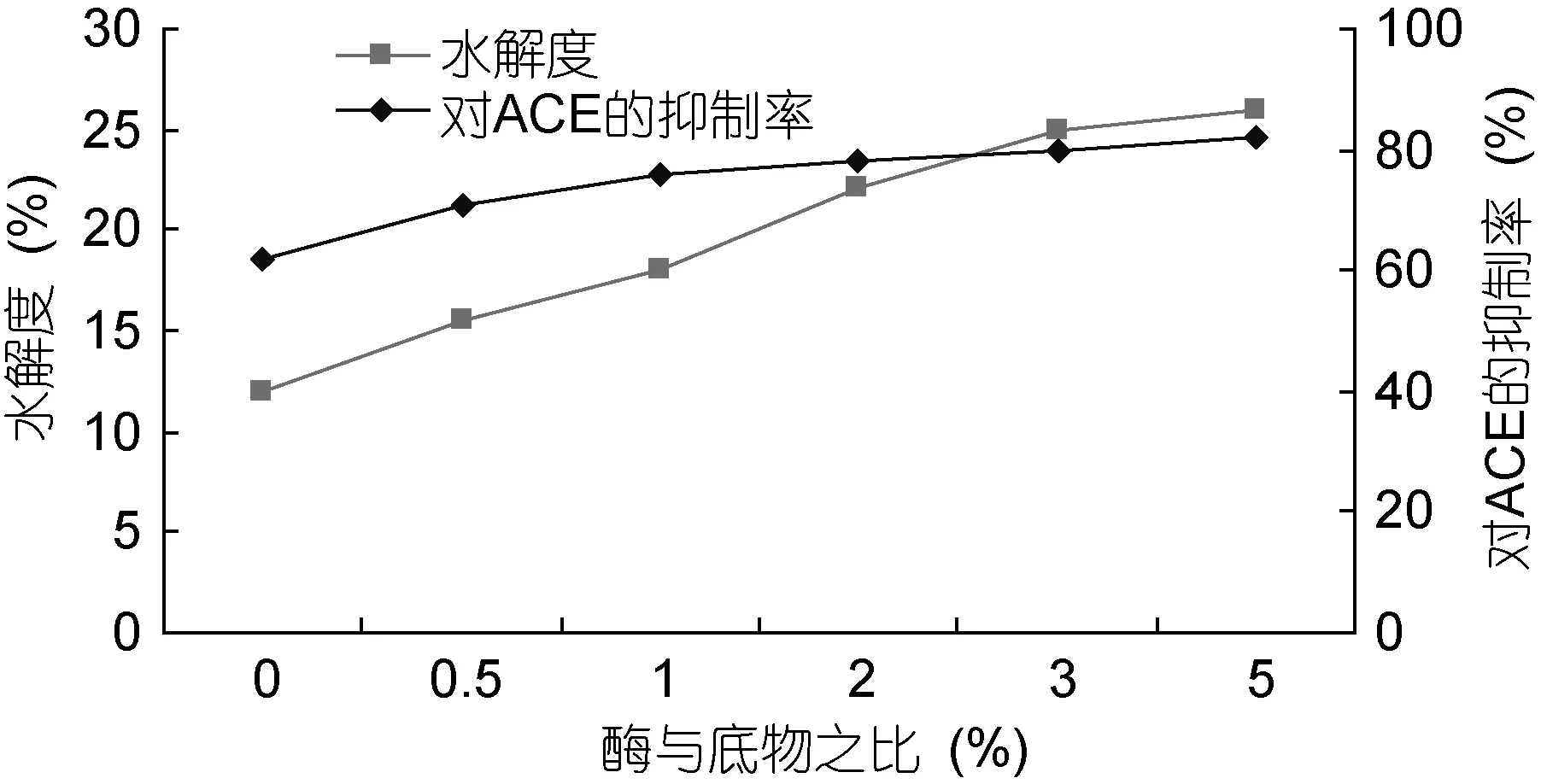
图3 酶与底物比对水解度和ACE抑制活性的影响Fig.3 Influence of ratio of enzyme and the substrate on hydrolysis degree and ACE inhibitory activity
2.1.3 酶与底物比对蛋白酶解效果的影响 从图3可知, 当酶与底物比在 0%—2%的范围时, 水解度与酶和底物比的变化呈正相关, 而酶和底物比在2%—5%时, 水解度随着酶和底物比的升高增加的速度有所降低, 这是因为酶浓度越高, 其与蛋白质接触的可能性越高, 底物就越容易转化成底物肽。由图 3也可看出, ACE抑制率受酶与底物比的影响不明显,综合考虑二者, 将酶与底物比确定为2%。
2.2 降压活性肽的初步分离
采用 Sephadex G-100初步分离鱿鱼肝脏蛋白酶解液, 出现5个峰值, 如图4所示峰值组分一、组分二、组分三、组分四、组分五。对五个组分分别进行收集、真空浓缩、冷冻干燥, 并测定每个组分的抑制活性。
如表1所示, 组分一、组分二、组分三洗脱下来的蛋白具有降血压抑制活性, 其 IC50分别为: 2.28、1.92、5.02mg/mL。结果表明: 分子量较大的多肽, 其ACE抑制活性较好。选取粗分物中活性最高的组分(组分二), 对ACE抑制活性相关参数进行分析。
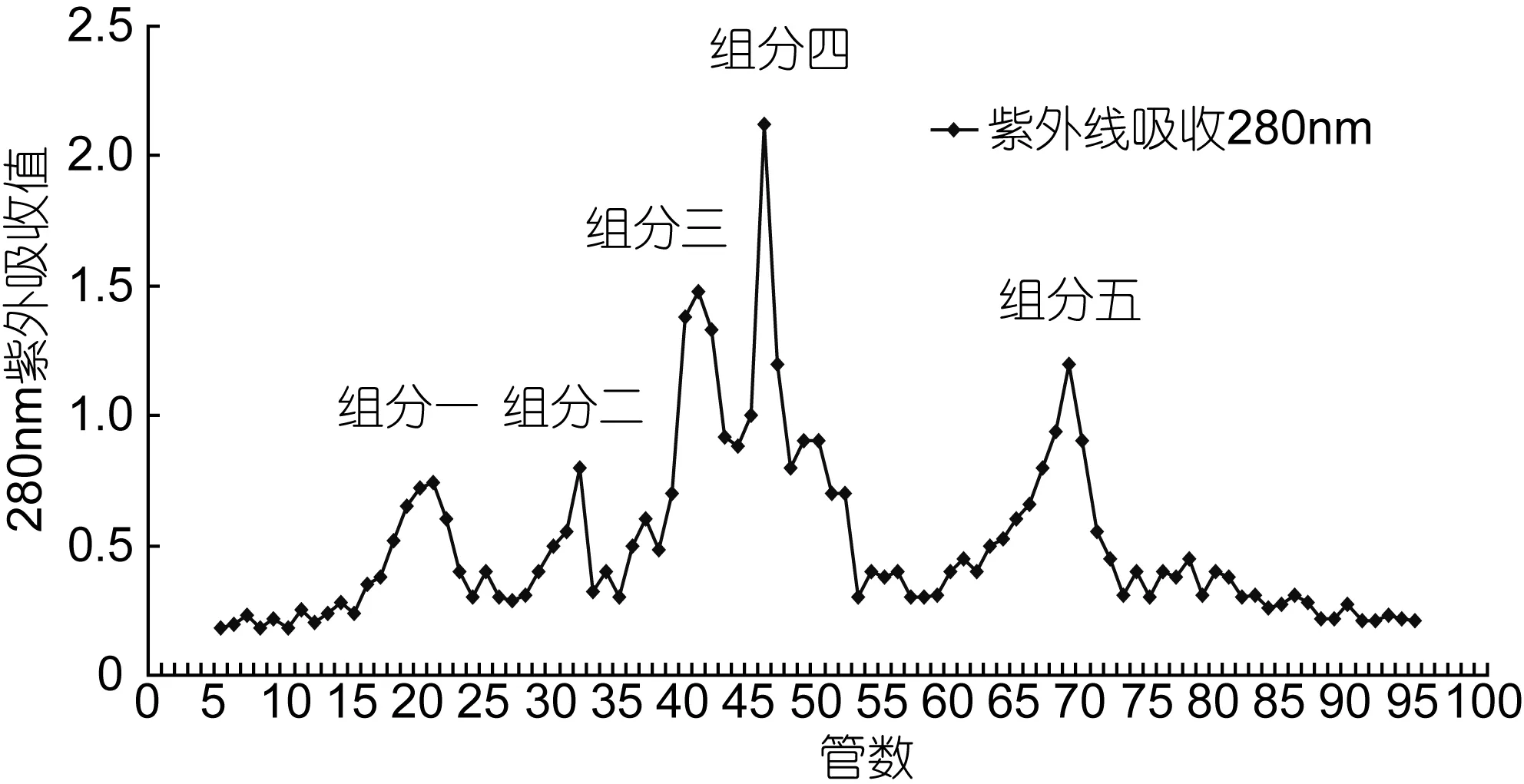
图4 酶解液在Sephadex G-100上的洗脱峰值Fig.4 Hydrolyzate in Sephadex G-100 on the elution diagram

表1 Sephadex G-100初步分离各组分ACE抑制活性和回收率Tab.1 The ACE inhibitory activity and returns-ratio of various components initially separated by Sephadex G-100
2.3 组分二中降血压肽抑制活性分析
2.3.1 组分二的理化稳定性考察研究 对鱿鱼肝脏蛋白用Sephadex G-50洗脱后得到的粗分物组分二的理化稳定性进行考察。图5、图6分别为不同温度和不同 pH对组分二的 ACE抑制活性的影响。结果显示, 组分二的溶液在温度 0—100°C、pH 值 1—12之间对ACE的抑制活性基本没有变化, 比较稳定。
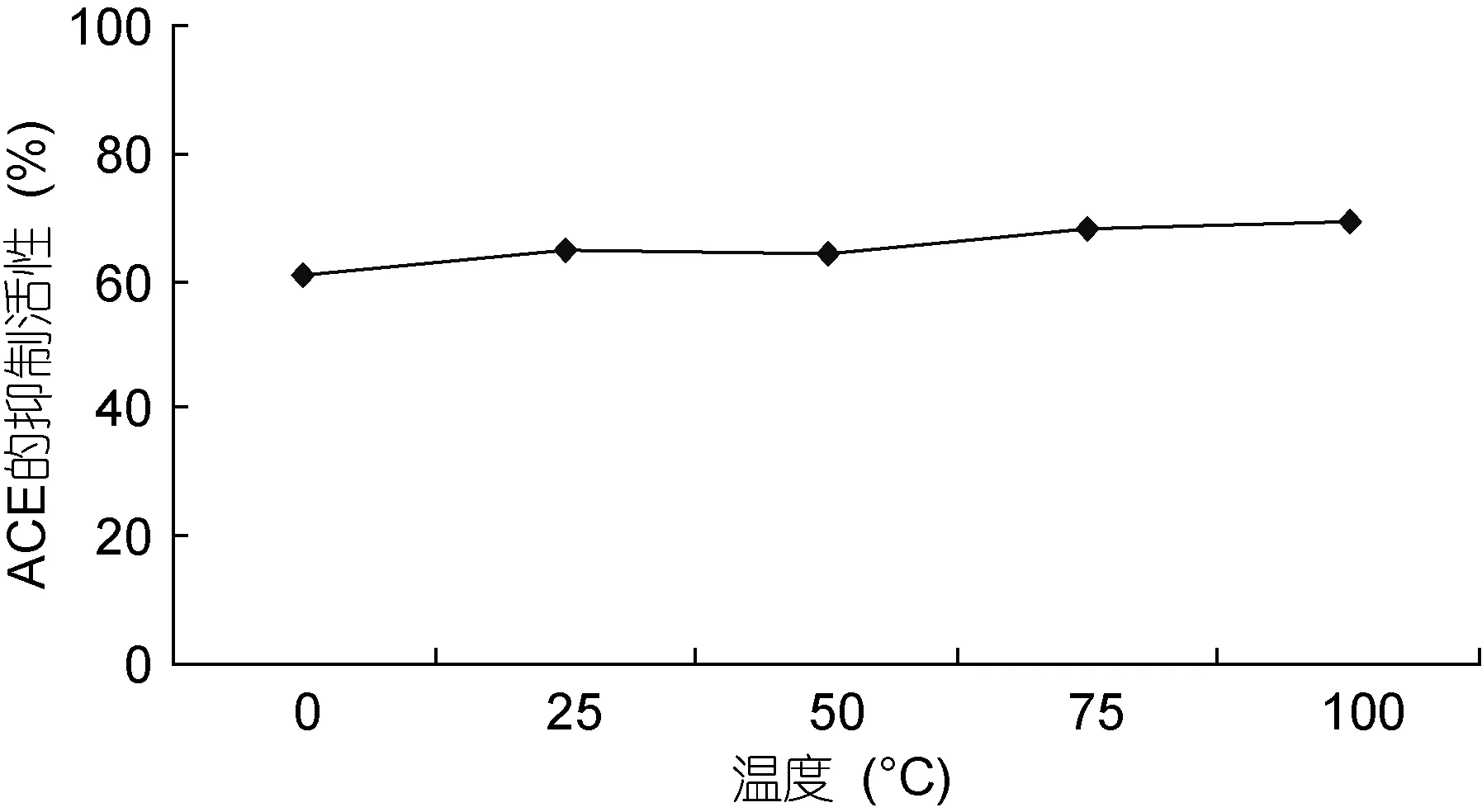
图5 温度对组分二抑制活性影响Fig.5 Temperature on the inhibitory activity of Component 2
2.3.2 模拟胃肠环境消化实验 ACE抑制肽在被人体摄入以后要经过胃肠消化道才能被吸收, 因此有必要研究模拟胃肠消化对组分二的 ACE抑制活性的影响。在本实验中, 选择组分二的样品浓度为1.80 mg/mL, 模拟消化实验, 检测各酶解反应后酶解液的ACE抑制活性, 结果如表2所示。
从表 2中可以看出, 粗分物组分二的 ACE抑制活性在经过胃蛋白酶消化2h后, ACE抑制活性有一些提高, 但总体来说, 模拟胃肠消化对 ACE抑制活性的影响不大, 粗分物组分二经过胃肠消化后仍具有较高的ACE抑制活性。

图6 pH对组分二的抑制活性影响Fig.6 pH on the inhibitory activity of Component 2
2.4 DEAE阴离子交换柱分离纯化ACE抑制肽
选择用适合生物大分子等物质分离的 DEAE阴离子交换柱对组分二分离纯化, 洗脱得到了两个峰值, 分别标注为组分六和组分七, 见图 7。其中第 1个峰值处显示抑制 ACE的活性较高, 且回收率高,标记为组分六。继续收集组分六。通过 Sephadex LH-25继续分离, 洗脱得到2个峰, 标记为组分八和组分九, 其半抑制浓度(IC50)分别为 1.58mg/mL和2.12mg/mL, 如图8。检测这两部分的ACE抑制活性,结果表明ACE的抑制活性大致相同。

表2 模拟胃肠消化对组分二的ACE抑制活性的影响Tab.2 Influence of simulated gastrointestinal digestion on the ACE inhibitory activity of Component 2
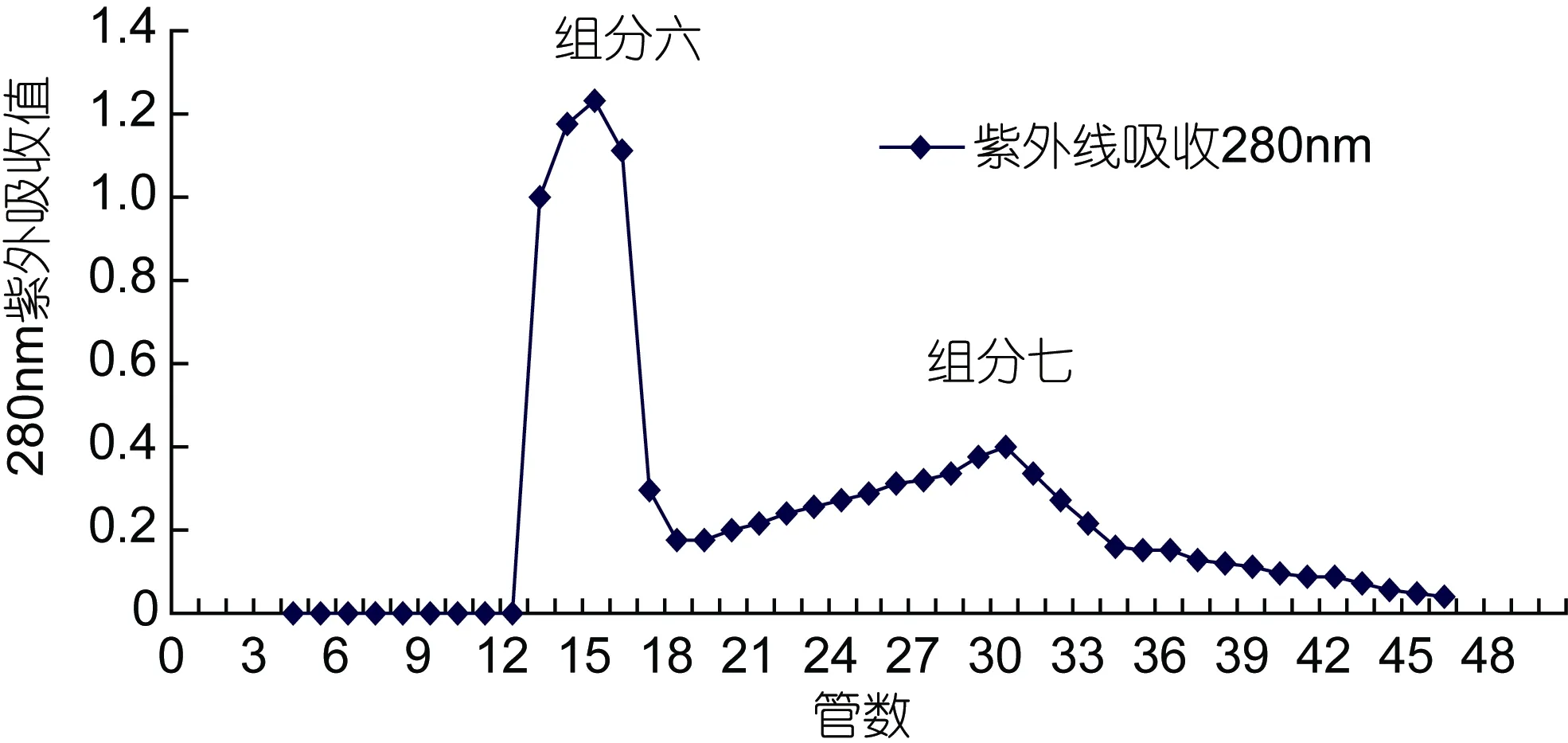
图7 粗分物组分二在DEAE阴离子交换柱上的洗脱图Fig.7 The elution diagram of crude components of Component 2 on DEAE anion exchange column
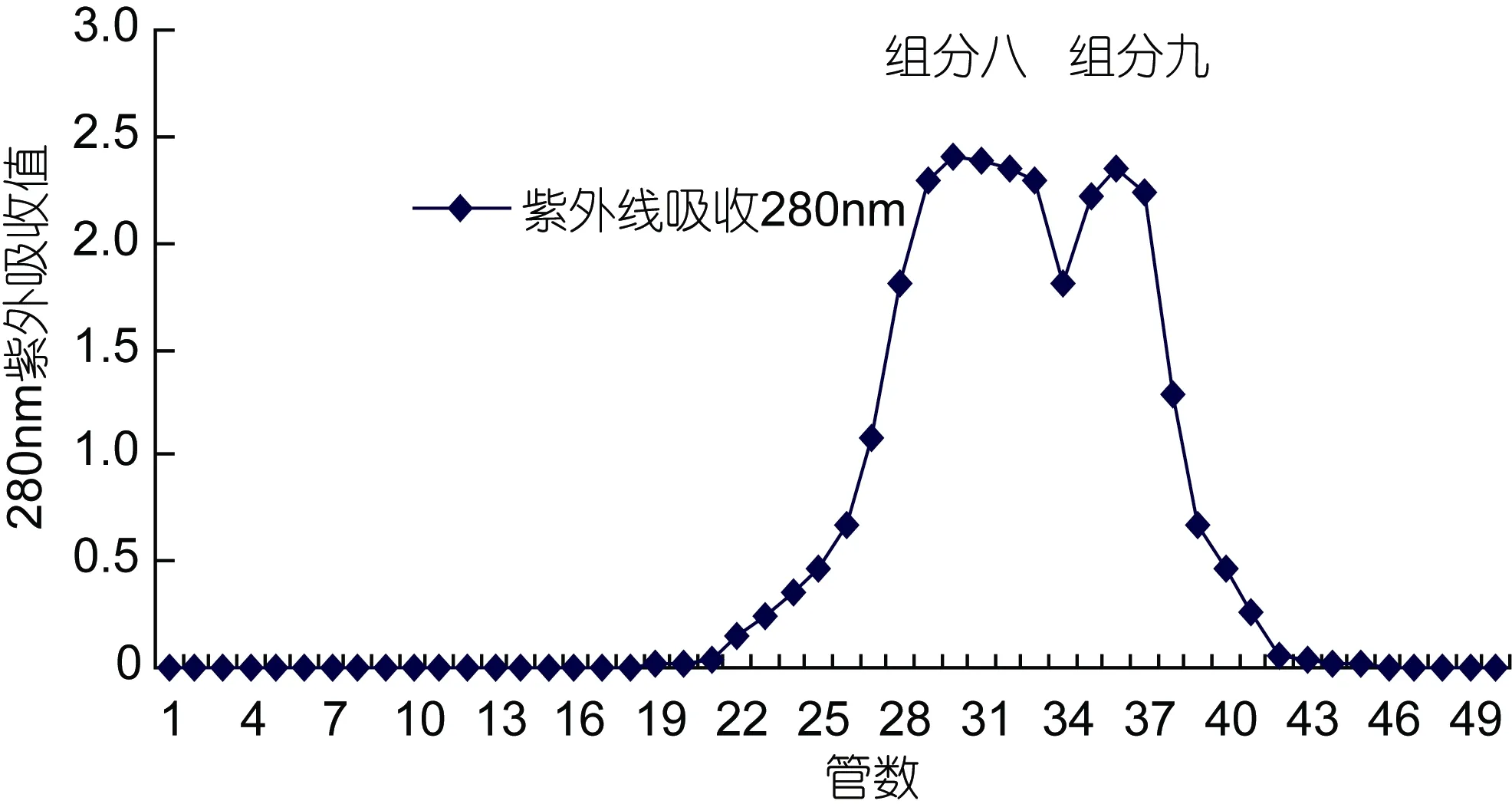
图8 组分六在Sephadex LH-20上的洗脱图Fig.8 The elution diagram of Component 6 in Sephadex LH-20
3 结论
本文对鱿鱼加工下脚料进行综合利用研究, 将提取鱼油后的鱿鱼肝脏蛋白用丙酮处理除脂, 选择蛋白酶进行酶解, 将酶解液进行超滤处理后, 跟踪其ACE抑制活性, 应用凝胶过滤层析等方法分离纯化ACE抑制肽。主要结论如下: (1) 将鱿鱼肝脏蛋白的酶解液经过截留分子质量为 20kDa的滤膜经过超滤处理后, 用 Sephadex G-100葡聚糖凝胶柱初步分离,洗脱得到 5个洗脱峰, 其中粗分物组分二的 ACE抑制活性较高, 其IC50为1.92 mg/mL。(2) 对粗分物组分二的 ACE抑制活性相关参数分析, 结果表明: 组分二的溶液在温度0—100°C、pH 1—12之间对ACE的抑制活性基本没有变化, 比较稳定。而且模拟胃肠消化实验对粗分物组分二的ACE抑制活性的影响不大, 经过胃肠消化后仍具有较高的ACE抑制活性。(3)用DEAE阴离子交换柱和Sephadex LH-20对组分六继续分离纯化, 分离得到为组分八和组分九, 其半抑制浓度(IC50)分别为1.58mg/mL和2.12mg/mL。
王建中, 吕玉英, 徐正瑛, 1999. 鱿鱼内脏的综合利用研究.中国海洋药物, (1): 55—58
文允镒, 1996. 浅谈血压及高血压. 生物学通报, 31(10):18—20
李桂芬, 2003. 鱿鱼的营养与开发利用. 科学养鱼, (7): 56
吴建平, 丁霄霖, 1998. 食品蛋白质降血压肽的研究进展. 中国粮油学报, 13(5): 10—14
何海伦, 陈秀兰, 孙彩云等, 2004. 血管紧张素转化酶抑制肽的研究进展. 中国生物工程杂志, 24(9): 7—11
陈 意, 2006. 鱿鱼的营养及食用价值. 食品与药品, 8(6A):75—76
陈吉球, 1997. 血管紧张素转换酶. 桂林医学院学报, 10(1):131—134
赵红伟, 2003. 鱿鱼肝脏的综合利用——鱿鱼肝脏在虾饲料中的应用研究. 大连: 大连海洋大学硕士学位论文
赵海珍, 陆兆新, 刘战民, 2004. 天然食品来源的血管紧张素转换酶抑制肽的研究进展. 中国生化药物杂志, 25(5):315—317
秦玉青, 刘承初, 王 慥, 2002. 鱿鱼皮胶原蛋白的测定与回收.上海水产大学学报, 11(2): 138—144
袁亚辉, 姚美君, 2002. 利用鱿鱼内脏生产海味素的研究. 现代渔业化, (1): 27—28
程云辉, 文新华, 2001. 生物活性肽制备的研究进展. 食品与机械, (4): 4—7
薛向阳, 孔繁东, 祖国仁等, 2004. 食品抗高血压肽的研究进展和前景分析. 食品研究与开发, 25(6): 28—30, 33
Cushman D W, Cheung H S, 1971. Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung. Biochemical Pharmacology, 20(7): 1637—1648
Erdös E G, Skidgel R A, 1987. The angiotensin I-converting enzyme. Laboratory Investigation, 56(4): 345—348
FAO, 1998. Fishery Statistics: Capture Production, FAO Yearbook, 86(1)
Li G H, Le G W, Shi Y Het al, 2004. Angiotensin I-converting enzyme inhibitory peptides derived from food proteins and their physiological and pharmacological effects. Nutrition Research, 24(7): 469—486
Linz W, Wiemer G, Gohlke Pet al, 1995. Contribution of kinins to the cardiovascular actions of angiotensin-converting enzyme inhibitors. Pharmacological Reviews, 47(1): 25—49
Morimura S, Negate H, Uemura Yet al, 2002. Development of an effective process for utilization of collagen from livestock and fish waste. Process Biochemistry, 37(12): 1403—1412
Voors A A, Pinto Y M, Buikema Het al, 1998. Dual pathway for angiotensinⅡ formation in human internal mammary arteries. British Journal of Pharmacology, 125(5): 1028—1032
