不同麻醉方式对患者围术期核心温度的影响
2015-03-22胡惠静雷勇静刘小彬
胡惠静,雷勇静,刘小彬
(1.皖南医学院第一附属医院;2.芜湖市第二人民医院麻醉科,安徽芜湖 241000)
36℃的现象[1-2]。近年来,已有大量研究探讨可能引起围术期体温下降的原因,如环境温度、手术时间和类型、麻醉药物和麻醉方式、静脉输液或血制品、患者体质差等[3-4]。围术期严重低体温可引发一系列不良事件,如使麻醉苏醒延迟[5]、术后寒颤不适[6]、增加切口感染风险[7]、甚至引发心血管事件[8],影响患者预后。然而,现有研究中关于围术期体温变化趋势的研究却很少。本研究主要了解不同的麻醉方式对患者核心温度的影响,观察围术期核心温度的变化趋势,为有效的预防围术期低体温发生提供临床依据。
1资料与方法
1.1 一般资料 选择2014年9月至2015年4月择期开腹手术患者100例,随机分为单纯全身麻醉组(GA组,n=50)和全麻复合硬膜外麻醉组(GEA组,n=50)。排除标准:手术时间小于2 h、影响鼓膜温度测量的手术;患有中枢性高热、体温调节异常疾病、感染性发热、术前3 d核心体温>38℃以及耳道疾病的患者。
1.2 麻醉方式 两组均不用术前药,入室开放静脉后,输入室温下液体10 mL·kg-1·h-1。GEA组根据手术范围选择硬膜外穿刺点,穿刺成功后注入2%利多卡因4 mL实验剂量,观察无不良反应,5 min后分次追加1%利多卡因+0.1%丁卡因混合液5 mL,平面确定后行全麻诱导。两组诱导方式相同:咪达唑仑 0.05 mg·kg-1,舒芬太尼 0.4 μg·kg-1,丙泊酚1.5 ~2 mg·kg-1,罗库溴铵0.6 mg·kg-1。诱导后插气管导管控制呼吸。术中GEA组患者每隔50 min硬膜外推注1%利多卡因+0.1%丁卡因混合液5 mL,GA组患者持续静脉输注瑞芬太尼 0.1 ~0.2 μg·kg-1·min-1,其余麻醉维持方式相同,均持续静脉泵注丙泊酚4~8 mL·kg-1·h-1,顺式阿曲库铵 0.1 mg·kg-1·h-1,根据心率血压变化间断推注舒芬太尼。手术结束前30 min停肌松药,开始缝皮时停丙泊酚,术毕时停瑞芬太尼,患者清醒拔管后转入PACU,观察其寒战发生情况。
1.3 室温控制和体温测量方法 术前30 min将手术室温度调至24℃,术中根据需要调节温度(24±1.0)℃。在术前等候期间和术后PACU恢复期间,患者身上均覆盖棉被保温,术中统一覆盖无菌被单。术中除体腔冲洗液加温至37℃外,其余液体如静脉输液、消毒液均于室温保存,需输血者将血液加温至室温输入。以鼓膜温度作为核心温度,分别于麻醉诱导前、诱导后5 min、诱导后每隔30 min至术毕、术毕即刻以及出室(离开PACU)时测同一侧鼓膜温度。所有点的温度均测量3次,每次测量时间间隔10 s,取平均值。
1.4 记录指标 (1)、患者的一般情况,包括性别、年龄、体重、BMI指数,手术时长、麻醉时长、环境温度、液体出入量和体腔冲洗量。(2)、两组患者诱导前、诱导后5 min、诱导后每隔30 min至术毕、术毕即刻以及出室各时点的鼓膜温度,最大温差(术前体温-术中最低体温)。(3)、围术期低体温发生率、PACU期间寒战发生率。
1.5 统计学方法 采用SPSS17.0软件行统计学分析。计量资料以均数±标准差(x±s)表示,组间比较采用t检验,组内比较采用重复测量数据方差分析,计数资料比较采用χ2检验。
2 结果
两组患者中,除GEA组有一例患者术毕直接带管送入ICU无法观察术后寒战发生情况外,其余所有患者均完成试验。
2.1 两组患者的一般情况和手术基本情况比较 差异无统计学意义(P >0.05),见表1。
2.2 两组术中鼓膜温度比较 与诱导前比较,两组患者诱导后30 min开始至出室各时点体温均下降,差异有统计学意义(P<0.05);组间比较,两组患者各对应时间点体温差异无统计学意义(P>0.05)。监测过程中,两组患者鼓膜温度变化趋势相同,呈3个时相:诱导后1.5 h内体温下降,1.5 ~2.5 h 处于相对稳定状态,2.5 h 后,开始缓慢回升,至出室时回升到接近诱导前水平。两组的最大温差比较无统计学差异(P=0.50)见表2;变化趋势见图1。

表1 两组患者的一般情况和手术基本情况比较(x±s)

表2 两组术中鼓膜温度比较(℃,x±s)
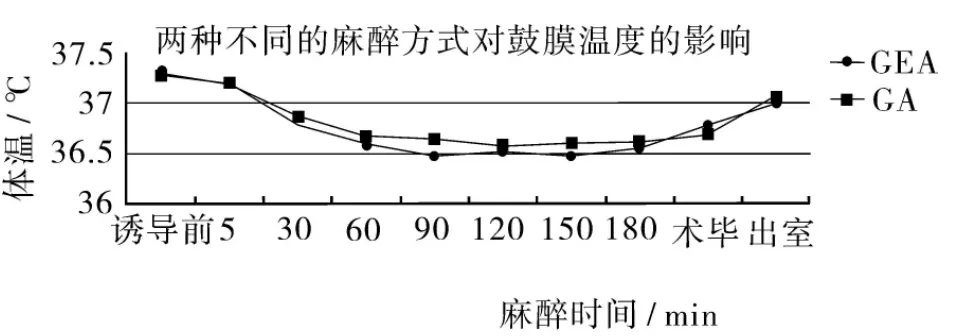
图1 两组术中鼓膜温度比较
2.3 两组患者低体温和寒战发生率比较 围术期低体温发生率比较,GA组(12%)与GEA组(22.5%)的差异无统计学意义(χ2=1.900,P=0.168);苏醒期寒战发生率比较,GA组(10%)与GEA组(14.3%)的差异无统计学意义(χ2=0.472,P=0.514),见表 3。

表3 两组患者低体温和寒战发生率比较[例(%)]
3讨论
人体的体温调节包括中枢和外周调节,中枢性调节主要指下丘脑的产热和散热中枢,根据体温调定点阈值维持体温稳定;外周调节表现为产热(血管收缩和寒战)和散热(血管舒张和出汗)[9]。麻醉后,体温调节功能被打乱,产热散热失平衡。全麻主要影响中枢性体温调节,使体温调节阈值范围从正常的0.2℃增大到原来的5~20倍[10];麻醉药抑制体温调节且呈剂量依赖性。椎管内麻醉同时抑制中枢和外周体温调节,其中外周体温调节受抑制是椎管内麻醉低体温的重要原因;中枢性体温调节抑制程度与麻醉阻滞平面呈正相关,使体温调节阈值范围增大到原来的3倍[10]。围术期多种因素综合作用导致患者发生体温下降,麻醉后体温调节阈值增宽使患者不能对下降的体温做出正确的调节反应,从而处于低体温状态。
核心温度可较好的反映人体的正常体温,测量部位主要有肺动脉导管、食管远端、鼻咽部和鼓膜[11]。本试验选用Braun PRO4000红外耳温计测量鼓膜温度,其具有测量准确、快速、安全、舒适的优点,同时适用于清醒和麻醉患者[12],保证了围术期全程(术前、术中和术后PACU)由同一温度计测量体温,更直观的反映患者围术期体温变化。
围术期体温受多种因素的影响,包括患者的一般情况、手术因素、麻醉因素等[13]。本研究中,两组患者的性别、年龄、体重、BMI指数、手术时长、环境温度、液体出入量和体腔冲洗量比较均无统计学差异,手术类型统一为开腹手术,且术中所输液体均为室温,需输血者将血制品加温到室温再输入。在如上条件均衡的情况下,两组间的体温变化可主要反映不同的麻醉方式对体温的影响。
本研究中,两组患者的围术期体温变化趋势相同:首先表现为体温下降,主要是诱导后麻醉药导致血管扩张,体热由中心向外周扩散,发生再分布性低温[14-15]。然后,体温趋于稳定状态,可能因体温下降到一定程度触发体温调节机制,血管收缩,热量散失减少;同时,机体代谢产热,两者共同作用,维持体温处于相对平衡状态[14-15]。最后体温缓慢回升,至离开PACU前已回升到接近术前水平,可能与术毕在PACU恢复期间常规保温有关。
由于两组患者围术期体温变化趋势相同,而且术中最大温差[GA 组(0.8±0.4)℃,GEA 组(1.0 ±0.3)℃]无统计学差异(P=0.50);低体温发生率(GA组12%,GEA组22.45%)无统计学差异(P=0.168);寒战发生率(GA 组10%,GEA 组14.3%)无统计学差异(P=0.514),如上数据即可说明,在本试验中,两种不同麻醉方式对开腹手术患者围术期体温变化的影响差异不明显。
综上所述,在本研究中,无论采用全麻还是全麻复合硬膜外麻醉方式,开腹手术患者术中均发生体温降低,但两者体温变化无明显差异。
[1] Erdling A,Johansson A.Core temperature-the intraoperative difference between esophageal versus nasopharyngeal temperatures and the impact of prewarming,age,and weight:a randomized clinical trial[J].AANA J,2015,83(2):99-105.
[2] Yang HL,Lee HF,Chu TL,et al.The comparison of two recovery room warming methods for hypothermia patients who had undergone spinal surgery[J].Nurs Scholarsh,2012,44(1):2-10.
[3] Adriani MB,Moriber N.Preoperative forced-air warming combined with intraoperative warming versus intraoperative warming alone in the prevention of hypothermia during gynecologic surgery[J].AANA J,2013,81(6):446-451.
[4] 杨 艳.引起麻醉期低体温的相关因素临床分析[J].吉林医学,2015,36(7):1414-1415.
[5] Torossian A,Bröuer A,Höcker J,et al.Preventing inadvertent perioperative hypothermia[J].Dtsch Arztebl Int,2015,112(10):166-172.
[6] 何 龙,范连慧,王 军,等.经皮肾镜碎石术中低体温对术后恢复影响的观察研究[J].安徽医药,2014,18(3):468-470.
[7] Geiger TM,Horst S,Muldoon R,et al.Perioperative core body temperatures effect on outcome after colorectal resections[J].Am Surg,2012,78(5):607-612.
[8] Lam DH,Dhingra R,Conley SM,et al.Therapeutic hypothermiainduced electrocardiographic changes and relations to in-hospital mortality[J].Clin Cardiol,2014,37(2):97-102.
[9] 庄心良.现代麻醉学[M].北京:人民卫生出版社,2010:426-427.
[10] enhardt R.The effect of anesthesia on body temperature control[J].Front Biosci,2010,1(2):1145-1154.
[11] Shin J,Kim J,Song K,et al.Core temperature measurement in therapeutic hypothermia according to different phases:comparison of bladder,rectal,and tympanic versus pulmonary artery methods[J].Resuscitation,2013,84(6):810-817.
[12] Gasim GI,Musa IR,Abdien MT,et al.Accuracy of tympanic temperature measurement using an infrared tympanic membrane thermometer[J].BMC Res Notes,2013,10(6):194.
[13] Constantine RS,Kenkel M,Hein RE,et al.The impact of perioperative hypothermia on plastic surgery outcomes:a multivariate logistic regression of 1062 cases[J].Aesthet Surg J,2015,35(1):81-88.
[14] Esnaola NF,Cole DJ.Perioperative normothermia during major surgery:is it important?[J].Adv Surg,2011,45:249-263.
[15] Carrero EJ,Fàbregas N.Thermoregulation and neuroanesthesia[J].Saudi JAnaesth,2012,6(1):5-7.
