肾癌根治术中淋巴结清扫对生存预后的影响
2015-03-22李先承
植 凡,李先承,梁 辉
(1.深圳市龙华新区人民医院泌尿外科,广东深圳 510109;
2.大连医科大学附属第一医院泌尿外科,辽宁大连 116011)
肾细胞癌(renal cell carcinoma,RCC)约占成人全部恶性肿瘤的2% ~3%,占肾肿瘤的85%[1]。国内报道发病率男性为3.66/10万,女性为1.56/10万,居泌尿系统恶性肿瘤第二位[2],严重影响人类的生命健康。肾癌根治术是其治疗的金标准,常规手术范围包括:患肾及肾周围组织及Gerota’s筋膜、受累侧的肾上腺、区域淋巴结。但多年来,在对肾癌患者施行肾癌根治术时,是否行淋巴结清扫术一直争议不断[3-5]。本研究收集并分析了自2003年以来我院诊断肾细胞癌行肾癌根治术患者的资料,以期为肾细胞癌的临床治疗提供理论依据。
1 对象与方法
1.1 研究对象 收集2003年1月至2015年1月经大连医科大学附属第一医院确诊为肾细胞癌并行肾癌根治术的患者1 158例,剔除治疗同时或之前发生其它恶性肿瘤,手术治疗时已经有远处转移,术后使用靶向药物的患者,最终有252例病例纳入本研究,所有患者均自愿同意并参加随访。
1.2 手术方法 患者全麻、仰卧位,患侧腹直肌旁切口,肾癌根治术切除范围为肾及肿瘤、肾周脂肪、Gerota筋膜、肾门淋巴结、输尿管上段,切除肿瘤侵犯肾上腺患者的同侧肾上腺。左肾癌的区域淋巴结清扫:切除主动脉前面和外侧面的淋巴组织,沿主动脉向下清扫,保护肠系膜上动脉、腹腔神经节和内脏神经,于腔静脉和主动脉间向下清扫主动脉侧面至肠系膜下动脉。右肾癌的区域淋巴结清扫:于腹主动脉表面切开血管鞘,沿主动脉清扫至分叉处,再清扫腔静脉后及主动脉右侧组织,至主动脉分叉。系统性淋巴结清扫:根据两侧肾脏淋巴回流范围确定,以患侧肾为中心进行清扫,上止于肾动脉上缘,下起髂血管分叉水平。
1.3 观察指标 收集患者的年龄、性别、TNM分期(采用2010年AJCC发布的分期标准)、Fuhrman病理分级、是否有淋巴结转移、是否行淋巴结清扫术及是否为非透明细胞癌。
1.4 随访 通过电话、走访、信访等方式进行随访,收集患者的总生存时间(overall survival,OS):起点为手术日期,终点为因肾癌死亡的日期和疾病无进展生存期(progression free survival,PFS),随访时间为1.2 ~80.7 个月,平均21.6 个月。
1.5 统计分析 不同组生存时间的分析采用非参数检验,生存分析采用Kaplan-meier法,多因素分析采用COX回归模型,检验水准α=0.05,P<0.05认为有统计学意义,所有分析均采用SPSS17.0完成。
2 结果
2.1 基本情况 252例患者中男性患者162例(64.3%),女性患者 90 例(35.7%);平均年龄为(58.23±11.96)岁,≤60岁的患者为 143例(56.7%),>60 岁的患者为 109 例(43.3%)。TNM 分期:T1-2期的病例共208 例(82.5%),T3-4期的病例共44例(17.54%)。其中140例进行了淋巴结清扫术,术后病理证实有淋巴结转移的仅8例,其中 T1-2组 3 例,阳性率1.4%,T3-4组4 例,阳性率9.1%;病例中有13例为非透明细胞癌。Fuhrman分级:其中高分化肾癌组为188例(74.6%),中低分化组为26例(10.3%),未记录病理Fuhrman分级的病例为36例(14.3%)。术后随访死亡患者46例,发生淋巴结转移者14例。
2.2 不同患者的PFS和OS比较 统计学检验结果显示,年龄≤60岁和年龄>60岁患者的PFS差异有统计学意义(P<0.05);行淋巴结清扫术的患者与未行淋巴结清扫术的患者、不同的TNM分期和Fuhrman分级患者的OS差异有统计学意义(P<0.05),见表 1。
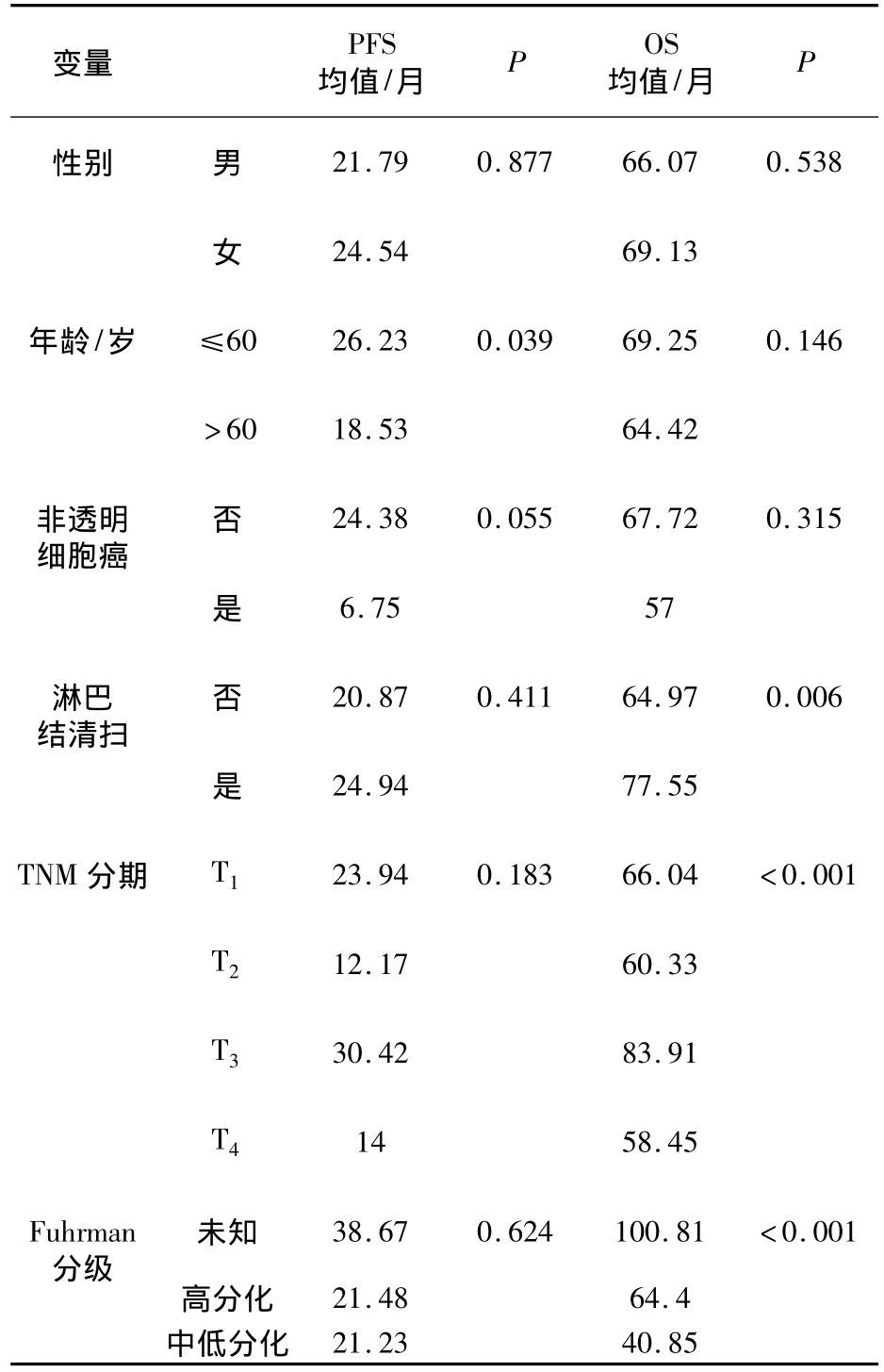
表1 不同患者的PFS和OS比较
2.3 生存分析 所有患者的生存时间为8~134月,生存分析显示,全部患者的生存时间均值为114.1个月,行清扫术的患者生存时间均值为117.7个月,未行清扫术的生存时间均值为102.9个月,生存分析有统计学意义(χ2=5.091,P <0.05)。
全部患者的生存曲线如图1所示,可见进行淋巴结清扫的患者其生存时间明显高于未进行淋巴结清扫的患者。
生存分析显示,TNM分期为T1-2期患者的生存时间均值为107.9个月,行清扫术的生存时间均值为110.7个月,未行清扫术的生存时间均值为102.6个月,生存分析无统计学意义(χ2=2.828,P=0.093)。
TNM分期为T1-2期患者的生存曲线如图2所示,可见进行淋巴结清扫的患者其生存时间与未进行淋巴结清扫的患者相比,无明显区别。

图1 252例行根除术的肾癌患者生存曲线图

图2 T 1-2期患者的生存曲线图
生存分析显示,TNM分期为T3-4期患者的生存时间均值为90.8个月,行清扫术的患者生存时间均值为100.6个月,未行清扫术的患者生存时间均值为67.7个月,生存分析有统计学意义(χ2=5.023,P <0.05)。
TNM分期为T3-4期患者的生存曲线如图3所示,可见进行淋巴结清扫的患者其生存时间明显高于未进行淋巴结清扫的患者。

图3 T3-4期患者的生存曲线图
2.4 多因素分析 多因素COX回归结果显示,肾癌根治术中行淋巴结清扫及Fuhrman分级可影响患者的生存状况,其差异经检验有统计学意义(P<0.05)。见表 2。

表2 患者生存影响因素的COX回归分析
3 讨论
长期以来,肾癌根治术是否同时行区域淋巴结清扫术以及淋巴结清扫的范围一直存在争议。过去的10年间,泌尿外科医生行淋巴结清扫术的数量呈持续下降趋势,主要是由于现有研究结果尚不能证明淋巴结清扫术有益。欧洲癌症治疗研究组织(EORTC 30881)[6]的一项历经20年的前瞻性随机对照试验结果显示淋巴结清扫组的患者与未行淋巴结清扫组患者在无进展生存时间和总生存时间上没有差别,即行淋巴结清扫术的患者并没有因此获得生存优势。但该项研究尚有不足之处,首先,入组患者的临床分期比较低,主要集中在T1-3N0M0肾癌患者,没有很好的说明中—高危肾癌患者的情况;其次,没有将局限性肾癌(临床Ⅰ~Ⅱ期)和局部进展性肾癌(临床Ⅲ期)患者的生存时间区别开来,故淋巴结清扫术在肾癌根治术中的意义仍值得深入探讨。
本研究结果显示,行清扫术的患者生存时间较未行清扫术的患者生存时间长,这与Pantuck等[7]的研究结果一致。但Crispen等[8]在一项队列研究中发现转移性肾癌患者中,术前淋巴结阳性并行淋巴结清扫患者与术前淋巴结阴性患者的中位生存时间没有差异,提示了淋巴结清扫术未必能够改善其预后。
对不同TNM分期患者的分析结果显示,T3-4期行淋巴结清扫的患者其生存时间明显高于未进行淋巴结清扫的患者,但在T1-2期患者中并无统计学差异。在以T1-2期患者为主的EORTC 30881研究中,淋巴结转移发生率为4%,而在Schafhauser等[9]进行的以T3-4占多数的队列研究中,淋巴结转移发生率为14%。因此,淋巴结清扫的作用在T1-2的患者价值有限,可能更适合在T3~4患者中进行。
淋巴结清扫术本身可造成的并发症包括淋巴囊肿、乳糜性腹水、腹部大血管损伤造成出血和对邻近脏器的损伤[8,10]。不清扫淋巴结还能缩短手术时间,降低手术难度,减少出现并发症的可能性[11]。而 EORTC 30881 和多项回顾性研究[6,12-13]的统计学数据表明,肾癌根治术同时行淋巴结清扫术患者术后并发症的发生率并无增加。淋巴结清扫术可能使患者受益却不增加并发症的风险,从该角度考虑,积极清扫是可行的。然而,彻底的淋巴结清扫术手术区域涉及腹腔大血管[14],因此系统广泛的淋巴结清扫术的手术时间和复杂性将必然增加,对医生技能的要求也相应提高,同时由于肾癌淋巴结转移的不确定性,导致了淋巴结清扫术目前还没有一个“标准”的术式。
经过对患者生存时间的影响因素进行Cox回归分析,显示患者的病理Fuhrman分级情况以及是否在肾癌根治术中行淋巴结清扫术,可显著影响患者的生存时间。本研究中TNM分期非显著影响因素,可能是由于病人选择偏倚造成。
目前淋巴结清扫术持续争议的主要原因有以下几点:(1)肾癌淋巴结转移的途径不确定;(2)肾癌伴远处转移者不一定存在区域淋巴结转移;(3)淋巴结阳性患者术前确认困难;(4)缺少令人信服的证据说明接受淋巴结清扫术的患者具有生存优势,尤其对于高危患者。因此肾癌根治术是否同时行区域淋巴结清扫,仍需要进一步研究来明确淋巴结清扫术在肾癌根治术中的作用。
[1] Capitanio U,Becker F,Blute ML,et al.Lymph Node Dissection in Renal Cell Carcinoma[J].European Urology,2011,60(6):1212-1220.
[2] 赵振威,李延江.肾细胞癌流行病学的研究进展[J].山东医药,2013,53(7):95 -97.
[3] 毕满华,郭志文.后腹腔镜下与开放式两种肾细胞癌根治术的临床疗效分析[J].安徽医药,2013,17(2):230 -232.
[4] Kates M,Lavery HJ,Brajtbord J,et al.Decreasing Rates of Lymph Node Dissection During Radical Nephrectomy for Renal Cell Carcinoma[J].Annals of Surgical Oncology,2012,19(8):2693 -2699.
[5] Lam JS,Shvarts O,Leppert JT,et al.Postoperative surveillance protocol for patients with localized and locally advanced renal cell carcinoma based on a validated prognostic nomogram and risk group stratification system[J].The Journal of Urology,2005,174(2):466-472.
[6] Blom JH,van Poppel H,Marechal JM,et al.Radical nephrectomy with and without lymph-node dissection:final results of European Organization for Research and Treatment of Cancer(EORTC)randomized phase 3 trial 30881[J].European Urology,2009,55(1):28-34.
[7] Pantuck AJ,Zisman A,Dorey F,et al.Renal cell carcinoma with retroperitoneal lymph nodes:role of lymph node dissection[J].The Journal of Urology,2003,169(6):2076 -2083.
[8] Crispen PL,Breau RH,Allmer C,et al.Lymph node dissection at the time of radical nephrectomy for high-risk clear cell renal cell carcinoma:indications and recommendations for surgical templates[J].European Urology,2011,59(1):18 -23.
[9] Schafhauser W,Ebert A,Brod J,et al.Lymph node involvement in renal cell carcinoma and survival chance by systematic lymphadenectomy[J].Anticancer Research,1999,19(2C):1573 -1578.
[10] Blute ML,Leibovich BC,Cheville JC,et al.A protocol for performing extended lymph node dissection using primary tumor pathological features for patients treated with radical nephrectomy for clear cell renal cell carcinoma[J].The Journal of Urology,2004,172(2):465-469.
[11] Bex A,Vermeeren L,de Windt G,et al.Feasibility of sentinel node detection in renal cell carcinoma:a pilot study[J].European Journal of Nuclear Medicine and Molecular Imaging,2010,37(6):1117-1123.
[12] Joslyn SA,Sirintrapun SJ,Konety BR.Impact of lymphadenectomy and nodal burden in renal cell carcinoma:Retrospective analysis of the national surveillance,epidemiology,and end results database[J].Urology,2005,65(4):675 - 680.
[13] Whitson JM,Harris CR,Reese AC,et al.Lymphadenectomy Improves Survival of Patients With Renal Cell Carcinoma and Nodal Metastases[J].Journal of Urology,2011,185(5):1615 -1620.
