辐射对人胶质瘤U251细胞COX-2和survivin表达的影响
2015-03-22储进锦
储进锦,张 帆,王 凡
(安徽医科大学第一附属医院肿瘤放疗科,安徽合肥 230022)
神经胶质瘤来源于神经上皮,是最常见的颅内原发肿瘤之一,约占颅内肿瘤的40% ~50%。胶质瘤是一种生物学特性非常复杂的恶性肿瘤,肿瘤生长迅速,向周围组织浸润能力强,手术难以全切,术后放疗是重要的治疗手段[1]。神经胶质瘤治疗后复发以原发灶局部复发为主,而增加原发灶局部的放射剂量却没有提高原发灶局部控制率,患者多数在确诊后1~2年内死亡,究其原因是人脑胶质瘤细胞存在放射抵抗性[2]。因此胶质瘤的治疗效果差,预后不佳。环氧化酶是催化花生四烯酸向前列腺素转化的关键限速酶,环氧化酶2(cyclooxygenase-2,COX-2)在正常组织中几乎无表达,主要在肿瘤组织中表达,主要通过抑制细胞凋亡促进肿瘤的发生发展[3]。survivin是凋亡抑制蛋白家族(Inhibitor of apoptosis proteins,IAP)的成员之一,是一类独立于Bcl-2的内源性细胞凋亡抑制蛋白,具有抑制细胞凋亡和调节细胞有丝分裂的功能,在肿瘤发生发展过程中发挥重要作用[4]。研究证实COX-2和survivin蛋白在胶质瘤组织中均高表达,尤其在Ⅲ~Ⅳ级高度恶性胶质瘤组织中表达明显增多,促进胶质瘤的发生和发展[5-6]。本实验通过体外培养人胶质瘤U251细胞,经X线照射后,观察COX-2和survivin蛋白表达的变化,分析辐射对胶质瘤细胞COX-2和survivin蛋白表达的影响,了解辐射是否通过改变肿瘤细胞的抗凋亡能力来增加其放射抵抗性。
1 实验材料和方法
1.1 研究对象和分组 人胶质瘤细胞系U251细胞购自中国科学院上海细胞库,进行体外传代培养,并随机分为实验组和对照组,实验组为经过10 Gy剂量X线照射的细胞,对照组无特殊处理。
1.2 实验试剂和器材 COX-2、survivin兔抗人多克隆抗体均购自英国Abcam公司;PV6000聚合物免疫组化检测试剂盒、DAB浓缩型显色试剂盒购自北京中杉金桥公司;DMEM高糖培养基购自Gibco公司;胎牛血清购自杭州四季青公司;CO2培养箱为HERA cell 150型;医用电子加速器为美国瓦里安23EX型直线加速器;倒置显微镜为OLYMPUSCX41型。
1.3 细胞培养 细胞培养各操作均在无菌细胞培养室超净台内进行。人胶质瘤细胞系U251贴壁培养在含10%胎牛血清的DMEM培养基中,置于37℃、CO2体积分数5%的饱和湿度培养箱中培养,2~3 d换液一次,在倒置显微镜下观察,待细胞生长面积达到培养瓶底约80% ~90%时,常规传代:吸弃旧培养基,0.25%的胰蛋白酶消化,观察到细胞间隙增大、形态变圆、细胞漂浮时加入含有血清的培养基终止胰酶消化,收集细胞悬液,离心后制成单细胞悬液,并置于培养箱中继续培养。重复以上操作,同时观察细胞生长情况,细胞贴壁状况良好,排列较为紧密,培养基清亮,无明显杂质及沉淀,说明细胞已处于对数生长期,可用于实验。
1.4 照射方式 取处于对数生长期的实验组及对照组U251细胞,0.25%胰酶消化后制成单细胞悬液,分别接种于六孔板中,培养至细胞铺满板底70% ~80%后,实验组细胞釆用直线加速器6MVX线垂直照射,照射方法:室温下进行源皮距照射,剂量率为200 cGy·min-1,照射野为10 cm×10 cm,源皮距(射线至板顶)为100 cm,剂量为10 Gy,接受照射后再立即放回培养箱中。对照组细胞同步进行传代培养,但不予X线照射。
1.5 细胞爬片制作及免疫组化 将实验组及对照组细胞继续培养48 h,分别取对数生长期细胞,将0.25%胰蛋白酶消化后的细胞悬液分别接种于预先置有细胞爬片的六孔板中培养,每组细胞各制作10张细胞爬片。从六孔板中取出爬片,pH7.2的PBS液冲洗3次,4%多聚甲醛室温下固定20 min,0.5%TxitonX-100室温下处理 20 min,后采用PV6000免疫组化法染色:3%过氧化氢去离子水室温下处理10 min,PBS液冲洗3次,每组其中5张滴加 COX-2一抗(稀释浓度为1∶800),另外5张滴加survivin一抗(稀释浓度为1∶1 500),置于4℃冰箱孵育过夜,PBS液冲洗后滴加通用型IgG抗体-HRP多聚体(二抗),37℃温箱中孵育20 min,DAB试剂显色5 min,待阳性染色为黄色或棕黄色后,苏木素复染细胞核1 min,冲洗,烤干,封片,观察。每组细胞爬片按以上操作重复3次实验。
1.6 结果判定 细胞免疫组化结果利用生物图像分析软件,每张细胞爬片随机选取5个高倍(×400)视野,分别测定平均光密度值,用平均光密度值来表示细胞中COX-2和survivin蛋白的相对含量。
1.7 统计分析 运用SPSS19.0统计学软件进行数据处理,数据采用均数±标准差(x±s)表示,组间比较采用t检验进行统计学分析,P<0.05认为差异有统计学意义。
2 实验结果
COX-2和survivin蛋白在未处理的对照组人胶质瘤U251细胞的细胞质和细胞核中均有表达,呈黄色或者棕黄色。经过10 Gy剂量X射线照射48 h后,检测到COX-2和survivin蛋白在细胞内的染色变深,平均光密度值增加,说明两者的表达量较未照射组均明显增加(P <0.05),见表1,图1,图 2。

表1 生物图像分析系统定量分析辐射对人胶质瘤U251细胞COX-2和survivin蛋白表达的影响
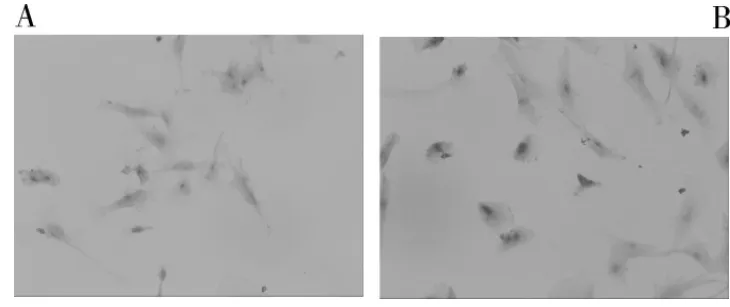
图1 免疫组化法检测辐射对COX-2蛋白表达的影响(A:对照组,B:实验组)(×400)

图2 免疫组化法检测辐射对survivin蛋白表达的影响(C:对照组,D:实验组)(×400)
3 讨论
细胞凋亡是一种由基因控制的细胞自主性死亡方式,在凋亡刺激因子作用下通过启动细胞内死亡机制和信号转导途径,最终发生细胞程序性死亡的过程,它是一种细胞生长的负性调控机制。细胞凋亡涉及一系列基因的激活、表达以及调控,多种基因相互作用共同调节细胞的增殖和凋亡。近年来研究表明,肿瘤不仅是一种增殖失控的疾病,也是细胞凋亡异常的疾病。正常情况下,细胞应处于增殖与凋亡的动态平衡状态,凋亡调控基因的表达异常直接导致了细胞凋亡异常,这使得细胞分裂周期失调的细胞逃脱正常的监控机制而异常增殖,导致肿瘤的发生、发展。
环氧化酶(cyclooxygenase,COX)是催化花生四烯酸向前列腺素转化的关键的限速酶,其存在两种亚型:结构型COX-1和诱导型COX-2。COX-1是表达于大部分组织的结构酶,定位于内质网,呈稳定持续表达,COX-2为一种诱导酶,定位于细胞质和核膜。一般认为COX-2在正常生理状态下多数组织不表达,当受到包括生长因子、细胞因子、炎性介质、各种促癌因素等刺激因素作用时,其表达量迅速上调[7]。大量研究证实COX-2可从多个环节参与肿瘤的形成,具有抑制细胞凋亡、促进细胞增殖分化、促进肿瘤血管生成、干扰细胞正常免疫及促进肿瘤转移和侵袭的生物学作用,在乳腺癌、食管癌、胃肠道恶性肿瘤等多种癌组织中高表达[8]。COX-2的主要产物前列腺素(PGE)可促进细胞的增殖、侵袭、血管生成,抑制细胞凋亡,与肿瘤的发展密切相关,在正常组织中无表达,而在肿瘤中高表达[9]。survivin蛋白是凋亡抑制蛋白IAP家族的成员之一,生物学功能主要有抑制细胞凋亡、调控细胞周期、调节有丝分裂、促进细胞增殖,在分化成熟的组织中不表达,特异性地高表达于多种恶性肿瘤中,如肺癌、胃癌,包括胶质瘤,因此被认为是在肿瘤发生发展过程中发挥重要作用的一个关键分子[10]。survivin蛋白是染色体分裂和细胞质分裂中关键的调节因子,survivin在G2/M期高表达,可通过相应的调控机制使细胞逃避G2/M期的校正,不能有效对肿瘤细胞进行监控,从而诱导其异常分裂,抑制了肿瘤细胞的凋亡[11]。survivin蛋白还可通过抑制caspase信号通路来阻断细胞的凋亡程序,caspase级联活化是细胞凋亡发生的核心机制,survivin可作用于终末效应因子 caspase-3和caspase-7,通过抑制其表达,干扰凋亡信号的传导,从而进一步阻断细胞的凋亡程序[12]。
放射治疗是肿瘤治疗的重要手段之一,电离辐射的生物效应主要由对DNA的损伤所致,关键靶点是DNA。辐射可诱导细胞基因组的不稳定性,导致基因表达的变化,发生遗传异常、细胞形态异常、功能异常,正是这些基因表达的异常,从而引起细胞生物特性改变。Pervan M[13]的实验显示辐射可诱发多数肿瘤细胞凋亡,但有的肿瘤细胞即使给予较高辐射剂量也不会发生凋亡。Anai S[14]报道当肿瘤细胞暴露于小剂量的放射线时,细胞会上调COX-2蛋白的表达,这可能是肿瘤细胞产生放射损伤逃逸现象的途径之一。Steinauer[15]研究显示:放射治疗是COX-2蛋白表达的一种刺激因素,COX-2的表达随着照射剂量的增加而显著增加,同时COX-2的主要产物前列腺素2(PGE2)的水平在放射治疗后也明显升高,呈剂量依赖性,且前列腺素及其类似物已被证实是辐射损伤的细胞保护剂。survivin可增加肿瘤细胞的放射抗拒作用,survivin蛋白的高表达与胶质瘤的放射抵抗性有关,下调survivin的表达或是抑制其功能,可以提高肿瘤细胞对放射治疗的敏感性[16]。Jin X 等[17]发现,下调肿瘤细胞内survivin蛋白的表达后,辐射诱导的细胞凋亡大大增加。Khan等[18]发现,下调survivin蛋白水平或者进行基因消除后,头颈部肿瘤细胞的放射敏感性明显增高。本实验的研究结果显示,在10Gy剂量的照射条件下,辐射可诱导人胶质瘤U251细胞COX-2和survivin蛋白表达的明显增加。我们可以推测出,在胶质瘤放射治疗过程中,一部分肿瘤细胞发生了凋亡,存活下来的细胞通过上调COX-2和survivin蛋白的表达,产生一系列的抗凋亡效应,抑制了这部分细胞的凋亡,逃避了放射线的损伤,对放射治疗的敏感性大大下降,因此不能达到预期的疗效,为日后复发留下隐患。
在当今恶性肿瘤的治疗领域里,只进行传统的手术、放疗和化疗并不能达到显著的疗效,辅助治疗的地位日益突出,而靶向治疗是基于对特定靶点结构和功能的认识,通过干扰特异性分子而阻断肿瘤的生长和扩散,其在未来的肿瘤治疗中将发挥巨大的作用。为进一步提高放疗疗效,不增加周围正常组织毒副反应,在放疗过程中需要利用各种辅助手段来降低某些肿瘤对辐射的抵抗能力,提高其放射敏感性,放射增敏剂是重要的辅助治疗方法之一[19]。COX-2和survivin是当下比较热门的基因靶点,怎样消除胶质瘤的放射抵抗性,如何增强胶质瘤的放射敏感性也是当前胶质瘤治疗领域的研究热点之一。已有研究将COX-2和survivin作为增强胶质瘤放射敏感性的靶点,旨在通过提高肿瘤细胞对放射线的敏感性,来实现在不增加放疗剂量的基础上,提高放疗的疗效,减少复发,延长患者生存时间。聂斌等[20]研究COX-2抑制剂塞来昔布对脑胶质瘤SHG-44细胞放射增敏的作用,结果显示塞来昔布(30μmol·L-1)可增加SHG-44细胞的放射敏感性,与诱导肿瘤细胞自噬和G2/M期阻滞有关。聂亮琴等[21]研究表明塞来昔布可通过参与调节细胞周期和减少DNA损伤修复来增强脑胶质瘤细胞u373的放射增敏性,其增敏比为1.21,明显高于正常脑组织细胞,这证明COX-2抑制剂塞来昔布可作为提高胶质瘤放疗疗效的手段之一。张瞳光等[22]通过克隆形成试验和皮下移植瘤试验发现survivin基因过度表达和恶性胶质瘤的放疗抵抗性密切相关,抑制survivin基因能够显著增强胶质瘤的放射敏感性。Reichert[23]通过siRNA下调恶性胶质瘤LN229细胞survivin的表达,结果显示细胞凋亡明显增加,DNA损伤修复作用减弱,克隆形成率下降,放射敏感性增强,说明下调survivin可减少辐射诱导的DNA损伤的修复。COX-2抑制剂NS398作用于肝癌细胞中可降低survivin的表达,相关性分析显示NS-398作用后COX-2与survivin蛋白表达呈显著正相关[24],提示COX-2和survivin之间的确可能存在某种联系,但其中的具体机制仍不清楚,因此COX-2和survivin在促进肿瘤作用中的内在联系有待于深入研究,以进一步了解胶质瘤产生放疗抵抗的分子机制。
综上所述,本研究结果表明辐射可诱导胶质瘤细胞COX-2和survivin蛋白的表达增多,这可能是胶质瘤存在放射抵抗的机制之一。设想通过各种手段下调COX-2和survivin蛋白的表达可增加细胞的凋亡,提高胶质瘤对辐射的敏感性,为临床寻找更加有效的治疗方式提供了新的方向。本研究仍存在一些不足,例如没有进行细胞放射增敏性的研究,没有将照射剂量进行更为细致的分组,且后期还需要进一步调控COX-2的表达来观察其对胶质瘤放射效应的影响以及survivin的变化,探讨COX-2及survivin之间的关系,以进一步了解神经胶质瘤产生放疗抵抗的分子机制,为临床优化胶质瘤的治疗提供新的理论和实验依据。
[1] Lima FR,Kahn SA,Soletti RC,et al.Glioblastoma:Therapeutic challenges,what lies ahead[J].Biochim Biophys Acta,2012,1826(2):338-349.
[2] Sheehan JP,Shaffrey ME,Gupta B,et al.Improving the radiosensitivity of radioresistant and hypoxic glioblastoma[J].Future Oncol,2010,6(10):1591-1601.
[3] Hoellen ,Kelling K,Dittmer C,et al.Impact of cyclooxygenase-2 in breast cancer[J].Anticancer Res,2011,31(12):4359-4367.
[4] Kanwar JR,Kamalapuram SK,Kanwar RK.Targeting survivin in cancer:patent review[J].Expert Opin Ther Pat,2010,20(12):1723-1737.
[5] El-Sayed M,Taha MM.Immunohistochemical expression of cycloxygenase-2 in astrocytoma:correlation with angiogenesis,tumor progression and survival[J].Turk Neurosurg,2011,21(1):27-35.
[6] 倪 恒,窦长武.生存素survivin与脑胶质瘤的研究进展[J].中外医学杂志,2014,12(14):150-153.
[7] 刘永庆,童斯浩,鲍扬漪,等.塞来昔布对肝癌HepG2 HepG3细胞的免疫增敏作用[J].安徽医药,2014,18(7):1336-1340.
[8] Ke HL,Tu HP,Lin HH,et al.Cyclooxygenase-2(COX-2)upregulation is a prognostic marker for poor clinical outcome of upper tract urothelial cancer[J].Anticancer Res,2012,32(9):4111-4116.
[9] Kim YM,Shin YK,Jun HJ,et al.Systematic analyses of genes associated with radiosensitizing effect by celecoxib,a specific cyclooxygenase-2 inhibitor[J].J Radiat Res,2011,52(6):752-765.
[10] Altieri DC.Survivin and IAP proteins in cell-death mechanisms[J].Biochem J,2010,430(2):199-205.
[11] Mobahat M,Narendran A,Riabowol K.Survivin as a preferential target for cancer therapy[J].Int J Mol Sci,2014,15(2):2494-2516.
[12]张贺春,窦长武.凋亡蛋白抑制因子Survivin在脑胶质瘤中的作用研究进展[J].内蒙古医科大学学报,2014,36(3):283-287.
[13] Pervan M,Pajonk F,Sun JR,et al.Molecular pathways that modify tumor radiation response[J].Am JClin Oncol,2001,24(5):481-485.
[14] Anai S,Tanaka M,Shiverick KT,et al.Increased expression of cyclooxygenase-2 correlates with resistance to radiation in human prostate adenocarcinoma cells[J].J Urol,2007,177(5):1913-1917.
[15] Steinauer KK,Gibbs I,Ning S,et al.Radiation induces upregulation of cyclooxygenase-2(COX-2)protein in PC-3 cells[J].Int J Radiat Oncol Biol Phys,2000,48(2):325-328.
[16] Rǒdel F,Reichert S,Sprenger T,et al.The role of survivin for radiation oncology:moving beyond apoptosis inhibition[J].Curr Med Chem,2011,18(2):191-199.
[17] Jin X,Li Q,Wu Q,et al.Radiosensitization by inhibiting survivin in human hepatoma HepG2 cells to high-LET radiation[J].J Radiat Res,2011,52(3):335-341.
[18] Khan Z,Khan N,Tiwari RP,et al.Down-regulation of survivin by oxaliplatin diminishes radioresistance of head and neck squamous carcinoma cells[J].Radiother Oncol,2010,96(2):267-273.
[19]冉晨曦,何人可,汤小玲,等.肿瘤放射治疗中辐射增敏剂的应用进展[J].山东医药,2015,55(3):86-88.
[20]聂 斌,周菊英,吴 琼,等.自噬在塞来昔布对脑胶质瘤SHG-44细胞放射增敏效应中的作用[J].苏州大学学报(医学版),2012,32(1):18-23.
[21]聂亮琴,周菊英,王利利,等.塞来昔布对正常脑胶质细胞和脑胶质瘤细胞放射增敏效应的比较及其机制[J].中华放射医学与防护杂志,2014,34(5):342-345.
[22]张瞳光,杜利力,刘显明,等.siRNA沉默survivin基因表达对恶性胶质瘤细胞放射敏感性的影响[J].中国药业,2010,19(9):15-17.
[23] Reichert S,Rödel C,Mirsch J,et al.Survivin inhibition and DNA double-strand break repair:A molecular mechanism to overcome radioresistance in glioblastoma[J].Radiother Oncol,2011,101(1):51-58.
[24] 付卫争,孙国平,范璐璐,等.环氧合酶-2选择性抑制剂NS398诱导人肝癌细胞BEL-7402凋亡及其机制探讨[J].肿瘤,2010,30(1):11-14.
