TBX2和MDM2在子宫内膜样腺癌中的表达及相关性
2015-03-22郭真理
郭真理,陈 柯,徐 傲,杜 军,沈 倩
(安徽省立医院南区病理科,安徽合肥 230001)
原癌基因的异常激活在子宫内膜样腺癌发生中发挥重要作用。生理情况下原癌基因编码的蛋白质对正常细胞的生长与分化起正性调控作用,各种致癌因素的作用会使正常细胞内处于正常或有限表达的原癌基因被激活为有致癌活性的癌基因。相关癌基因TBX2与MDM2相互协同调控结肠腺癌及乳腺癌等腺癌发生发展已有一些研究,而同时检测二者在子宫内膜样腺癌中的表达及相关性报道不多,我们运用免疫组化SP法检测TBX2与MDM2蛋白在92例子宫内膜样腺癌中的表达情况,初步探讨其表达变化在肿瘤发生发展进程中的作用及对肿瘤靶点寻求及预后判断的意义。
1 材料与方法
1.1 标本来源及处理 选取安徽省立医院本部及南区病理科2001年9月—2012年10月经中性甲醛固定及石蜡包埋的子宫内膜样腺癌标本92例,患者年龄38~72岁,平均55岁,依据国际妇产科联盟(FIGO)2000年的标准对子宫内膜样腺癌进行手术病理分期:Ⅰ期者35例,Ⅱ期者30例,Ⅲ期者27例;其中病理分级为G1级(高分化)者35例,G2级(中分化)者40例,G3级(低分化)者17例;肌层浸润为≤1/2者45例,>1/2者47例;淋巴结转移为发生者27例,未发生者65例。同时选取因其它缘故如诊断性刮宫或子宫肌瘤实行手术的子宫病患存档蜡块标本,其中子宫内膜正常增生期30例,单纯性增生30例,复杂伴不典型性增生30例,所有标本均经两名具有高级职称的病理专家复核诊断,所有病患术前均未进行放化疗或激素类内分泌治疗。
1.2 组织芯片制备 首先复查HE切片选取富集肿瘤细胞的区域,其次标记上述选定区域对应的蜡块位点,再次用组织芯片仪制作空心蜡模,最后用组织芯片取样器在蜡块标记位点取出目标组织并放入空心蜡模中,构建8×7点阵的组织微阵列。对组织芯片蜡块行3μm厚连续切片,并裱褙于购自北京中杉金桥生物公司的阳离子防脱片上行相关染色。
1.3 主要试剂与方法 即用型MDM2鼠抗人单克隆抗体(ZM-0425)及通用型二步法试剂盒(PV-6000)均购自北京中杉金桥生物公司;浓缩型TBX2鼠抗人单克隆抗体由北京中杉公司代购,工作液浓度为1∶100。方法采用SP法:切片经二甲苯、梯度酒精脱蜡至水,柠檬酸盐高压加热修复抗原,3%过氧化氢阻断,其余步骤按说明书依次进行。用既往TBX2与MDM2阳性切片作阳性对照,PBS代替一抗作阴性对照。
1.4 免疫组织化学结果判定 以细胞核和(或)细胞浆出现黄色、棕黄色及棕褐色为阳性,与背景颜色一样或无着色为阴性。结果选用半定量积分法[1]判读:首先依阳性细胞在视野中占百分比评分:阴性为0,阳性细胞≤10%为1分,11% ~50%为2分,51%~75%为3分,>75%为4分;其次依染色强度评分:无色为0,浅黄色为1分,棕黄色为2分,棕褐色为3分,同时考虑背景着色。两项得分之积:阴性(-)为0~4分,弱阳性(1+)为4~5分,中阳性(2+)为6~8分,强阳性(3+)为9~12分。
1.5 统计学方法 采用SPSS13.0统计软件分析,率的比较采用χ2检验,Fisher's精确概率法用于判断样本差异的显著性,TBX2与MDM2蛋白之间的相关性用Spearman等级相关分析。
2 结果
2.1 TBX2和MDM2在良恶性病变子宫内膜中表达 见表1。TBX2与MDM2蛋白在正常增生期内膜多呈阴性表达(图1,图2);TBX2蛋白主要表达于子宫内膜样腺癌细胞质,少量胞核表达(图3);MDM2阳性表达主要位于子宫内膜样腺癌细胞核(图4)。从子宫内膜正常增生期到子宫内膜样腺癌,TBX2和MDM2的阳性表达率渐次升高。χ2检验显示子宫内膜样腺癌中TBX2阳性表达率(76.1%)显著高于正常增生期内膜及单纯性增生内膜(30.0%;36.7%),亦显著高于复杂伴不典型增生内膜(43.3%),差异均具有统计学意义(P<0.01)。而复杂伴不典型增生组织相较正常增生期内膜表达差异没有显著性(P>0.05);χ2检验显示子宫内膜样腺癌中MDM2蛋白表达与正常增生期内膜、单纯性增生及复杂不典型性增生内膜组间差异有显著性(P均<0.01),复杂伴不典型性增生与正常增生期内膜差异亦有显著性(P<0.01),与单纯性增生内膜差异没有显著性(P >0.05)。

表1 TBX2和MDM2在不同子宫内膜组织中的表达
2.2 TBX2和MDM2表达与临床病理参数的关系
见表2。TBX2阳性表达与子宫内膜样腺癌病理学分级高低、肌层浸润深浅及临床分期高低均有关(χ2=11.143,P <0.01;χ2=9.306,P <0.01;χ2=8.276,P <0.05),与淋巴结转移与否无关(χ2=3.442,P >0.05);MDM2阳性表达率与子宫内膜样腺癌病理学分级高低、肌层浸润深浅无关,与临床分期高低、淋巴结转移与否也不具相关性(χ2=1.964,χ2=2.081,χ2=3.867,χ2=1.377,P 均 >0.05)。

表2 子宫内膜样腺癌中TBX2和MDM2的表达与临床病理参数的关系
2.3 TBX2和MDM2表达的相关性 Spearman等级相关分析显示子宫内膜样腺癌中TBX2与MDM2蛋白表达呈正向相关性(rs=0.346,P <0.01)。

图1 TBX2蛋白在正常增生期内膜中的表达呈阴性

图3 TBX2蛋白在子宫内膜样腺癌中主要表达于细胞浆,少量胞核表达

图4 MDM2蛋白在子宫内膜样腺癌中主要表达于细胞核,均为SP法,高倍放大
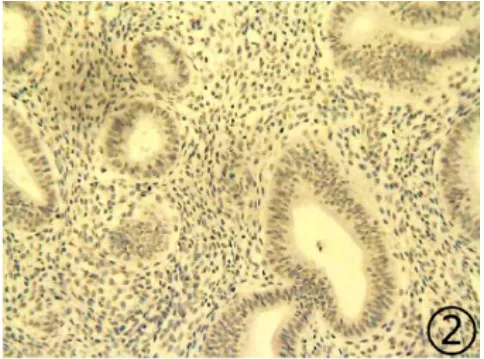
图2 MDM2蛋白在正常增生期内膜中的表达呈阴性
3 讨论
TBX2是T-BOX基因家族重要组员,TBOX区为其特有的结构,在生物体内主要有调控发育的作用,属发育调控相关基因。其编码蛋白主要通过羧基末端的抑制转录结构域发挥阻遏作用。TBX2广泛表达于各种组织的胚胎发育过程,能够指导胚胎以及组织器官轴向发育[2-3]。TBX2可由多条途径参与肿瘤的形成过程,首先,P19ARF-MDM2-P53通路是体内与细胞衰老有关的重要作用轴,而TBX2可通过抑制P19ARF的表达封闭细胞衰老途径,抑制细胞凋亡发生,当TBX2的异常累积到一定程度会导致细胞的恶性变[4]。其次,与 myc、sis等经典癌基因协同作用,使细胞过度增殖恶化[5]。再次,可以与P21基因启动子区结合抑制P21基因的表达并使其在DNA损伤后不能发挥诱导作用[6]。此外,新近研究[7]还发现TBX2能够干扰抑癌基因PRb的转录从而使其对细胞周期进程失去控制能力。研究表明TBX2蛋白在多种人类恶性肿瘤如胰腺癌、乳腺癌等中均呈高表达[8-9]。本实验发现92例子宫内膜样腺癌中TBX2阳性表达率(76.1%,70/92)显著高于30例正常增生期内膜及30例单纯性增生内膜(30.0%,9/30;36.7%,11/30),亦显著高于复杂伴不典型增生内膜(43.3%,13/30),差异均具有统计学意义(P<0.01)。而相较正常增生期内膜而言,在复杂伴不典型增生组织中表达虽有上升势头,但没有统计学意义。这与本课题组之前[10]做72例子宫内膜样腺癌标本的研究结果一致,样本量的扩大仍然支持上述结果,增加了可信度。而且与其他学者[11]的研究结果也基本吻合。可以看出,TBX2阳性表达率在子宫内膜病变前期(单纯性增生及复杂伴不典型增生阶段)与正常增生期内膜差别不大,而到了病变后期(腺癌发生阶段)其表达率却发生陡然升高,提示TBX2基因活化主要发生在子宫内膜病变晚期。本次还发现TBX2阳性率随着病理学分级的变低及肌层浸润的加深而增高,差异均有统计学意义(P均<0.01),即低分化的癌变组织中高表达,高分化的癌变组织中低表达;肌层深浸润的肿瘤组织中表达更强,肌层浅浸润的肿瘤组织中表达相对弱些。这可能与TBX2抑制P19ARF从而阻遏细胞衰老抑或干扰PRb转录使细胞周期和分化不能正常进行有关。另外TBX2表达情况与临床分期之间的差异亦有显著性(P<0.01),即高分期的病人TBX2表达较高,低分期的患者表达稍弱。而临床分期是临床上判断病患预后情况的重要参考指标,临床分期的增高往往预示着病人情况不理想,发生远处多部位转移可能性较大,预后较差。上述结果提示TBX2阳性高表达使癌组织易于突破基底膜向肌层及更远处浸润性生长,提升了癌组织侵袭能力,促进了子宫内膜样腺癌向增殖更快、恶性程度更高方向演进。故而TBX2基因具有癌基因显著特征,与肿瘤的浸润侵袭密切相关,为肿瘤的预后评估与生物治疗提供了新的关键因子。
MDM2是一种进化保守基因,位于人染色体12q13-14,在体内作为一种转录因子发挥作用,可以自发诱导癌变形成,正常人体多个组织器官均可见其表达。MDM2处于P19ARF-MDM2-P53作用轴的核心,在体内其主要和野生型P53(wtP53)之间通过负反馈调节环进行相互作用[12],也就是说,wtP53可以促进MDM2的转录,使MDM2蛋白表达变高;同时过表达的MDM2蛋白又可与wtP53结合在一起发挥降低其转录活性的作用,阻遏了wtP53基因的转录激活功能,并使wtP53蛋白表达水平维持在低水平。除了wtP53以外,MDM2还可抑制被wtP53活化的下游基因P21的抑制细胞增生作用。另外MDM2还能够通过增强Rb相关的E2F-I聚合物的加快生长作用等非wtP53依赖方式调控细胞的增殖和凋亡[13]。本次实验我们加大样本量发现MDM2阳性表达率在30例正常增生期内膜中显著低于92例子宫内膜样腺癌(P<0.01),在30例复杂不典型增生中亦明显低于92例子宫内膜样腺癌(P<0.01)。并且在30例子宫内膜正常增生期组织中亦显著低于30复杂不典型性增生内膜(P <0.01),这与我们之前[14]癌变组织较少时的研究一致,提示高表达的MDM2蛋白在子宫内膜病变刚开始时就已经存在,MDM2基因异常激活在肿瘤进程中属于早期事件。另本研究还发现MDM2阳性表达率随着子宫内膜样腺癌病理学分级的降低及肌层浸润加深发生有增高势头,临床分期较高者表达亦高于较低者,淋巴结转移发生者相较未发生转移者表达亦相对高些,但统计学上均无意义。另外有学者[15]研究子宫内膜样腺癌亦发现MDM2阳性表达率与病理学分级的差异有统计学意义,与肿瘤临床分期、肌层浸润及淋巴结转移的差异没有统计学意义。综上说明MDM2基因活化始发于子宫内膜组织病变早期,在促进子宫内膜细胞从正常增生状态变成不典型增生,从不典型增生到高分化癌变中发挥至关重要的作用。单从本实验看,其在肿瘤后期恶化演进发展中的作用不是太明显,但并不代表其高表达不可进一步促进肿瘤侵袭,因为我们的实验只做了蛋白层次,而且还可能有误差的存在,故而需要进一步加深研究。
本次我们在92例子宫内膜样腺癌标本中研究TBX2与 MDM2蛋白的表达关系,得出 TBX2与MDM2蛋白表达呈正相关关系。与宋一村等[16]在45例子宫内膜样腺癌标本中的研究相符合。另外二者其在结肠腺癌和乳腺癌[17-18]等腺癌中的研究也是正向相关。提示两者在肿瘤特别是腺癌演进中起协同作用,其联系可能是TBX2通过阻遏P19ARF蛋白表达促进MDM2较强表达,亦有可能是内在结构有配套作用位点甚或其他相关途径。我们目前只用了免疫组化方法,具体机制还搞不清,需要进一步加深实验研究。不管机理如何,有一点是可以肯定的,即TBX2与MDM2在腺癌中起着癌基因的作用,当某些致癌因素有效活化它们后,可使级联反应的相关蛋白激活,引起正常细胞过度增殖后恶变聚积形成肿瘤。同时加速肿瘤侵袭和进展,子宫内膜样腺癌的侵袭转移过程接受多种基因调控,尤其在向肌层浸润时,当TBX2与MDM2都高表达形成合力,对肌层具有极强的破坏性。总之,TBX2与MDM2蛋白都高表达可提示肿瘤恶性程度较高和预后不佳,至于其能不能作为有用的生物标记分子或是基因治疗靶点,可能还需要更多的研究。
[1] 刘彭坤,郝吉庆.PARP-1、P-gp和LRP在肺腺癌中的表达和相关性研究[J].安徽医药,2014,18(5):851 -854.
[2] Teng H,Parker MI,Prince S.Functional characterization of cis -acting elements involved in basal transcription of the human TBX2 gene:a new slight into the role of Sp1 transcriptional regulation[J].Gene,2008,423(1):8 -13.
[3] Bilican B,Goding CR.Cell cycle regulation of the T-box transcription factor TBX2[J].Exp Cell Res,2006 ,312(12):2358-2366.
[4] Rowley M,Grothey E,Couch FJ.The role of Tbx2 and Tbx3 in mammary development and tumorigenesis[J].Journal of Mammary Gland Biology and Neoplasia ,2004,9(2):109 -118.
[5] Abrahams A,Parker MI,Prince S.The T-box transcription factor TBX2:its role in development and possible implication in cancer[J].IUBMB Life,2010,62(2):92 -102.
[6] Prince S,Carreira S,Vance K W,et al.Tbx2 directly represses the expression of the p21(WAF1)cyclin-dependent kinase inhibitor[J].Cancer Res,2004,64(5):1669 - 1674.
[7] Vance KW,Shaw HM,Rodriguez M,et al.The retinoblastoma protein modulates Tbx2 specificity[J].Mol Biol Cell,2010,21(15):2770-2779.
[8] Duo S,Tiao - Dong T,Lei Z,et al.Expression and clinical significance of Tbx2 in pancreatic cancer[J].Asian Pac J Cancer Prev,2009,10(1):118 -122.
[9] Douglas NC,Papaioannou VE.The T - box transcription factors TBX2 and TBX3 in mammary gland development and breast cancer[J].J Mammary Gland Biol Neoplasia,2013,18(2):143 -147.
[10]徐 傲,陈 柯,郭真理,等.子宫内膜样腺癌中TBX2、PAX9的表达及相关性[J].临床与实验病理学杂志,2012,28(2):158-161.
[11] Liu WK,Jiang XY,Zhang ZX.Expression of PSCA,PIWIL1,and TBX2 in endometrial adenocarcinoma[J].Onkologie,2010,33(5):241-245.
[12] Nag S,Qin J,Srivenugopal KS,et al.The MDM2 - p53 pathway revisited[J].J Biomed Res,2013,27(4):254 -271.
[13] Manfredi JJ.The Mdm2 - p53 relationship evolves:Mdm2 swings both ways as an oneogene and a tumor suppressor[J].Genes Dev,2010,24(15):1580 -1589.
[14]郭真理,陈 柯,王晓秋,等.子宫内膜样腺癌中MDM2、Livin和Caspase-3蛋白及mRNA的表达[J].安徽医科大学学报,2011,46(3):223 -227.
[15] Jeczen R,Skomra D,Cybulski M,et al.P53/MDM2 overexpression in metastatic endometrial cancer:correlation with clinicopathological features and patient outcome[J].Clin Exp Metastasis,2007,24(7):503-511.
[16]宋一村,王晓菲,包虹旭,等.MDM2基因和TBX2在子宫内膜样腺癌中的表达及临床意义[J].现代生物医学进展,2012,12(31):6127-6131.
[17]陈 樱,王本忠.乳腺浸润性导管癌中TBX2和MDM2表达及临床意义[J].临床与实验病理学杂志,2012,28(11):1211-1214.
[18]崔 婷,魏 强.结肠腺癌患者癌组织MDM2、TBX2和Pokeman表达及相关性[J].中国老年学杂志,2014,34(14):3896-3898.
