大鼠失神经不同时相的骨骼肌形态和MyoD表达变化
2015-03-22柯棠山刘坤祥
董 进,柯棠山,刘坤祥,2
(1.遵义医学院解剖教研室,贵州遵义563099;2.遵义医学院生物与医学中心实验室,贵州遵义563099)
大鼠失神经不同时相的骨骼肌形态和MyoD表达变化
董 进1,柯棠山1,刘坤祥1,2
(1.遵义医学院解剖教研室,贵州遵义563099;2.遵义医学院生物与医学中心实验室,贵州遵义563099)
目的研究大鼠失坐骨神经后MyoD在腓肠肌中不同时相的表达变化,进一步探讨骨骼肌失神经后再生修复机制。方法将48只2月龄SD雄性大鼠随机分为八组,每组6只。其中正常对照和失神经各四组,于术后2、7、14、28 d取材,分别标记为Z1、Z2、Z3、Z4组和S1、S2、S3、S4组。在相应的时相内取各组大鼠左、右后肢的腓肠肌测肌湿重后冻存以备后续实验。计算各组腓肠肌湿重比及其肌腹段HE染色后的横截面积,Western blotting检测MyoD在腓肠肌的表达。结果手术组失神经侧(S1F右、S2F右、S3F右、S4F右)大鼠腓肠肌湿重逐渐减小,且各时相肌湿重比比较,差异均有统计学意义(P<0.05);HE染色后腓肠肌的各时相平均横截面积逐渐减小,即各时相组内与组间比较,差异均有统计学意义(P<0.05);Western blotting检测各时相失神经侧较正常对照组腓肠肌的MyoD表达增加,差异有统计学意义(P<0.05)。结论大鼠腓肠肌失坐骨神经后第1周内出现明显肌萎缩现象,且萎缩速度在失神经前2周较快;MyoD蛋白在大鼠失坐骨神经后的表达增加,在失神经第2周时其表达量最高,随后开始降低,但仍高于正常大鼠。
骨骼肌; 肌形成调节因子; 肌萎缩; 坐骨神经; 去神经支配; 大鼠,Sprague-Dawley
周围神经损伤所致骨骼肌萎缩是临床常见的创伤疾病,而肌肉的再生与萎缩是一个复杂的细胞分子生物学调控过程。近年来相关研究表明,在此过程中成肌调节因子(MRFs)和转化生长因子具有重要作用。其中MRFs又称MyoD家族[1-3],主要包括MyoD、myogenin、myf-5、MRF4等成员,是一组具有生肌能力的转录调节因子,其中MyoD、myogenin的作用尤为突出,MyoD对其他类型细胞转化为成肌细胞和成肌细胞在分化为肌管的过程中起重要作用。在特异性基因转录中起着总开关的作用;有研究表明,MRFs可参与肌肉损伤修复,相关研究主要集中于创伤、神经源性和肌源性肌病(如肌营养不良症)所致的损伤[3-6]。而有关失神经所导致骨骼肌萎缩与MRFs,尤其与MyoD、myogenin蛋白表达的关系鲜见报道。本研究通过观察失坐骨神经后大鼠骨骼肌MyoD蛋白水平的变化,进一步探讨MyoD与骨骼肌失神经萎缩变化及修复机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 2月龄健康雄性SD大鼠48只[普通级,由重庆第三军医大学大坪医院实验动物中心提供,许可证号:SCXK(渝)2007-0005],体质量(220±20)g,随机分为八组,每组6只,分笼饲养。其中正常对照和失神经各四组分别于术后2、7、14、28 d取材,标记为Z1、Z2、Z3、Z4组和S1、S2、S3、S4组。
1.1.2 主要试剂与仪器 MULTISKAN酶标仪(Thero Scientific),Bio-Rad伯乐Mini-PROTEAN Tetra电泳槽,PowerPacTMBasic电泳仪(BIO-Rad),Odyssey红外激光成像系统(LI-COR公司);HE染色试剂盒,RIPA裂解液(Beyotime),BCA蛋白浓度测定试剂盒(Beyotime),苯甲基磺酰氟(PMSF),Tris(Bio-Rad),十二烷基磺酸钠(SDS,Sigma),浓盐酸,5×SDS上样缓冲液,脱脂奶粉,吐温-20(Beyotime),PVDF膜,预染蛋白分子量标准(Thermo scientific),兔抗大鼠GAPDH一抗(Proteintech),山羊抗兔荧光二抗。
1.2 方法
1.2.1 失神经模型的构建 将48只SD大鼠饲喂4 d后进行实验,随机分组称质量,标记。四组大鼠去坐骨神经模型,用浓度为3 mg/mL戊巴比妥钠以1 mL/100 g剂量进行腹腔麻醉后,取俯卧位,无菌操作下暴露其坐骨神经,于梨状肌下缘剪断其坐骨神经1 cm,缝合皮肤,等待其复苏,放回饲养笼饲养。
1.2.2 大鼠骨骼肌取材 分别于术后2、7、14、28 d称质量,麻醉后,在无菌条件下取双后肢的腓肠肌称其肌湿重,同时计算肌湿重比[(S右/S左)/(Z右/Z左)]。取相应肌腹段约0.5 cm宽放入4%多聚甲醛固定标记以备HE染色。其余放入冻存管于液氮冻存,以备后续实验。
1.2.3 肌肉组织HE染色 将已固定的组织标本通过自来水冲洗,经梯度乙醇脱水后二甲苯透明后浸蜡包埋,然后将石蜡包埋的组织行8 μm厚的切片,于温水中摊片用载玻片贴片;再进行脱蜡HE染色,经乙醇脱水后甲苯透明,最后中性树胶封片固定,以备显微镜观察采集图片,取200倍视野下计算肌肉横截面积。
1.2.4 Western blotting技术检测MyoD蛋白表达 (1)蛋白的提取及定量:液氮研磨法提取总蛋白,用BCA蛋白浓度测定试剂盒(增强型)行蛋白定量后再行蛋白变性。(2)电泳:中间各孔加10 μL样品,两侧加Marker,5%浓缩胶80 V,20 min;12%分离胶120 V,65 min。(3)转膜:低温300 mA恒流电转55 min将蛋白转至PVDF膜上。(4)封闭:5%脱脂奶粉封闭1.5 h。(5)一抗孵育:将一抗孵育PVDF膜4℃过夜后,PVDF膜用TBST洗膜3次,每次5 min。(6)二抗孵育:山羊抗兔荧光二抗在37℃、水平摇床上孵育1.5 h,用TBST洗膜2次,每次5 min,再用TBST洗膜5 min后行Odyssey红外激光成像系统曝光。
1.3 统计学处理 应用Image-Pro Plus软件计算图像横截面积;应用SPSS19.0统计软件进行数据分析,实验数据以±s表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠平均肌湿重比较 同时相手术组失坐骨神经(右)侧腓肠肌(SXF右,x代表第1、2、3、4组)与其对侧(SXF左)肌湿重比较,差异有统计学意义(P<0.05或0.01);手术侧腓肠肌平均肌湿重随时间延长逐渐减小,即S1F右与S2F右、S3F右、S4F右平均肌湿重比较,差异有统计学意义(P<0.01)。见表1。
表1 各组大鼠腓肠肌平均肌湿重比较(±s,g)
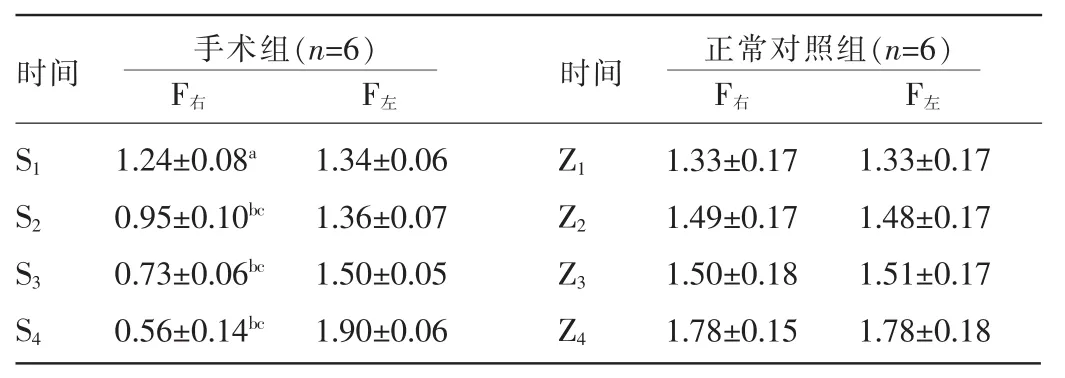
表1 各组大鼠腓肠肌平均肌湿重比较(±s,g)
注:与同组同时相左侧比较,aP<0.05,bP<0.01;与同组S1比较,cP<0.01。
时间 手术组(n=6)F右 F左时间 正常对照组(n=6)F右 F左S1 S2 S3 S4 1.34±0.06 1.36±0.07 1.50±0.05 1.90±0.06 1.24±0.08a0.95±0.10bc0.73±0.06bc0.56±0.14bcZ1 Z2 Z3 Z4 1.33±0.17 1.49±0.17 1.50±0.18 1.78±0.15 1.33±0.17 1.48±0.17 1.51±0.17 1.78±0.18
2.2 各时相腓肠肌肌湿重比 术后2、7、14、28 d肌湿重比(0.922、0.703、0.530、0.298)逐渐减小,相邻两组间比较,差异有统计学意义(P<0.05),且肌湿重比随时间变化第1周内萎缩速度最快,第2周后萎缩速度逐渐变缓。见图1。
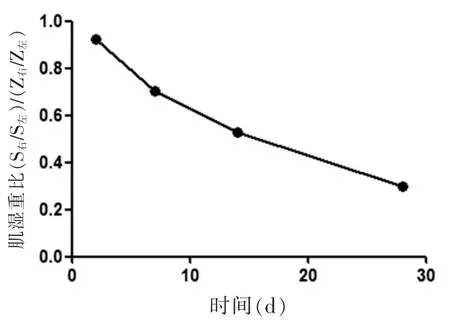
图1 肌湿重比随时间变化图
2.3 HE染色后各时相肌肉横截面积
2.3.1 各时相手术与正常右侧肌肉形态 肌肉横截面积随失神经时间增加而逐渐减小,肌纤维形态变得不规整,胶原纤维组织增生,随失神经时间的延长肌萎缩趋势逐渐减小。见图2。
2.3.2 各组各时相肌肉横截面积比较 腓肠肌横截面同时相手术侧(SXF右)与其对侧(SXF左)横截面积比较,差异有统计学意义(P<0.05);与同时相正常对照组横截面积比较,差异有统计学意义(P<0.05);手术侧腓肠肌相邻两组比较,差异有统计学意义(P<0.05)。手术侧腓肠肌横截面积随失神经时间的延长逐渐减小,差异有统计学意义(P<0.05)。见表2。
2.4 各组各时相MyoD表达情况 各时相手术组与正常对照组右侧腓肠肌所测MyoD/GAPDH百分比比较,差异有统计学意义(P<0.05);手术组MyoD蛋白表达量在第14天时出现高峰,随后开始降低,但仍高于正常对照侧。见图3、4。

图2 各组各时相HE染色图(200×)
表2 各组各时相肌肉横截面积比较(±s,×102μm2)
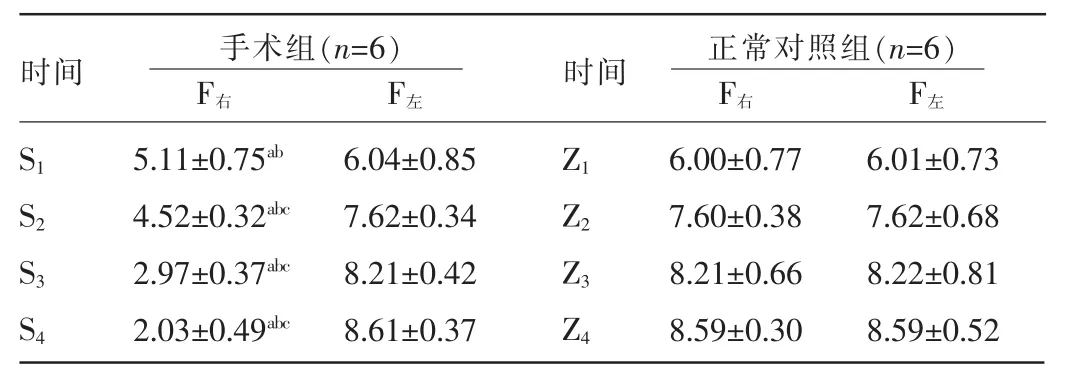
表2 各组各时相肌肉横截面积比较(±s,×102μm2)
注:与同组同时相左侧比较,aP<0.05;与正常对照组同时相比较,bP<0.05;cP<0.05。
时间 手术组(n=6)F右 F左时间 正常对照组(n=6)F右 F左6.01±0.73 7.62±0.68 8.22±0.81 8.59±0.52 S1 S2 S3 S4 5.11±0.75ab4.52±0.32abc2.97±0.37abc2.03±0.49abc6.04±0.85 7.62±0.34 8.21±0.42 8.61±0.37 Z1 Z2 Z3 Z4 6.00±0.77 7.60±0.38 8.21±0.66 8.59±0.30

图4 MyoD与GAPDH灰度值百分比条形图
3 讨 论
近年来相关研究表明,在肌肉的再生与萎缩过程中,MRFs和转化生长因子具有重要作用[4-6]。对其他类型细胞转化为成肌细胞和成肌细胞分化为肌管的过程中起重要作用,在特异性基因转录中起着总开关作用。有研究用Oct4的DNA结合区域融合性蛋白与MyoD强大转录活性结构域结合,其具有诱导染色质重塑的能力,可使已诱导的多功能干细胞(iPSCs)增加50倍[7]。本实验结果显示,失神经的骨骼肌均会出现不同程度的萎缩,且随着失神经支配时间的延长肌肉萎缩程度逐渐增加;并伴随着一系列的组织形态学、细胞分子生物学改变,肌肉横截面积逐渐减小,肌纤维形态变得不规整,胶原纤维组织增生,但随时间的延长肌萎缩速度逐渐减缓。这一结果可能与成肌调节因子的激活有关。
MyoD是一个具有bHLH结构的转录因子,其氨基酸末端具有强大而简单的转录激活结构域[6-8]。在肌肉生成方面,MyoD是使许多基因的基因座染色质重塑和募集具有活性转录复合物的主导转录因子[5,9-10]。胚胎时期,MyoD是由形成体节过程中的肌源性前体细胞转录的,对脊柱旁肌肉的形成非常重要[11]。有研究表明,MRFs可参与肌肉损伤修复,且对神经源性和肌源性肌病(如肌营养不良症)所致的损伤也有一定的修复作用[3-6]。MyoD去神经骨骼肌肉中的表达观点不一,大多数学者认为去神经为上调,但有的学者研究发现,失神经后MyoD表达不仅不增高反而下降,失神经损伤后导致MRFs表达差异的原因至今仍不太清楚[5,12-13]。研究表明,大鼠失神经性损伤的骨骼肌中肌卫星细胞MyoD+、myogenin+在损伤后的早期表达上调,2个月后急剧下降,1年后几乎不能检测到肌卫星细胞的存在[14-15]。本实验研究表明,各时相失神经骨骼肌中MyoD蛋白表达量均较正常对照组增加;且失神经组MyoD蛋白表达量在术后14 d时出现高峰,术后28 d时表达量降低但仍高于正常对照侧。
大鼠腓肠肌失坐骨神经后7 d内出现明显肌萎缩,且萎缩速度较快;MyoD蛋白在大鼠失坐骨神经后的表达增加,在失神经后7 d其表达量最高,随后开始降低,但仍高于正常对照组。由于大鼠失神经出现肌萎使MyoD蛋白表达增加,从而减缓了大鼠肌肉的萎缩速度,而长时间失神经可导致不可逆性肌萎缩,从而刺激MyoD蛋白进一步表达增加;而由于成肌细胞逐渐耗竭和某些凋亡因子的作用,导致了MyoD蛋白的表达又开始逐渐减少,从而出现了表达高峰。
[1]Wyzykowski JC,Winata TI,Mitin N,et al.Identification of novel MyoD gene targets in proliferating myogenic stem cells[J].Mol Cell Biol,2002,22(17):6199-6208.
[2]Ekmark M,Rana ZA,Stewart G,et al.De-phosphorylation of MyoD is linking nerve-evoked activity to fast myosin heavy chain expression in rodent adult skeletal muscle[J].J Physiol,2007,584(Pt 2):637-650.
[3]Borensztein M,Monnier P,Court F,et al.Myod and H19-Igf2 locus interactions are required for diaphragm formation in the mouse[J].Development,2013,140(6):1231-1239.
[4]潘同斌,钱福鸿,韩天翼,等.大负荷运动后不同时相大鼠骨骼肌成肌调节因子MyoD、myogenin表达的变化[J].中国运动医学杂志,2011,30(10):926-930.
[5]高宏飞,梁炳生,双卫兵.Myod1和Myog真核共表达载体构建及鉴定[J].中国组织工程研究,2013,17(37):6645-6651.
[6]Powell DJ,McFarland DC,Cowieson AJ,et al.The effect of nutritional status on myogenic gene expression of satellite cells derived from different muscle types[J].Poult Sci,2014,93(9):2278-2288.
[7]Mokalled MH,Johnson AN,Creemers EE,et al.MASTR directs MyoD-dependent satellite cell differentiation during skeletal muscle regeneration[J].Genes Dev,2012,26(2):190-202.
[8]Hirai H,Tani T,Kikyo N.Structure and functions of powerful transactivators:VP16,MyoD and FoxA[J].Int J Dev Biol,2010,54(11/12):1589-1596.
[9]Soleimani VD,Yin H,Jahani-Asl A,et al.Snail regulates MyoD bindingsite occupancy to direct enhancer switching and differentiation-specific transcription in myogenesis[J].Mol Cell,2012,47(3):457-468.
[10]Zhao P,Iezzi S,Carver E,et al.Slug is a novel downstream target of MyoD.Temporal profiling in muscle regeneration[J].J Biol Chem,2002,277(33):30091-30101.
[11]Camp JR.The known MyoD enhancers are largely dispensable for proper embryonic expression and cells of the MyoD expressing lineage are multipotentinthetrunkbutnottheoimbsofamyogenicembryos[D].Storrs:University ofConnecticut,2014.
[12]Launay T,Armand AS,Charbonnier F,et al.Expression and neural conn trol of myogenic regulatory factor genes during regeneration of mouse soleus[J].J Histochem Cytochem,2001,49(7):887-899.
[13]Xiong WM,Huang JH,Xie L,et al.Overexpression of MyoD attenuates denervated rat skeletal muscle atrophy and dysfunction[J].Neurosci Med,2012,3(4):387-393.
[14]Relaix F,Demignon J,Laclef C,et al.Six homeoproteins directly activate Myod expression in the gene regulatory networks that control early myogenesis[J].PLoS Genet,2013,9(4):e1003425.
[15]Voytik SL,Przyborski M,Badylak SF,et al.Differential expression of muscle regulatory factor genes in normal and denervated adult rat hindlimb muscles[J].Dev Dyn,1993,198(3):214-224.
Changes in the protein expression of MyoD and the skeletal muscles morphology of rats after denervation in different time phases
Dong Jin1,Ke Tangshan1,Liu Kunxiang1,2
(1.Department of Anatomy,Zunyi Medical University,Zunyi,Guizhou 563099,China;2.Central Laboratory of Biology and Medicine,Zunyi Medical University,Zunyi,Guizhou 563099,China)
ObjectiveTo explore the expression changes of MyoD after losing the sciatic nerve in rats′gastrocnemius musle at different time phases in order to investigate the skeletal muscle regeneration and repair mechanisms after denervation further.MethodsA total of 48 male SD rats aged 2-month-old were randomly divided into 8 groups,6 of each group including the 4 normal control groups and the 4 nerve-lost groups,obtaining the samples after 2,7,14,28 d respectively,marking group Z1,Z2,Z3,Z4and group S1,S2,S3,S4.It was removed the gastrocnemius muscle from the latter legs of each group in the different time phases to measure their wet muscle weight and then frozed to prepare the following experiements.The wet weight ratio of the gastrocnemius muscle and the cross-sectional area of musle belly setions stainied by HE.The expression of gastrocnemius muscle was detected by Western blotting.ResultsThe wet musle weight was gradually decreased in the denervation side(S1Fright,S2Fright,S1Fright,S4Fright)from the operation groups.There were statistically significant compared the wet weight among the above time pahses(P<0.05).The average cross-sectional area after HE staining was declined at different time phases,whose difference had statisti cal significance within the group and among the groups(P<0.05).The denervation sides in various time phases were increased than the normal control groups in MyoD protein by Western blotting.The difference was statistically significant(P<0.05).ConclusionThe amyotrophy occurred within 1 week after loseing ischiadic nerve of rats′gastrocnemius muscle and accelerated in the first two weeks.The MyoD protein expression were increased after loseing their ischiadic nerve.The expression amount reaches the peak at the second week of denervation,then began to decrease but still higher than controls.
Muscle,skeletal; Myogenic regulatory factors; Muscular atrophy; Sciatic nerve; Denervation;Rats,sprague-dawley
10.3969/j.issn.1009-5519.2015.08.002
:A
:1009-5519(2015)08-1124-03
2015-01-08)
贵州省科学技术基金项目(黔科合J字[2009]2号)。
董进(1987-),男,贵州沿河人,在读硕士研究生,主要从事骨骼肌失神经萎缩方面的研究;E-mail:601137533@qq.com。
刘坤祥(E-mail:1684429795@qq.com)。
