公山羊β防御素104a生物信息学分析及表达特性研究
2015-03-22任有蛇张国林郭丽娜张春香郑亚琳张彩霞乔利英吕丽华刘文忠
任有蛇,张国林,郭丽娜,张春香,郑亚琳,张彩霞,乔利英,靳 黎,吕丽华,刘文忠
(山西农业大学动物科技学院, 太谷 030801)
公山羊β防御素104a生物信息学分析及表达特性研究
任有蛇#,张国林#,郭丽娜,张春香*,郑亚琳,张彩霞,乔利英,靳 黎,吕丽华,刘文忠
(山西农业大学动物科技学院, 太谷 030801)
旨在预测山羊β防御素104a蛋白质特性,研究其在成年公山羊生殖组织及其他组织中的表达特性及其定位。采用在线软件对gBD104a基因(KJ508074.1)进行生物信息学分析,用QRT-PCR法检测gBD104amRNA在睾丸、附睾及其他组织中的表达情况,用免疫荧光技术对生殖组织和精子中的gBD104a进行定位。结果,(1)生物信息学分析结果表明gBD104a基因cDNA全长324 bp,编码107个氨基酸,第1~19个氨基酸为信号肽,第27~55个氨基酸为潜在的β防御素构象区域,在C端有7个潜在的O糖基化位点;(2)QRT-PCR结果表明,gBD104a在附睾体中表达量最高,在附睾头、气管、皱胃、空肠、回肠等组织中表达量较高,其他组织中表达量均较低;(3)免疫组化定位结果显示,在附睾头和体部的假复层纤毛柱状上皮细胞检测到较强的gBD104a阳性信号,在附睾尾部的纤毛柱状上皮细胞也检测到较强的阳性信号。gBD104a包裹在精子头部顶体和中段线粒体表面。gBD104a是一种分泌型糖蛋白,在成年公山羊机体各组织中广泛表达,但主要表达在附睾体,是精子表面的主要成分。推测可能与精子运动、顶体反应和获能有关。需要进一步深入研究其功能。
β防御素104a;生殖组织;表达特性及定位;公山羊
β防御素家族蛋白是一类含有多个半胱氨酸残基的阳离子抗菌肽,在机体组织上皮细胞中广泛表达[1],不仅具有广谱抗菌活性[1-3],还在色素沉积、吸引免疫细胞、免疫调节和生殖调控等多个方面具有重要生理作用[4]。β防御素在哺乳动物的雄性生殖器官中大量表达,且已被证明在雄性生殖过程中起重要作用[5-6]。Y.S.Zhou等[7]构建了9个β防御素基因先天缺失的雄性小鼠模型,发现这些试验小鼠产生的精子活力明显下降,且附睾尾中的精子表现出提前获能和自发顶体反应的现象,最终导致小鼠不育。Y.Heguo等[8]发现,人β防御素106(Human beta-defensins 106,hBD106)主要在附睾、睾丸和肺表达,在骨骼和皮肤中也有表达。hBD114和hBD118主要在附睾中表达,体外和体内试验发现其不仅可抵抗由脂多糖介导的炎症反应,还可避免由脂多糖引起的精子活力下降[9-10]。T.L.Tollner等[11]研究表明,猕猴精子获能过程中精子头部会脱落一部分蛋白,其主要成分为β防御素126蛋白。体外试验进一步发现β防御素126有保障精子穿过宫颈黏液和调节精子与输卵管上皮细胞结合的能力[12]。小鼠β防御素22(Mouse beta-defensins 22,mBD22)表达特点与之相似[13]。另外C.C.Pedro等[14]研究发现,mBD 29主要在附睾尾中大量表达,作为CCR6的配体对精子活力的保持具有特殊的作用。然而有关山羊β防御素104a(Goat Beta-Defensins 104,gBD104a)在体内表达定位的情况还鲜有报道。
本研究应用生物信息学方法分析预测其蛋白特性,并用QRT-PCR方法对gBD104a的mRNA在成年公山羊全身各组织中的表达情况进行分析,用组织免疫荧光技术对生殖组织和精子中gBD104a表达进行定位,探寻gBD104a基因的表达规律,为gBD104a的生物学功能的研究提供依据。
1 材料与方法
1.1 试验动物和组织样品采集
试验羊为健康的晋岚绒山羊公羊,由山西农业大学动物科技学院实验基地提供。选用体重相近18月龄的成年公羊4只,颈静脉放血致死,取每一个体的睾丸(Testis,Tes)、附睾头(Caput,Cap)、附睾体(Corpus,Cor)和附睾尾(Cauda, Cau)、气管(Trachea,Tra)、食管 (Esophagus,Eso)、皱胃(Abomasum,Abo)、十二指肠(Duodenum,Duo)、空肠(Jejunum,Jej)、回肠(Ileum,Ile)、胆囊(Gall bladder,Gab)、肠淋巴结(Payer’s patches,Pap)、腮腺(Parotid gland,Pag)、脾(Spleen,Spl)、扁桃体(Tonsil,Ton)、胸隔膜(Diaphragm,Dia)、视网膜(Retina,Ret)、下丘脑(Hypothalamus,Hya)、垂体(Hypophysis,Hyp)、甲状腺(thyroid gland,Thg)、肾上腺(Adrenal gland,Adg)、精囊腺(Seminal vesicle,Sev)、前列腺(Prostate glands,Prg)、膀胱(Bladder,Bla)、输精管(Seminiferous duct,Sed)、输尿管(Ureter,Ure)、心包膜(Pericardium,Per)、肺 (Lung,Lun)和肾(Kidney,Kid)组织同一部位的样品。所有样品用经过DEPC水处理的锡箔纸包被后放入冻存管,并迅速置于液氮中,采样结束后转移到-80 ℃冰箱中保存。
1.2 主要试剂
RNAiso Plus试剂 (D9180A)、SYBR PrimeScriptTMRT Reagent Kit试剂盒(DDR037A)、SYBR Premix Ex TaqTM试剂盒(DDR041A)均购自宝生物工程(大连)有限公司。Rabbit Anti-gBD104a多克隆一抗委托北京天成新脉生物技术有限公司制备,即用型SABC免疫组化试剂盒、FITC标记的Goat Anti-Rabbit二抗(BST08L30c)、绿色荧光染料均购自武汉博士德生物工程有限公司。
1.3 试验方法
1.3.1 生物信息学分析 gBD104a蛋白的基本理化性质用http://web.expasy.org/protparam/在线软件预测;gBD104a蛋白结构域采用http://smart.embl-heidelberg.de/在线软件SMART程序分析;糖基化位点采用http://www.cbs.dtu.dk/services/NetNGlyc/和http://www.cbs.dtu.dk/services/NetOGlyc/在线预测。
1.3.2 总RNA提取 按照RNAiso Plus试剂盒操作说明书步骤提取组织总RNA,用核酸蛋白测定仪(北京NanoDrop)测定总RNA的浓度和纯度,用DEPC处理水调整浓度至0.5 μg·μL-1左右,保存在-80 ℃。
1.3.3 cDNA合成 按照SYBR PrimeScriptTMRT Reagent Kit试剂盒说明书操作,10 μL体系为:随机引物0.5 μL,Oligo dT 引物0.5 μL, RT Enzyme MIX I 0.5 μL ,Total RNA模板0.5 μg,5 ×PrimeScriptTMMaster Mix 2 μL,RNase Free ddH2O 5.5 μL;反转录条件:37 ℃ 15 min,85 ℃ 5 s,其产物保存在-20 ℃。
1.3.4 引物设计与合成 根据GenBank数据库中gBD104a的mRNA序列(KJ508074.1)和18S rRNA序列(AF379200.1),通过Primer Premier 5.0 软件分别设计特异性引物,并在美国国立生物技术中心(NCBI)在线比对其特异性,引物由北京六合华大基因科技股份有限公司合成,参数见表1。
表1gBD104a和18S rRNA基因引物序列
Table 1 Oligo-nucleotide primers pairs for thegBD104aand 18S rRNA genes
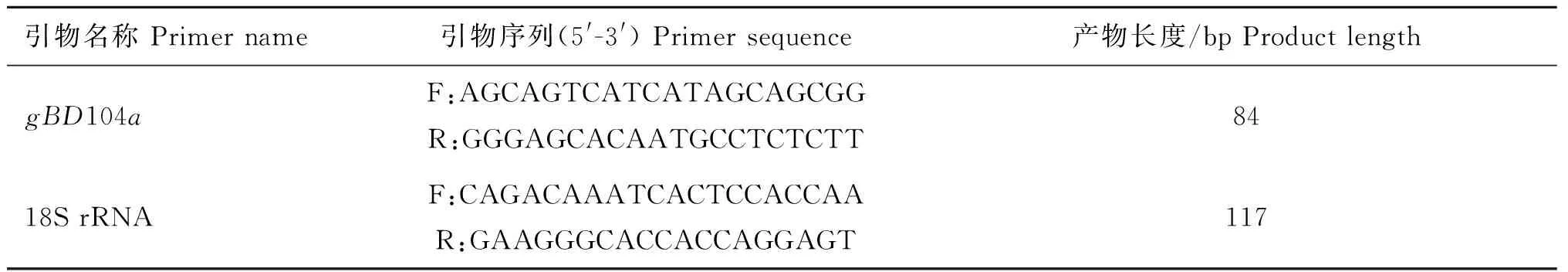
引物名称Primername引物序列(5'-3')Primersequence产物长度/bpProductlengthgBD104aF:AGCAGTCATCATAGCAGCGGR:GGGAGCACAATGCCTCTCTT8418SrRNAF:CAGACAAATCACTCCACCAAR:GAAGGGCACCACCAGGAGT117
1.3.5 常规RT-PCR检测 用15 μL PCR 反应体系:用mix正反向引物(10 μmol·L-1)各0.6 μL,山羊组织cDNA模板1.0 μL, 2×Taq MasterMix 7.5 μL,ddH2O 5.3 μL。反应条件:94 ℃ 3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 8 min。用2.0%琼脂糖凝胶检测PCR产物。
1.3.6 相对定量标准曲线的绘制 附睾头组织cDNA按照2×稀释8 个梯度,其浓度分别是2、22、23、24、25、26、27、28,无模板的空白作阴性对照,反应体系总体积20 μL:SYBR Premix Ex TaqTM10 μL,Rox Reference Dye Ⅱ 0.4 μL,cDNA模板2.0 μL,正反向引物1.6 μL,ddH2O 6.0 μL。扩增条件:95 ℃ 5 s,60 ℃ 35 s,共40 个循环。软件自动绘出标准曲线。
1.3.7 QRT-PCR QRT-PCR反应条件和反应体系同上,每个组织样本3个重复,导出定量PCR获得Ct值。
1.3.8 组织免疫荧光分析 参照施力光等[15]描述的山羊生殖器官免疫荧光试验的步骤:切片(厚度 0.5 μm)、脱蜡、梯度乙醇脱水、3.0% H2O2(80%甲醇)抗原修复、封闭。Rabbit Anti-gBD104a多克隆一抗按照1∶50稀释,4 ℃过夜;PBS冲洗3 次各 5 min;加FITC标记二抗37 ℃,30 min;PBS洗3次;加SABC复合物37 ℃,30 min;PBS冲洗4 次;然后绿色荧光染色;脱水、透明、封片。同时用抗体稀释液PBS代替一抗做阴性对照。荧光正置生物显微镜(Olympus)下观察,拍照。
1.4 数据处理
采用2-ΔΔCt计算gBD104a相对定量结果。设定gBD104a在成年附睾头中的相对表达量为1。数据处理和分析用Excel 2007和SPSS 17.0。组织免疫组化图片用Image-proplus 7.0分析。
2 结 果
2.1 gBD104a蛋白生物信息学分析
2.1.1 gBD104a蛋白基本理化性质分析gBD104a基因编码的mRNA全长989 bp,递交NCBI数据库GenBank No.:KJ508074。其中CDS区长324 bp,为1个完整的开放阅读框(ORF),编码107个氨基酸。目的蛋白分子质量(MW)为11.82 ku,理论等电点(pI)为9.75,不稳定系数为57.29,大于40,为不稳定蛋白。对氨基酸所占比例进行统计分析,结果显示有16个带正电荷的Arg+Lys残基,有7个带负电荷的Asp+Glu残基;不同性质氨基酸所占的比例不同,疏水系数为55.61,亲水性指数总平均为-0.426,说明蛋白分子为亲水性蛋白;蛋白浓度在1 g·L-1时,半胱氨酸未形成二硫键时吸光系数(Abs)为1.215,预测所有的半胱氨酸成对形成胱氨酸;预测不稳定系数为57.29,大于40。说明目的基因编码的蛋白质为不稳定蛋白。
2.1.2 gBD104a蛋白关键结构域分析 SMART程序分析结果如图1所示,gBD104a蛋白的CDS区序列编码的蛋白质前19个氨基酸区域为信号肽区域,另外在序列第27~55个氨基酸处为潜在的防御素区域,具有典型的C-X6-C-X3-C-X9-C-X5-CC-防御素特有的构象,为6个半胱氨酸残基所囊括的区域。

图1 gBD104a编码的蛋白质SMART分析Fig.1 SMART analysis of the protein translated from goat gBD104a gene
2.1.3 gBD104a蛋白糖基化位点预测 根据在线网站的分析结果,该蛋白没有潜在的N糖基化修饰位点,有7个潜在的O糖基化修饰位点,分别在gBD104a蛋白的第63、83、86、94、97、102和103位氨基酸处。
2.2gBD104a在成年公羊各组织中的表达特性
2.2.1 总RNA提取及常规RT-PCR检测 用核酸蛋白测定仪检测各种组织总RNA的A260 nm/A280 nm均为1.8~2.0,2.0%变性琼脂糖凝胶电泳结果显示,28S、18S清晰,无降解(图略),可以进行反转录。以不同组织cDNA为模板进行目的基因和内参基因常规RT-PCR反应,其产物琼脂糖凝胶电泳检测结果见图2。从图2可以看出,所检测的组织中均有gBD104的表达,其中以气管、皱胃、空肠、回肠等组织的条带相对于其他组织更明显。将产物回收测序,测序结果与GenBank(KJ508074)序列相似性达到98%以上,可以开展后续的QRT-PCR检测。
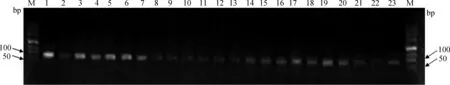
1~23.气管;食管;皱胃;十二指肠;空肠;回肠;胆囊;肠淋巴结;腮腺;脾;扁桃体;下丘脑;垂体;甲状腺;肾上腺;精囊腺;前列腺;膀胱;输精管;输尿管;心包膜;肺;肾1-23.trachea;esophagus;abomasum;duodenum;jejunum;ileum;gall bladder;payer’s patches;parotid gland;spleen;tonsil;hypothalamus;hypophysis;thyroid gland;adrenal gland;seminal vesicle;prostate glands;bladder;seminiferous duct;ureter;pericardium;alveolus pulmonary;kidney图2 RT-PCR检测成年公羊各组织gBD104a 表达量Fig.2 gBD104a expression in different tissues of bucks dertermined by RT-RCR
2.2.2 定量标准曲线的建立 图3A为软件自动绘制的标准曲线。从图可以看出,在8个数量级梯度上线性关系良好,gBD104a和18SrRNA回归系数分别为0.998和0.997,扩增效率分别为104.4%和103.3%,说明本研究建立的定量检测gBD104a和18S rRNA的方法有效;图3B为gBD104a和18S rRNA QRT-PCR的扩增动力学曲线,其基线平稳、拐点清楚、平行性好。图3C为其熔解曲线,仅有单一峰,说明没有非特异性产物和引物二聚体。
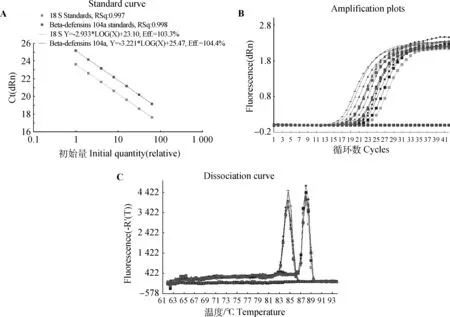
A.标准曲线;B.扩增动力学曲线;C.熔解曲线A.Standard curves of gBD104a and 18S rRNA gene;B.PCR amplification plots;C.Dissociation curves图3 gBD104a 与18S rRNA标准曲线建立Fig.3 Construction of standard curves for gBD104aA and 18S rRNA
2.2.3gBD104amRNA在生殖器官中的表达量 成年公羊生殖器官各组织gBD104amRNA定量分析结果见图4。从图4可知,成年公羊生殖器官各组织gBD104amRNA表达量顺序:附睾体>>附睾头>附睾尾>输精管>睾丸、前列腺和精囊腺。附睾体中gBD104amRNA表达量显著高于其他生殖器官中的表达量,是睾丸组织的107.5倍(P<0.05),是附睾头的18.27倍(P<0.05)。附睾头、附睾尾和输精管gBD104amRNA表达量显著高于睾丸、前列腺和精囊腺(P<0.05)。

不同小写字母表示差异显著(P<0.05)The different lowercases indicate significant difference(P<0.05)图4 生殖器官各组织gBD104a mRNA相对表达量Fig.4 Relative expression levels of gBD104a mRNA in reproduction organs
2.2.4gBD104amRNA在其余各组织中的表达量 山羊其他组织中gBD104a荧光定量分析结果如图5所示。在所检测的其他组织中,气管中gBD104amRNA表达量最高,其显著高于皱胃的(P<0.05),极显著高于空肠和回肠(P<0.01);皱胃gBD104amRNA表达量显著高于空肠和回肠(P<0.05),极显著高于胆囊、十二指肠、胸隔膜、输尿管和肾(P<0.01)。然而在下丘脑、甲状腺、肾上腺和腮腺等重要分泌器官、肠淋巴结和扁桃体等免疫器官表达量均较低,显著低于输尿管和胸膈膜等组织(P<0.05)。在垂体和小脑中gBD104amRNA表达量很低。全身各组织中,以附睾体中的gBD104amRNA表达量最高,其次是附睾头和气管,再者是皱胃、附睾尾、输精管、空肠和回肠,其余各组织中gBD104amRNA相对表达量均低于0.2。除附睾外,在气管和消化道分泌活动旺盛的上皮组织中gBD104amRNA表达量也较高。

图5 其他组织GBD104a mRNA相对表达量Fig.5 Relative expression levels of GBD104a mRNA in other tissues
2.3 gBD104a在成年公羊睾丸、附睾和精子中的定位
2.3.1 gBD104a在成年公羊睾丸和附睾中的定位 gBD104a通过免疫组化技术在成年公羊睾丸、附睾中的定位结果见图6。gBD104a是分泌蛋白,图6显示,仅在附睾头和附睾体的假复层上皮细胞中检测到阳性信号,在附睾尾部的柱状上皮细胞和精浆中有较为明显的阳性信号,在睾丸组织中检测到微量阳性信号。
2.3.2 gBD104a在成年公羊精子中的定位 gBD104a在成年公羊精子中的定位结果见图7。从图7A可以看出,gBD104a包裹在精子头部顶体上和精子尾部中段线粒体上。精子尾部的主段和末端没有gBD104a的包裹。而图7B阴性对照精子头部和尾部都没有阳性信号。
3 讨 论
3.1 gBD104a生物信息学分析
gBD104a为近年新发现的β防御素家族成员,仅与牛防御素家族中精子相关抗原11的B型剪接体[16]和牛类β防御素15有部分同源区域。图1显示,经SMART程序预测到潜在的防御素构象正是gBD104a蛋白序列6个半胱氨酸残基所在的区域。蛋白质理化分析预测这6个半胱氨酸残基两两相连,符合β防御素保守的立体结构模式[1]。T.Ganz等[1-2]证明,β防御素这种特殊的构象是维持其生理活性的关键,Y.Suresh等[9]进一步研究发现,防御素构象在发挥其免疫作用的过程中起关键作用。因此推测,gBD104a可能同其他β防御素一样具有免疫功能。
糖基化位点可以使蛋白质抵抗消化酶的作用,并且只有在该位点发生糖基化修饰才能使原蛋白质正常折叠[17]。糖基化位点预测分析结果说明gBD104a蛋白C末端可能发生高度O糖基化修饰。精子表面的蛋白质在射出体外之前会有一个明显的糖基化修饰过程。当处在雌性生殖道中时,精子表面的糖蛋白修饰又会有一个系统的移除或改变构象的过程,这个过程也是精子获能的特征之一[18]。T.L.Tollner等[19]在研究猕猴β防御素126对精子的作用时也证明了高度O糖基化修饰的这种作用。以此推测,gBD104a蛋白C端糖基化修饰可能对精子成熟及生殖免疫识别有重要作用。
3.2 公山羊生殖组织中gBD104a表达特性分析
在哺乳动物中大部分的β防御素基因主要在雄性输精管道中表达,且表达均受雄激素调控,并在性成熟时得以加强,暗示着β防御素具有生殖和宿主防御的双重作用。精子由睾丸产生后,在附睾中成熟,附睾尾中贮存[20-21],附睾头和附睾体则是精子主要的成熟场所,其复杂的管腔液是影响精子成熟的重要因素[22-24]。A.J.Scott等[25]曾研究了β防御素家族在大鼠和小鼠附睾各部分的基因转录表达水平,结果显示,其中的29个成员分别在附睾不同的部位有明显的区域特异性表达。本研究结果显示,附睾头和附睾体是gBD104a在公山羊生殖组织中的主要表达场所,这说明gBD104a编码的蛋白质可能在精子成熟过程中发挥重要作用,且蛋白质发挥生理功能的主要部位可能是附睾体。
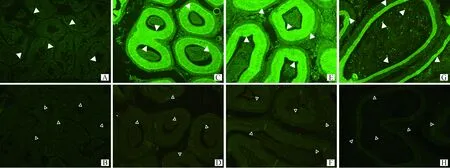
其中A、C、E和G分别为睾丸、附睾头、附睾体和附睾尾阳性。B、D、F和H分别为睾丸、附睾头、附睾体和附睾尾的阴性对照;A.gBD104a在睾丸组织中检测到微量阳性信号;C和E.gBD104a分别在附睾头和体部的假复层柱状上皮细胞中被检测到强阳性信号;G.gBD104a在附睾尾部的柱状上皮细胞和管腔液中被检测到较强的阳性信号B,D,F and H are negative controls of adult goat testis,caput,corpus and cauda,respectively;A.The weak positive signal of gBD104a is detected in testis;C and E.gBD104a strong positive signals are detected in pseudostratified ciliated columnar epithelium of caput, and corpus,respectively;G.gBD104a strong positive signal is detected in columnar epithelium of cauda and luminal liquid图6 睾丸和附睾gBD104a 免疫组化结果 400×Fig.6 Immunohistochemistry results of gBD104a in testis and epididymis 400×

图7 精子gBD104a的免疫荧光结果 400×Fig.7 Immunohistochemistry results of gBD104a in sperm 400×
3.3 成年公山羊机体各组织中gBD104a的表达特性分析
防御素家族成员均含有保守的多个半胱氨酸残基和高度相似的三级结构,因此都有广谱抗菌活性[26],gBD104a也不例外。图5结果显示,gBD104amRNA在气管、皱胃和小肠等与外界相通的管道中表达较多,在其他组织中表达较少。气管、皱胃和小肠等器官含有丰富的上皮组织,分泌活动旺盛,在机体免疫抵抗致病微生物方面起重要作用,这些组织中相对较高的表达量暗示着其蛋白可能具有一定的抗菌作用;然而gBD104在淋巴结、腮腺、脾、扁桃体等免疫器官内表达量较少,不能体现
其免疫特性,这可能与防御素家族蛋白有别于传统免疫过程的独特杀菌机理有关[9]。gBD104在下丘脑和垂体中表达较少,说明该蛋白不是性腺轴上的主要信号蛋白。另外,gBD104在甲状腺、肾上腺、精囊腺、前列腺等腺体器官以及膀胱、输精管、输尿管、心包膜、肺泡、肾等分泌活动贫乏的上皮组织中表达较少,说明从防御素家族高度进化而来的gBD104a拥有高度特异的生理功能,不仅简单履行免疫调节作用,可能只在特定条件下发挥其独特的生理作用。
3.4 gBD104a在成年公山羊附睾体和精子中的定位
目前关于gBD104a定位表达的研究很少。本研究结果显示,gBD104a在睾丸和附睾的上皮组织中均有表达,其在睾丸中有微量表达,主要表达在于附睾中柱状上皮细胞伸向附睾管腔的部分,尤其是细胞末端的纤毛部分有明显的阳性信号,推测gBD104a可能在精子成熟过程中发挥重要作用。有资料表明,β防御素的一些其他成员在牛、人、大鼠的整个附睾上皮细胞内均有表达[24]。Y.Heguo等[8]发现,人β防御素114在附睾管腔的起始部位大量聚集,离管腔越远表达量越低,作用是防止精子由脂多糖介导的炎症反应而导致的运动能力的下降;C.W.A.Maria等[16]通过免疫组化技术研究发现,SPAG11D/E同样是在附睾上皮组织中表达,并且在附睾管腔的起始和末梢部位大量聚集,精子免疫荧光技术显示其覆盖精子尾部,但是具体作用未知。本研究中,精子免疫荧光结果显示,gBD104a包裹在精子头部前段顶体和精子中端线粒体表面,验证了其生物信息学分析的结果,gBD104a是一种分泌型糖蛋白,参与了精子表面的糖蛋白修饰过程。K.Toshimore等[27]在1991年研究发现,蛋白质发生高度O糖基化修饰后会携带负电荷,可以与唾液酸末端链接覆盖在精子表面,不仅在附睾中起到精子加工和贮存的作用,还在雌性生殖道内起到保护、免疫识别和去能因子的作用。因此,推测gBD104a可能与顶体反应、精子运动或免疫识别有关,具体生物学功能需要进一步研究证实。
4 结 论
gBD104a基因编码的mRNA全长989 bp,其中cDNA全长324 bp,前19个氨基酸为信号肽区域,第27~55个氨基酸为潜在的β防御素构象区域,C端预测到7个潜在的O糖基化位点。gBD104a在成年山羊体内广泛表达,生殖组织中附睾体是主要的转录表达部位。在气管、皱胃、空肠、回肠等分泌活动旺盛的上皮细胞内表达较高,但其他组织中的表达量较低。gBD104a定位在附睾的上皮组织中、精子顶体和尾部中段线粒体上。推测其可能与精子运行、顶体反应和获能、免疫识别等有关,其具体生物学功能需进一步研究。
[1] GANZ T.Defensins:antimicrobial peptides of innate immunity[J].NatRevImmunol,2003,3:710-720.
[2] LEHRER R I.Primate defensins [J].NatRevMicrobiol,2004,2:727-738.
[3] DIAMOND G,BEVINS C L.β-Defensins:endogenous antibiotics of the innate host defense response [J].ClinImmunolImmunopathol,1998,88:221-225.
[4] SEMPLE F,DORIN J R.Beta-defensins:multifunctional modulators of infection,inflammation and more [J].InnateImmunol,2012,4:337-348.
[5] OH J,LEE J,WOO J M,et al.Systematic identification and integrative analysis of novel genes expressed specifically or predominantly in mouse epididymis [J].BMCGenomics,2006,7:314.
[6] PATIL A A,CAI Y,SANG Y,et al.Cross-species analysis of the mammalian beta-defensin gene family:presence of syntenic gene clusters and preferential expression in the male reproductive tract [J].PhysiolGenomics,2005,23:5-17.
[7] ZHOU Y S,WEBB S,LETTICE L,et al.Partial deletion of chromosome 8 beta-defensin custer confers sperm dysfunction and infertility in male mice [J].PLoSGenet, 2013,9(10):e1003826.
[8] HEGUO Y,JING D,YIHUA G,et al.The novel human β-Defensin 114 regulates lipopolysaccharide (LPS)-mediated inflammation and protects sperm from motility loss [J].JBiolChem,2013,288(17):12270-12282.
[9] SURESH Y,KATHERINE G H,FRANK S F,et al.The androgen-regulated epididymal sperm-bingding protein,human β-defensin 118(DEFB118) (formerly ESC42),is an antimicrobial β-defensin [J].Endocrinology,2004,145(7):3165-3173.
[10] RODRIJUEZ-JIMEEZ F J,KRAUSE A,SCHULZ S,et al.Distribution of new human β-defensin genes clustered on chromosome 20 in functionally different segments of epididymis [J].Genomics,2003,81:175-183.[11] TOLLNER T L,YUDIN A I,TREECE C A,et al.Macaque sperm release ESP13.2 and PSP94 during capacitation:the absence of ESP13.2 is linked to sperm-zona recognition and binding [J].MolReprodDev,2004,69:325-327.
[12] THEODORE L,TOLLNER,YUDIN A I,et al.Macaque sperm coating protein DEFB126 facilitates sperm penetration of cervical mucus [J].HumReprod,2008,23(11):2523-2534.
[13] YUDIN A I,TOLLNER T L,TREECE C A,et al.β-defensin 22 is a major component of the mouse sperm glycocalyx [J].Reproduction,2008,136(6):753-765.
[14] PEDRO C C,MARIANO G B,FABIAN B,et al.A role for the chemokine receptor CCR6 in mammalian sperm motility and chemotaxis [J].CellPhysiol,2014,229(1):24418-24441.
[15] 施力光,荀文娟,岳文斌,等.山羊PHGPx基因在不同组织中的表达特点及性腺中的定位[J].中国农业科学,2010,43(17):3653-3659. SHI G L,XUN W J,YUE W B,et al.Tissue expression profile and cellular localization of PHGPx in gonad of goat[J].ScientiaAgriculturaSinica,2010,43(17):3653-3659.(in Chinese)
[16] MARIA C W A,LUCIANA H,KATHERINE G H,et al.Novel aspects of the sperm-associated antigen 11 (SPAG11) gene organization and expression in cattle (Bostaurus) [J].BiolReprod,2007,76:1103-1116.
[17] 刘凌云,薛绍白,柳惠图.细胞生物学[M].北京:高等教育出版社,2002:89-92. LIU L Y,XUE S B,LIU H T.Cell biology[M].Beijing:Higher Education Press,2002:89-92.(in Chinese)
[18] SCHROTER S,OSTERHOFF C,MCARDLE W.The glycocalyx of the sperm surface [J].HumReprodUpdate,1999,5:302-313.
[19] TOLLNER T L,YUDIN A I,TARANTAL A F,et al.Beta-defensin 126 on the surface of macaque sperm mediates attachment of sperm to oviductal epithelia [J].BiolReprod,2008,78:400-412.
[20] HINTON B T,PALLADINO M A,RUDOLPH D,et al.The role of the epididymis in the protection of spermatozoa [J].CurrentTopicsDevBiol, 1996,33:61-102.
[21] JONES R C.To store or mature spermatozoa? The primary role of the epididymis [J].IntJAndrol,1999,22:57-67.
[22] HINTON B T,PALLADINO M A.Epididymal epithelium:its contribution to the formation of a luminal fluid microenvironment [J].MicroscopyResTech,1995,30:67-81.
[23] MOORE H D.Contribution of epididymal factors to sperm maturation and storage [J].Andrologia,1998,30:233-239.
[24] DACHEUX J L,GATTI J L,DACHEUX F.Contribution of epididymal secretory proteins for spermatozoa maturation [J].MicroscopyResTech, 2003,61:7-17.
[25] SCOTT A J,TERRY T T,HYUN J B,et al.The rat epididymal transcriptome:comparison of Segmental gene expression in the rat and mouse epididymides [J].BiolReprod,2007,76:561-570.
[26] XIN A,ZHAOY,YU H,et al.Soluble fusion expression,characterization and localization of human beta-defensin 6[J].MolMedRep,2014,9(1):149-155.
[27] TOSHIMORE K,ARAKI S,OURA C,et al.Loss of sperm surface sialic acid induces phagocytosis:anassay with a monoclonal antibody T21,which recognizes a 54K sialoglycoprotein [J].ArchivesAndrol, 1991,27:79-86.
(编辑 郭云雁)
Bioinformatics Analysis and Expression Characteristics of Goat Beta-defensin 104a Gene in Adult Bucks
REN You-she#,ZHANG Guo-lin#,GUO Li-na ,ZHANG Chun-xiang*,ZHENG Ya-lin, ZHANG Cai-xia,QIAO Li-ying,JIN Li,LÜ Li-hua,LIU Wen-zhong
(CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu030801,China)
The objectives of this study were to analyze the goat beta-defensins 104a (gBD104a) gene by bioinformatics,and to investigate the expression levels of gBD104a in various tissues of adult bucks and the location in reproduction organ and sperms.Bioinformatics analysis ofgBD104a(GenBank No.:KJ508074.1) was made by software online.Relative mRNA expressions were detected by real-time fluorescent quantitative PCR.Cellular localization of gBD104a in testes,epididymidis and sperms were examined by immunohistochemistry.The results showed that:(1) The results of bioinformatics analysis showed that the cDNA ofgBD104agene contains 324 nucleotides,including a complete open reading frame (ORF) encoding 107 amino acids,software online predictded 1-19 amino acids as signal peptide area,27-55 amino acids for potential beta defensins motif,7 potential O-glycosylation sites on C-terminal;(2) The results of QRT-PCR showed thatgBD104amRNA was widely expressed,but the relative expression ofgBD104amRNA was the highest in cauda epididymis.Expressions ofgBD104amRNA in caput epididymis,tracheal,abomasums,jejunum and ileum were more than those in other tissues;(3)The results of immunohistochemistry showed that there were strong positive signal of gBD104a in pseudostratified ciliated columnar epithelium of caput and corpus,and strong positive signal in columnar epithelium of cauda.gBD104a was located on the sperm acrosome and mitochondria surface.gBD104a was an epididymal secretory glycoprotein.gBD104amRNA was widely expressed in various tissues of bucks,while the highest expression levels was in cauda epididymis.gBD104a was coated on sperm surface,which maybe play an important role in sperm motility,acrosome reaction and capacitation process.Therefore,the physiological functions of gBD104a needs be further researched.
goat beta-defensin 104a;reproductive tissues;expression characteristics and localization;bucks
10.11843/j.issn.0366-6964.2015.02.007
2014-10-30
山西省科技攻关计划项目(20110311029; 20130311025-2)
任有蛇(1970-),男,山西岢岚人,副教授,博士,主要从事动物繁殖调控研究,E-mail:rys925@126.com;张国林(1989-),男,山东青岛人,硕士生,主要从事动物繁殖调控研究,E-mail:zhangguolin1989@126.com。任有蛇和张国林为共同第一作者
*通信作者:张春香,副教授,E-mail:zhchx66@126.com
S827.2
A
0366-6964(2015)02-0219-09
