温度与脂多糖对栉孔扇贝血细胞吞噬活力的影响❋
2015-03-22徐翊轩战文斌
徐翊轩, 战文斌, 邢 婧
(中国海洋大学教育部海水养殖重点实验室,山东 青岛 266003)
温度与脂多糖对栉孔扇贝血细胞吞噬活力的影响❋
徐翊轩, 战文斌, 邢 婧❋❋
(中国海洋大学教育部海水养殖重点实验室,山东 青岛 266003)
贝类无特异性免疫系统,细胞吞噬是其免疫防御的重要方式之一。在5、10、15、20和25℃养殖条件下,给栉孔扇贝(Chlamysfarreri)分别注射荧光微球、脂多糖和荧光微球混合液。在注射后的0, 6, 12, 18, 24, 30, 36, 42和48h抽取血细胞,用荧光标记血细胞以观察其对微球的吞噬状态,用流式细胞术测定血细胞对微球的吞噬率。结果表明,在5个养殖温度下,2个处理组均自6h后扇贝血细胞内即出现吞噬的微球,之后吞噬率逐渐上升,直到18~24h达到最高峰,随后逐渐下降。5、10、15、20和25℃条件下,注射荧光微球组血细胞最大吞噬率分别为8.66%±0.26%、14.00%±0.22%、16.97%±0.55%、25.62%±0.88%和8.97%±0.25%,注射脂多糖和荧光微球混合液组分别血细胞最大吞噬率为9.75%±0.48%、17.49%± 0.43%、23.13%±0.57%、34.16%±0.97%和10.42%±0.45%。20℃组的两处理组血细胞吞噬率显著高于其他温度组,其次是15和10℃组,最低是5和25℃组,并且20、15℃组的最大吞噬率出现在18h,其他组均在24h。各养殖温度组中,脂多糖和荧光微球混合液组血细胞吞噬率均高于荧光微球组。研究表明:栉孔扇贝血细胞的吞噬活力受水温影响显著,脂多糖能够显著增强扇贝血细胞的吞噬活力。
栉孔扇贝; 血细胞; 吞噬活力; 温度; 脂多糖
贝类血细胞是其免疫防御的主要组成部分,血细胞通过吞噬、包囊、胞吐及活性氧产生等完成细胞免疫,还通过分泌和释放各种免疫因子参与体液免疫[1-2]。血细胞的吞噬作用是细胞免疫的主要方式,吞噬过程主要包括趋化作用、识别接触、内化和消化4个阶段[3],最后清除异物。血细胞吞噬过程涉及多种因子与细胞类型,因此在某种程度上能够反应出机体生理等健康状况[4-5]。众多研究发现,环境因子[6-8]、外源刺激[9-10]和病源感染等[11-13]均会引起贝类血细胞吞噬活性的变化。水温是影响贝类免疫防御的重要环境因子,研究发现,过高的水温是栉孔扇贝(Chlamysfarreri)大规模死亡的主要原因之一[14-15],水温的骤然改变会引起贝类血细胞吞噬率、活性氧产量及酶活性等的变化[15-17]。脂多糖是革兰氏阴性细菌外膜的组成部分,被称为固有免疫的重要激活剂之一,具有免疫调节作用[18-19],有研究发现其在激活血细胞增殖[20]、活化酶原[21]、增强细胞吞噬活性[22]等方面效果显著。在双壳类中, 针对血细胞的吞噬作用已开展大量研究,目前多应用显微镜观察计数法、光密度法及流式细胞术研究吞噬活性[23]。直接计数法比较直观,但测定样品量有限,计算误差较大;流式细胞仪方法测定血细胞数较多,但细胞本身自发荧光干扰等因素不能确定吞噬的准确性。荧光微球是高分子微球,颗粒度均一、稳定性好,应用于细胞吞噬率的检测具有荧光强度均一、易于观察、误差小等优点,在生物医学领域中示踪目标细胞、免疫标记、药物载体选择等方面应用广泛[24],结合流式细胞术检测细胞吞噬率具有准确、灵敏、直观等优点。因此,采用荧光微球吞噬、流式细胞仪测定方法能够直观、准确、快速的测定血细胞的吞噬率此方法是目前优选的细胞吞噬测定方法。
栉孔扇贝是中国北方主要的养殖贝类,前期研究发现水温突变对扇贝血细胞数量的变化影响显著,甘露糖刺激能显著激活血细胞内6种内源酶的活力[13]。本文在此基础上研究栉孔扇贝在5、10、15、20和25℃养殖水温下,分别注射荧光微球、脂多糖和荧光微球混合液,观察血细胞吞噬状态,测定血细胞吞噬率,研究水温和脂多糖对血细胞吞噬活力的影响,以期为栉孔扇贝血细胞吞噬作用的研究提供数据。
1 材料与方法
1.1 实验动物及荧光微球和脂多糖的注射实验
栉孔扇贝(Chlamysfarreri)(壳长(7.0±0.3)cm)采自青岛八号码头扇贝养殖场,于水温17℃下暂养。将暂养扇贝随机分成5组,分别养殖于水温为5、10、15、20和25℃的容器中。一周后,将每个水温的扇贝随机分成3组,每组100只。第一组于闭壳肌注射100μL浓度为109particles/mL的荧光微球(Fluorescent microparticles,FM,Polysciences, 美国;直径为1μm,微球标记藻红蛋白)磷酸盐缓冲液(PBS,8g NaCl,0.2g KCl,2.9g Na2HPO4,0.2g KH2PO4,5.58g EDTA,加蒸馏水至1L,pH=7.2);第二组注射100μL脂多糖(Lipopolysaccharide,LPS,Sigma, 德国)和FM的PBS混合液,LPS和FM的终浓度分别为1.0mg/mL和109particles/mL;第三组注射100μL的PBS。分别于处理后0、6、12、18、24、30、36、42和48h,在各养殖温度下的各实验组随机取扇贝10只,抽取血淋巴,用于观察血细胞的吞噬状态和测定血细胞的吞噬率。
1.2 血细胞悬液制备
以装有预冷抗凝剂(PBSE:8g NaCl,0.2g KCl,2.9g Na2HPO4,0.2g KH2PO4,5.58g EDTA,加蒸馏水至1L,pH=7.2)的无菌注射器以1∶1比例从取样扇贝闭壳肌血窦中抽取血淋巴;之后400g 4℃离心10min,以PBS重悬血细胞沉淀,再离心洗涤2次;最后用PBS重悬,调整浓度约为107cells/mL,即为血细胞悬液,用于细胞标记荧光观察血细胞吞噬状态和流式细胞术检测血细胞吞噬率。
1.3 细胞荧光标记及血细胞吞噬状态观察
血细胞悬液1mL中加异硫氰酸荧光素(Fluoresceine isothiocyanate,FITC)的细胞标记溶液(Life technologies, 美国)5μL,于37℃孵育5min,将血细胞悬液滴在洁净的载玻片上,室温湿盒中沉降45min后,弃去悬液,以无荧光的甘油封片,在荧光显微镜下观察血细胞的吞噬状态。每组样品重复测定3次。
1.4 流式细胞术
血细胞悬液经300目筛绢过滤,用流式细胞仪(Becton Dickinson,法国)测定血细胞的吞噬率。流式细胞仪正散射光(FS)、侧散射光(SS)和荧光强度(FL)分别表明的是血细胞的大小、胞质颗粒度和荧光强度,结果应用WinMDI 2.9软件分析血细胞的吞噬率,以PBS组的荧光强度为血细胞吞噬率的阴性对照。血细胞吞噬率=含荧光微球的血细胞/测量血细胞的总数×100%,本实验重复3次。
1.5 数据分析
流式细胞仪测定的数据用Origin 8.0软件处理并作图,用One-way ANOVA统计分析实验组与对照组间的差异,P<0.05表示差异显著。
2 结果
2.1 细胞荧光标记及血细胞吞噬状态观察
荧光显微镜下,所有血细胞均标记上了FITC,整个血细胞呈现薄薄的绿色荧光,FM呈现出红色荧光。发生吞噬的血细胞,可观察到在绿色荧光的细胞内出现红色荧光颗粒,有的细胞中微球颗粒较多,红色荧光亮度较强,与绿色荧光叠加呈现亮黄色。相同视野下的微分干涉相差显微镜观察,可见血细胞内细胞核界限清晰,细胞质中有的有颗粒,有的无颗粒,吞噬的微球呈现出不透光的颗粒(见图1)。随着处理时间延长,血细胞的吞噬率逐渐增加,随后缓慢下降,直至实验结束。PBS对照组仅观察到标记上绿色荧光的血细胞。

(A:荧光显微镜观察结果;B:相同视野下微分干涉相差显微镜观察结果。箭头指示吞噬荧光微球的血细胞。A: Fluorescence microscopic assay. B: differential interference contrast microscopic assay at the same field of view. The arrows indicate haemocytes phagocytosing fluorescent microparticles.)
图1 养殖水温为15℃下注射脂多糖和荧光微球
混合液18h后扇贝血细胞吞噬状态的荧光观察结果
Fig.1 Flurescence microscope observation of fluorescent microparticles phagocytosed by haemocytes at 15 ℃
2.2 流式细胞术
养殖水温为5℃时,两处理组扇贝血细胞吞噬率均呈现出首先快速上升,至24h达到最高,之后逐渐下降,至实验结束(见图2),其中,LPS和FM混合液组血细胞的吞噬率自12h(3.58% ± 0.33%)开始显著高于FM组(3.12% ± 0.28%)(P<0.05)(见图2A),直至24h到达最高(9.75% ± 0.48%),仍显著高于FM组(8.66% ± 0.26%)(P<0.05)(见图2B),整个实验过程中,注射LPS和FM混合液组在12、18、24、36和42h的血细胞吞噬率均显著高于FM组(P<0.05)。PBS组的阴性对照值一直变化不显著,平均为0.43% ± 0.11%。
养殖水温为10℃时,2处理组扇贝血细胞吞噬率也呈现出首先快速上升,至24h达到最高,之后逐渐下降,至实验结束(见图3),其中,注射LPS和FM混合液组血细胞的吞噬率自6h(5.68% ± 0.33%)显著高于FM组(3.42% ± 0.20%)(P<0.05)(见图3A),至24h
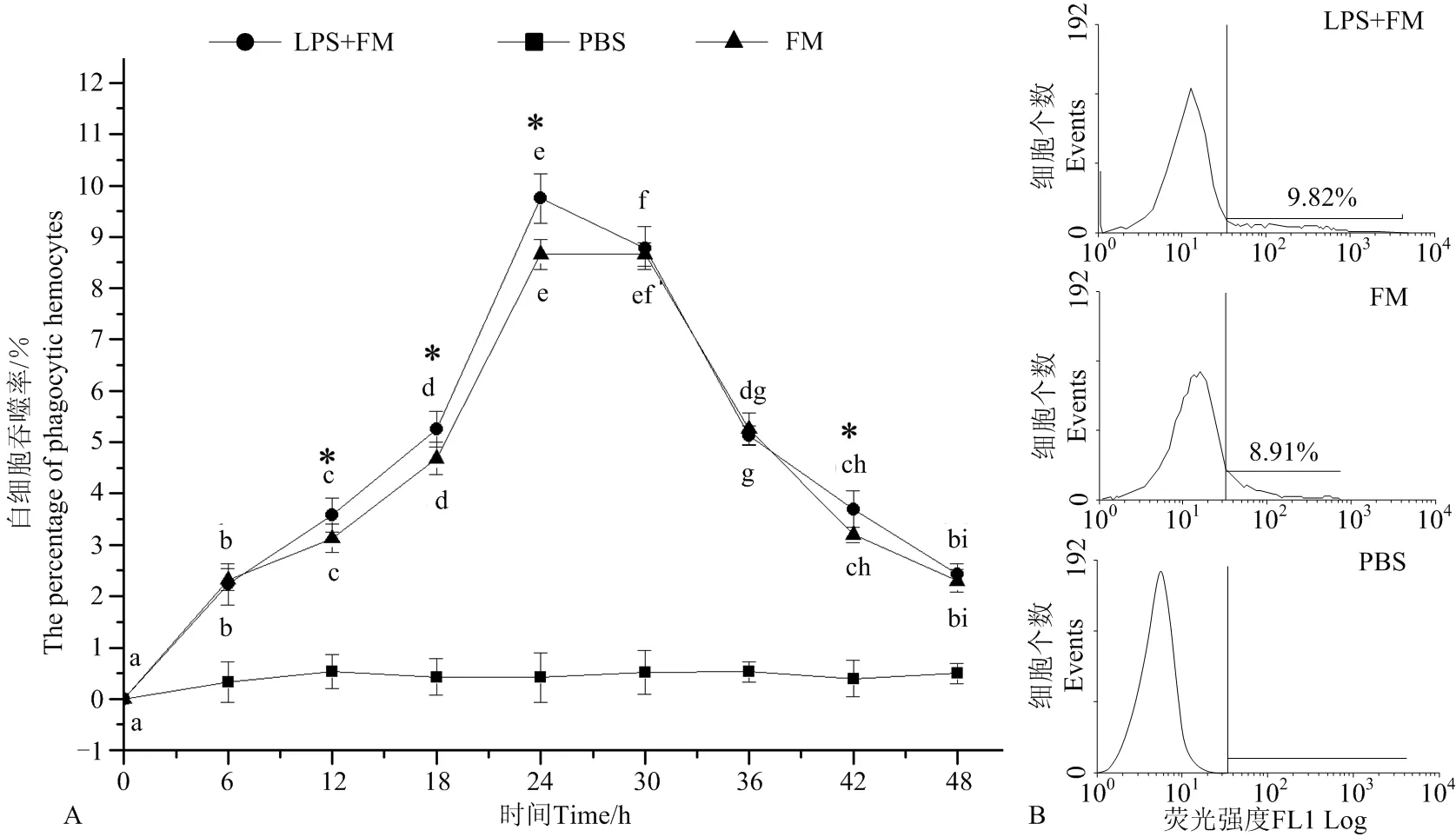
(A:扇贝血细胞吞噬率的变化图。B:注射24h后血细胞吞噬率的流式细胞术检测结果图。小写字母(a, b, c, d, e, f, g, h, i)表示同一处理下不同时间点之间的显著性差异(P<0.05)。“*”表示LPS+FM组与FM组间差异显著(P<0.05)。A. Variation of haemocyte phagocytosis activity; B. Histogram plot of flow cytometry for phagocytosis activity haemocyte at 24 h. Values with different lower-case superscripts (a, b, c, d, e, f, g, h, i) indicate significant differences (P<0.05) among different time point within the same treatment. Asterisks “*” indicate significant difference (P<0.05) between the LPS+FM group and FM group at the same time.)
图2 流式细胞术检测养殖水温为5℃时注射荧光微球(FM)、注射脂多糖和荧光微球混合液(LPS+FM)后扇贝血细胞吞噬率的变化
Fig.2 Variation of haemocyte phagocytosis activity after mixture of Lipopolysaccharide (LPS) and fluorescent microparticles (FM) or FM injection in scallopsChlamysfarreriat 5 ℃ detection by Flow cytometry
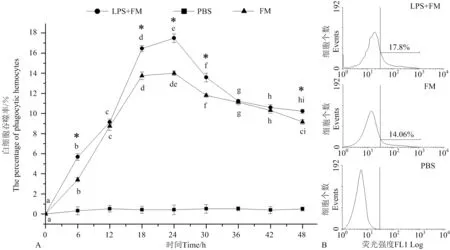
(A:扇贝血细胞吞噬率的变化图;B:注射24h后血细胞吞噬率的流式细胞术检测结果图。小写字母(a, b, c, d, e, f, g, h, i)表示同一处理下不同时间点之间的显著性差异(P<0.05)。“*”表示LPS+FM组与FM组间差异显著(P<0.05)。A. Variation of haemocyte phagocytosis activity; B. Histogram plot of flow cytometry for phagocytosis activity haemocyte at 24 h. Values with different lower-case superscripts (a, b, c, d, e, f, g, h, i) indicate significant differences (P<0.05) among different time point within the same treatment. Asterisks “*” indicate significant difference (P<0.05) between the LPS+FM group and FM group at the same time.)
图3 流式细胞术检测养殖水温为10℃时注射荧光微球(FM)、注射脂多糖和荧光微球混合液(LPS+FM)后扇贝血细胞吞噬率的变化
Fig.3 Variation of haemocyte phagocytosis activity after mixture of Lipopolysaccharide (LPS) and fluorescent microparticles (FM) or FM injection in scallopsChlamysfarreriat 10 ℃ detection by Flow cytometry
达到最高,为(17.49% ± 0.48%),仍显著高于FM组(14.00% ± 0.22%)(P<0.05)(见图3B),整个实验过程中,注射LPS和FM混合液组在 6、18、24、30和48h的血细胞吞噬率均显著高于FM组(P<0.05)。PBS组的阴性对照值一直变化不显著,平均为0.23% ± 0.07%。
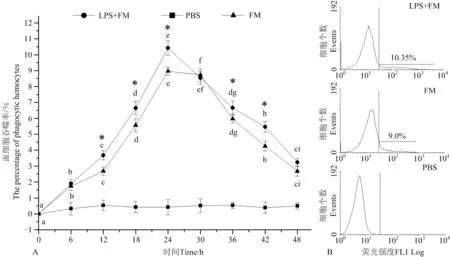
养殖水温为15℃时,两处理组扇贝血细胞吞噬率也呈现出首先快速上升,至18h达到最高,之后逐渐下降,至实验结束(见图4),其中,注射LPS和FM混合液组血细胞的吞噬率自6h(6.54 %± 0.21%)显著高于FM组(4.47% ± 0.29%)(P<0.05)(见图4A),18h达到最高,为23.13%±0.57%,仍显著高于FM组(16.97%±0.55%)(P<0.05)(见图4B),整个实验过程中,注射LPS和FM混合液组血细胞的吞噬率在6~24h均显著高于FM组(P<0.05)。PBS组的阴性对照值一直变化不显著,平均为0.19 %± 0.08%。

(A:扇贝血细胞吞噬率的变化图;B:注射18h后血细胞吞噬率的流式细胞术检测结果图。小写字母(a, b, c, d, e, f, g, h, i)表示同一处理下不同时间点之间的显著性差异(P<0.05)。“*”表示LPS+FM组与FM组间差异显著(P<0.05)。A. Variation of haemocyte phagocytosis activity; B. Histogram plot of flow cytometry for phagocytosis activity haemocyte at 18 h. Values with different lower-case superscripts (a, b, c, d, e, f, g, h, i) indicate significant differences (P<0.05) among different time point within the same treatment. Asterisks “*” indicate significant difference (P<0.05) between the LPS+FM group and FM group at the same time.)
图4 流式细胞术检测养殖水温为15℃时注射荧光微球(FM)、注射脂多糖和荧光微球混合液(LPS+FM)后扇贝血细胞吞噬率的变化
Fig.4 Variation of haemocyte phagocytosis activity after mixture of Lipopolysaccharide (LPS) and fluorescent microparticles (FM)
or FM injection in scallopsChlamysfarreriat 15 ℃ detection by Flow cytometry
养殖水温为20℃时,2处理组扇贝血细胞吞噬率也呈现出首先快速上升,至18h达到最高,之后逐渐下降,至实验结束(见图5),其中,注射LPS和FM混合液组血细胞的吞噬率自6h(12.58% ± 0.26%)显著高于FM组(11.41%±0.34%)(P<0.05)(见图5A),18h达到最高,为34.16%±0.97%,仍显著高于FM组(25.06%±0.97%)(P<0.05)(见图5B),整个实验过程中,注射LPS和FM混合液组血细胞吞噬率在6~48h的均显著高于FM组(P<0.05)。PBS组的阴性对照值一直变化不显著,平均为0.13% ± 0.06%。
养殖水温为25℃时,2处理组扇贝血细胞吞噬率也呈现出首先快速上升,至24h达到最高,之后逐渐下降,至实验结束(见图6),其中,注射LPS和FM混合液组血细胞的吞噬率自18h(6.65% ± 0.42%)显著高于FM组(5.57% ± 0.40%)(P<0.05)(见图6A),至24h达到最高为10.42%±0.45%,仍显著高于FM组(8.97%±0.45%)(P<0.05)(见图6B),整个实验过程中,注射LPS和FM混合液组血细胞吞噬率仅在18、24和42h显著高于FM组(P<0.05)。PBS组的阴性对照值一直变化不显著,平均为0.44% ± 0.11%。
各养殖温度组血细胞吞噬率的结果表明,20℃组血细胞吞噬率显著高于其他温度组,其次是15℃组、10℃组,5和25℃组血细胞吞噬率最低,这两温度组血细胞吞噬率差异不显著(P<0.05),并且15、20℃温度组吞噬率最大值出现时间为18h,其他组均为24h。此外,各温度组中,LPS和FM混合液组血细胞最大吞噬率均显著高于FM组(P<0.05)(见表1)。
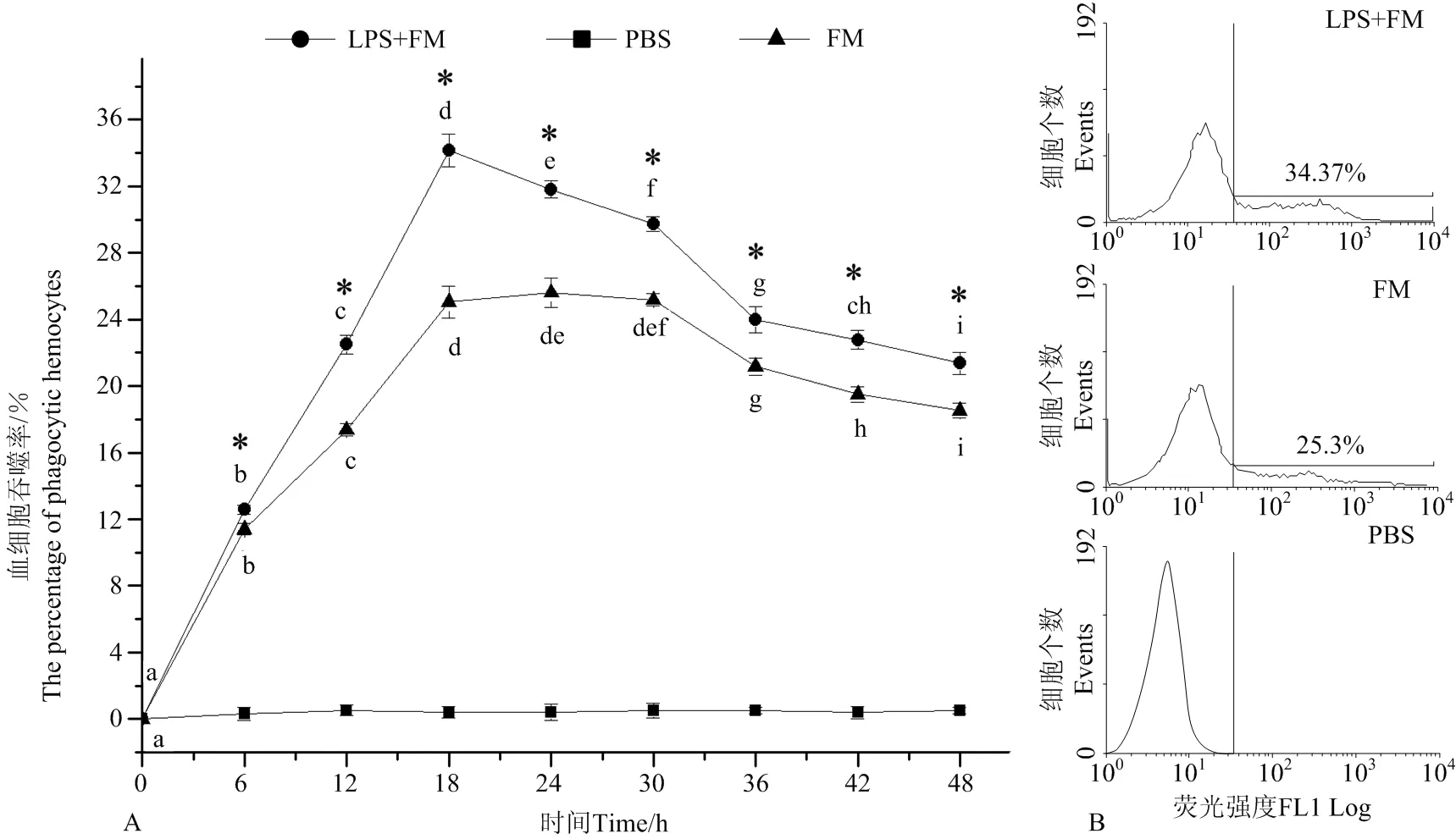
(A:扇贝血细胞吞噬率的变化图;B:注射18h后血细胞吞噬率的流式细胞术检测结果图。小写字母(a, b, c, d, e, f, g, h, i)表示同一处理下不同时间点之间的显著性差异(P<0.05)。“*”表示LPS+FM组与FM组间差异显著(P<0.05)。A. Variation of haemocyte phagocytosis activity; B. Histogram plot of flow cytometry for phagocytosis activity haemocyte at 18 h. Values with different lower-case superscripts (a, b, c, d, e, f, g, h, i) indicate significant differences (P<0.05) among different time point within the same treatment. Asterisks “*” indicate significant difference (P<0.05) between the LPS+FM group and FM group at the same time.)
图5 流式细胞术检测养殖水温为20℃时注射荧光微球(FM)、注射脂多糖和荧光微球混合液(LPS+FM)后扇贝血细胞吞噬率的变化
Fig.5 Variation of haemocyte phagocytosis activity after mixture of Lipopolysaccharide (LPS) and fluorescent microparticles (FM) or FM injection in scallopsChlamysfarreriat 20 ℃ detection by Flow cytometry
(A:扇贝血细胞吞噬率的变化图;B:注射24h后血细胞吞噬率的流式细胞术检测结果图。小写字母(a, b, c, d, e, f, g, h, i)表示同一处理下不同时间点之间的显著性差异(P<0.05)。“*”表示LPS+FM组与FM组间差异显著(P<0.05)。A. Variation of haemocyte phagocytosis activity; B. Histogram plot of flow cytometry for phagocytosis activity haemocyte at 18 h. Values with different lower-case superscripts (a, b, c, d, e, f, g, h, i) indicate significant differences (P<0.05) among different time point within the same treatment. Asterisks “*” indicate significant difference (P<0.05) between the LPS+FM group and FM group at the same time.)

图6 流式细胞术检测养殖水温为25℃时注射荧光微球(FM)、注射脂多糖和荧光微球混合液(LPS+FM)后扇贝血细胞吞噬率的变化Fig.6 Variation of haemocyte phagocytosis activity after mixture of Lipopolysaccharide (LPS) and fluorescent microparticles(FM) or FM injection in scallops Chlamys farreri at 25 ℃ detection by Flow cytometry
注:AD:激活持续时间;TPE:峰值出现时间;AE:激活幅度= 峰值-对照平均值;FM:荧光微球;LPS:脂多糖。表中大写字母(A,B,C,D,E)表示同一处理不同温度间的差异显著性(P<0.05);小写字母(a,b)表示同一温度峰值间的差异显著性(P<0.05)。
Note:AD: Activation Duration; TPE: Time of Peak Emergence; AE:Activation Extent= Peak value-control value;FM:Flurenscent Microparticle; LPS:Lipopolysaccharide.Values with different capitalised superscripts (A, B, C, D, E) indicate significant differences (P<0.05) between the two temperatures within the same treatment; Values with different lower-case superscripts (a, b) indicate significant differences (P<0.05) among the two treatments within the same temperature.
3 讨论
论文在观察血细胞吞噬时应用含FITC的细胞标记液标记血细胞,FITC呈绿色荧光,藻红蛋白荧光素呈红色荧光,2种荧光染料的最大吸收波长均在495nm左右,在荧光显微镜下能够同时观察到绿色荧光和红色荧光,再加上同一视野下微分相差的观察,能够清楚的观察到血细胞的形态以及血细胞对荧光微球的吞噬状况。另外,由于血细胞本身有自发荧光现象,在吞噬率较低的时候有可能血细胞自发荧光值会高于吞噬的荧光微球的荧光值,因此,以PBS注射组为对照,将其设为吞噬率的阴性值,能够保证血细胞吞噬荧光微球的吞噬率更加准确。吞噬作用是贝类清除侵入机体的外源异物主要方式,包括趋化、接触、内吞和消化4个步骤。微生物入侵后, 血细胞通过与体液因子的共同作用移动到微生物入侵处, 之后血细胞通过细胞质的变形包裹入侵微生物, 将其形成吞噬体随之进入细胞内部。细胞完成对入侵物的内吞, 通过2种方式清除异物, 一是溶解, 通过溶酶体中的溶酶体酶等降解并消化,另一种方式是利用吞噬作用中产生的大量活性氧, 杀伤入侵的微生物[25]。本研究中注射的荧光微球是乳胶颗粒,血细胞在识别及吞噬后不能通过酶类水解或者活性氧自由基的方式消化微球,其可能的途径可能有2种,一种血细胞在识别微球并进行包裹内吞之后,细胞内的酶类对微球无法分解和消化,随着微球越来越多血细胞吞噬率的增加,微球在血细胞内的不断堆积,血细胞未能及时消化影响了血细胞酶源酶类的正常功能,导致血细胞溶解[3],所以血细胞吞噬率在某些检测阶段有些下降也可能是有部分血细胞数量减少的原因;另一种少量的微球被识别吞噬后,血细胞无法识别和消化,血细胞内某些因子的参与排异,最终排出细胞外,详细的机制还需深入开展。从荧光显微镜观察的结果发现,吞噬荧光微球的血细胞有颗粒细胞也有透明细胞,有的研究认为透明细胞是吞噬能力很强的细胞,这类细胞能够活化酚氧化酶原系统组分并激活的吞噬能力[4]。还有的认为颗粒细胞通过释放颗粒中的溶酶体酶参与吞噬并消除异物[2],也是吞噬作用的积极参与细胞。本实验的研究结果发现二种类型的血细胞均有不同程度的吞噬,也可能是因为二者通过不同途径进行吞噬的结果。
本结果发现,注射LPS后,扇贝血细胞吞噬活力显著增强。LPS是位于革兰氏阴性菌细胞壁外膜的一种由类脂和多糖链组成的物质,具有与相应细胞结合以及免疫活性。在免疫活性方面,LPS能够通过感染后诱导巨噬细胞激活、产生大量细胞因子并激活细胞因子的活性[26]。添加LPS可促进血细胞变形并增强活动能力, 同时增强吞噬活力或溶菌酶的活力[27],以及增强巨噬细胞吞噬功能和活性氧的产生[28-29]。脂多糖本身具有很强的抗原性和毒性,有些研究表明,注射脂多糖能够引起血细胞大量减少[19-20],可能是因为较高浓度的脂多糖引起的毒性作用导致的,因此适当的浓度是研究免疫调节作用的关键。本研究的预实验发现,当LPS浓度≥3.0 mg/mL 时,各温度组的部分扇贝开始出现一些抑制生长等症状,并有的出现死亡;当其浓度≤2.0mg/mL 时,各温度组的扇贝均无异常反应。因此,选择1.0 mg/mL这个浓度被选作为合适浓度做为增强血细胞吞噬率的研究。关于高浓度的LPS反而产生免疫抑制的原因可能是浓度过高容易短时间内过度刺激免疫系统,导致机体免疫细胞及因子无防御反应和能力[30-31]。因此本文虽得出LPS提高了扇贝血细胞的吞噬率,并且激活的时间多在12~42h之间,建议在生产实践添加多糖时应该注意选择适当的剂量和投喂时段。
本研究结果表明,水温影响扇贝血细胞的吞噬率显著,15或20℃养殖温度处理组血细胞吞噬活性的激活程度、激活持续时间、吞噬率最大值出现时间均高于、长于并早于其他温度养殖组。这个结果的原因可能是与相对较高或较低的养殖水温相比,在其条件下,血细胞的运动能力、细胞膜的通透性等都有不同程度的下降,从而使其与相应结合蛋白结合的能力下降,引起与LPS的结合能力并激活细胞免疫活力的能力随之下降。据报道LPS的激活机理主要与存在于血细胞膜上的LPS结合蛋白有关[32-33]。LPS结合蛋白是一种模式识别蛋白,可以特异性识别LPS。一旦识别LPS后,结合的复合物就会激活血细胞的免疫防御系统,进而引发吞噬、包囊、凝集和消化降解等,最终使血细胞内产生和释放大量免疫活性物质增强细胞免疫功能[34]。这一解释在2种螯虾得到了验证:在22℃时,螯虾中的结合蛋白-mRNA表达量要显著低于12和16℃[35]。本研究结果说明较高的温度能显著影响栉孔扇贝的细胞的吞噬率,可能增加了被病原感染的机会,这也可能是栉孔扇贝大规模死亡病在夏季水温较高时期发病的原因。
[1] Roche P. Defense mechanisms and disease prevention in farmed marine invertebrates [J]. Aquaculture, 1999, 172(1-2): 125-145.
[2] Hine P M. The inter-relationships of bivalve haemocytes [J]. Fish and Shellfish Immunology, 1999, 9(5): 367-385.
[3] Bayne C J. Phagocytosis and non-self recognition in invertebrates. Phagocytosis appears to be an ancient line of defence [J]. Bioscience, 1990, 40: 723-731.
[4] Aladaileh S, Nair S V, Birch D, et al. Sydney rock oyster (Saccostreaglomerata) hemocytes: morphology and function [J]. Journal of Invertebrate Pathology, 2007, 96(1): 48-63.
[5] Chu F-LE. Defence mechanisms in marine bivalves [M].//Fingerman M, Nagabhushanam R. Recent Advances in Marine Biotechnology. Immunobiology and Pathology vol. 5. Plymouth, UK:Science Publishers, Enfield, NH, 2000: 1-42.
[6] 许友卿, 吴卫君, 蒋伟明, 等. 温度对贝类免疫系统的影响及其机理研究进展 [J]. 水产科学, 2012, 31(3): 176-180.
[7] Hegaret H, Wikfors G H, Soundant P. Flow cytometric analysis of haemocytes from eastern oysters,Crassostreavirginica, subjected to a sudden temperature elevation- II. Haemocyte functions: aggregation, viability, phagocytosis, and respiratory burst[J]. J Exp Mar Biol Ecol, 2003: 293: 249-265.
[8] Gagnaire B, Frouin H, Moreau K, et al. Effects of temperature and salinity on haemocyte activities of the pacific oyster,Crassostreagigas(Thunberg) [J]. Fish and Shellfish Immunology, 2006, 20(4): 536-547.
[9] Boyd J N, Burnett L E. Reactive oxygen intermediate production by oyster hemocytes exposed to hypoxia [J]. The Journal of Experimental Biology, 1999, 202: 3135-3143.
[10] Matozzo V, Monari M, Foschi J, et al. Exposure to anoxia of the clamChameleagallina. I: Effects on immune responses [J]. Journal of Experimental Marine Biology and Ecology, 2005, 325(2): 163-174.
[11] Liu J, Pan L Q, Zhang L, et al. Immune responses, ROS generation and the haemocyte damage of scallopChlamysfarreriexposed to Aroclor 1254 [J]. Fish and Shellfish Immunology, 2009, 26(3): 422-428.
[12] Ciacci C, Citterio B, Betti M, et al. Functional differential immune responses ofMytilusgalloprovincialisto bacterial challenge [J]. Comparative Biochemistry and Physiology, 2009, 153(4): 365-371.
[13] Xing J, Lin T, Zhan W. Variations of enzyme activities in the haemocytes of scallopChlamysfarreriafter infection with the acute virus necrobiotic virus (AVNV) [J]. Fish and Shellfish Immunology, 2008, 25(6): 847-852.
[14] Huan P, Wang H, Liu B. Comparative proteomic analysis of challenged Zhikong scallop (Chlamysfarreri): a new insight into the anti-Vibrio immune response of marine bivalves [J]. Fish and Shellfish Immunology, 2011, 31(6): 1186-1192.
[15] Jie Xiaoa, Susan E Fordb, Hongsheng Yang, et al. Studies on mass summer mortality of cultured zhikong scallops (ChlamysfarreriJones et Preston) in China [J]. Aquaculture, 2005, 250 (3-4): 602-615.
[16] Yu J H, Song J H, Choi M C, et al. Effects of water temperature change on immune function in surf clams,Mactraveneriformis(Bivalvia: Mactridae) [J]. Journal of Invertebrate Pathology, 2009, 102(1): 30-35.
[17] Cheng W, Hsiao I S, Hsu C H, et al. Change in water temperature on the immune response of Taiwan abaloneHaliotisdiversicolorsupertextaand its susceptibility toVibrioparahaemolyticus[J]. Fish and Shellfish Immunology, 2004, 17(3): 235-243.
[18] Yang J L, Qiu L M, Wang L L, et al. CfLGBP a pattern recognition receptor inChlamysfarreriinvolved in the immune response against various bacteria [J]. Fish & Shellfish Immunology, 2010, 29: 825-831.
[19] Rungrassamee W, Maibunkaew S, Karoonuthaisiri N, et al. Application of bacterial lipopolysaccharide to improve survival of the black tiger shrimp afterVibrioharveyiexposure [J]. Developmental and Comparative Immunology, 2013, 41(2): 257-262.
[20] Amparyup P, Sutthangkul J, Charoensapsri W, et al. Pattern recognition protein binds to lipopolysaccharide and β-1, 3-glucan and activates shrimp prophenoloxidase system [J]. The Journal of Biological Chemistry, 2012, 287(13): 10060-10069.
[21] Felix S. Pro-PO Based Immunomodulatory Effect of Glucan and LPS on Tiger Shrimp,Penaeusmonodon(Fabricius) [J]. Diseases in Asian Aquaculture V, 2005(3): 477-482.
[22] Takeshi Kadowaki, Yasumasa Yasui, Osamu Nishimiya, et al. Orally administered LPS enhances head kidney macrophage activation with down-regulation of IL-6 in common carp (Cyprinuscarpio) [J]. Fish & Shellfish Immunology, 2013, 34(6): 1569-1575.
[23] Carballal M J, López C, Azevedo C, et al. Invitrostudy of phagocytic ability ofMytilusgalloprovincialisLmk haemocytes [J]. Fish Shellfish Immunol, 1997, 7: 403-416.
[24] 于淼, 邹明强, 何昭阳. 高分子荧光微球在生物医学领域中的某些应用 [J]. 分析测试学报, 2006, 25(3): 33-35.
[25] 孙敬锋, 吴信忠. 贝类血细胞及其免疫功能进展 [J]. 水生生物学报, 2006, 30(5): 601-606.
[26] 张洪渊, 刘克武, 姜云, 等. 圆背角无齿蚌碱性硫酸酶的功能基团研究 [J]. 水生生物学报, 1997, 21(4): 348-352.
[27] 孙虎山, 李光友. 脂多糖对栉孔扇贝血清和血细胞中7种酶活力的影响 [J]. 海洋科学, 1999(4): 54-57.
[28] 罗海波, 朱平, 李兰娟. 细菌毒素与临床 [M]. 北京: 人民卫生出版社, 1999: 1-9.
[29] 叶剑敏, 简纪常, 吴后波, 等. 溶藻弧菌脂多糖的化学成分分析及其对石斑鱼的毒性 [J]. 水生生物学报, 2004, 28(5): 574-576.
[30] Ai Q H, Mai K S, Zhang L, et al. Effects of dietary β-1, 3-glucan on innate immune response of large yellow croaker,Pseudosciaenacrocea[J]. Fish Shellfish Immunol, 2007, 22: 394-402.
[31] Chandra Kanta Misra, Basanta Kumar Das, Subhas Chandra Mukherjee, et al. Effect of long term administration of dietary β-glucan on immunity, growth and survival ofLabeorohitafingerlings [J]. Aquaculture, 2006, 255(1-4): 82-94.
[32] 赵虎, 周庭银, 孔宪涛. LPS结合蛋白的结构和功能 [J]. 细胞与分子免疫学杂志, 2000, 16(1): 91-92.
[33] Liu F S, Li F H, Dong B, et al. Molecular cloning and characterization of a pattern recognition protein, lipopolysaccharide and β-1, 3-glucan binding protein(LGBP) from Chinese shrimpFenneropenaeuschinensis[J]. Mol Biol Rep, 2009, 36: 471-477.
[34] Jiravanichpaisal P, Lee B L, Söderhäll K. Cell-mediated immunity in arthropods: Hematopoiesis, coagulation, melanization and opsonization [J]. Immunobiology, 2006, 211: 213-236.
[35] Jiravanichpaisal P, Söderhäll K, Söderhäll I. Effect of water temperature on the immune response and infectivity pattern of white spot syndrome virus (WSSV) in freshwater crayfish [J]. Fish Shellfish Immunol, 2004, 7: 265-275.
责任编辑 朱宝象
Effect of Water Temperature on Phagocytic Activitiy of the Haemocytes of Scallop (Chlamysfarreri) After Stimulated by Lipopolysaccharide
XU Yi-Xuan, ZHAN Wen-Bin, XING Jing
(The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China)
Phagocytosis of haemocytes is the primary innate immune defense of scallop (Chlamysfarreri). In this study, the scallop was accustomed at 5,10, 15, 20 and 25 ℃, respectively, then injected with either phycoerythrin labeled fluorescent microparticles (FM), lipopolysaccharide (LPS) plus FM or PBS. After that, haemocytes were collected at 0, 6, 12, 18, 24, 30, 36, 42 and 48 hours post injection, respectively, and their phagocytic activity was measured with fluorescence microscope and flow cytometry (FCM). The results showed that haemocytes engulfed the FM at 6h, and the engulfing rate rose in the first 18-24 hours, reaching the maximum and then gradually declined. At 5℃, the maximum of haemocyte engulfing rate in the two treatment were 8.66% ± 0.26% and 9.75% ± 0.48%, respective; at 10 ℃ they were 14.00% ± 0.22% and 17.49% ± 0.43%; at 15 ℃, they were 16.97% ± 0.55% and 23.13%±0.57%; at 20 ℃ were 25.62% ± 0.88% and 34.16% ± 0.97%; at 25 ℃, they were 8.97 % ± 0.25% and 10.42% ± 0.45%. Engulfing rate in LPS-treated group was significantly higher than that in FM group. Moreover, at 20 ℃, engulfing rate was significantly higher than that of other groups, followed by 15 and 10 ℃ groups, and finally 5 and 25 ℃ groups, No significant difference between groups at 15 and 20 ℃. The results suggested that water temperature affected the engulfing rate significantly and LPS significantly enhanced the phagocytic activity of scallop haemocytes.
Chlamysfarreri; haemocyte; phagocytic activity; temperature; lipopolysaccharide
国家重点基础研究发展计划项目(2012CB114405);国家科技支撑计划项目(2012BAD17B02);新世纪优秀人才支持计划项目(NCET-10-0763);教育部留学回国人员科研启动基金项目(教外司留[2011]1139)资助
2014-02-20;
2014-05-05
徐翊轩(1977-),男,硕士生,主要从事贝类免疫学研究。
❋❋ 通讯作者: E-mail:xingjing@ouc.edu.cn
Q959.215
A
1672-5174(2015)06-031-08
10.16441/j.cnki.hdxb.20140039
