布拉酵母菌对大鼠高脂血症的调节作用
2015-03-21崔立红王晓辉闫志辉弓三东
李 超,崔立红,王晓辉,闫志辉,贺 星,弓三东,罗 哲,郑 岩
海军总医院 消化内科,北京 100048
布拉酵母菌对大鼠高脂血症的调节作用
李 超,崔立红,王晓辉,闫志辉,贺 星,弓三东,罗 哲,郑 岩
海军总医院 消化内科,北京 100048
目的探讨布拉酵母菌对大鼠高脂血症的防治作用。方法将40只SPF级SD大鼠随机分为4组,每组10只。A组饲喂普通饲料;B组饲喂高脂饲料;C组饲喂高脂饲料同时于第70天加用布拉酵母菌散剂;D组饲喂高脂饲料同时加布拉酵母菌散剂。实验第1天、第70天、第112天采集4组大鼠血液检测大鼠血脂四项。结果第70天时,B组、C组大鼠血清总胆固醇(total cholesterol,TC)(mmol/L)(B组:2.39±0.21 vs 1.93±0.15,C组:2.45±0.29 vs 1.94±0.24)、三酰甘油(triacylglycerol,TG)(mmol/L)(B组:1.04±0.21 vs 0.74±0.13,C组:1.02±0.18 vs 0.76±0.15)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)(mmol/L)(B组:1.04±0.12 vs 0.46±0.12,C组:1.06±0.16 vs 0.46±0.07)较初始升高(P<0.05)。D组大鼠血清TC较初始无变化(2.05±0.14 vs 1.98±0.21,P>0.05),TG降低(0.53±0.12 vs 0.77±0.22,P<0.05),LDL-C虽有升高(0.74±0.15 vs 0.48±0.09)但较B组(0.74±0.15 vs 1.04±0.12)、C组(0.74±0.15 vs 1.06±0.16)低(P<0.05)。第112天时,C组大鼠血清TC(2.13±0.19 vs 2.45±0.29)、TG(0.46±0.07 vs 1.02±0.18)、LDL-C(0.56±0.16 vs 0.81±0.11)较第70天时降低(P<0.05),且低于B组(2.13±0.19 vs 2.60±0.18,0.46±0.07 vs 1.06±0.22,0.56±0.16 vs 0.72±0.09,P<0.01)。结论高脂饲料饲喂会造成大鼠血脂明显升高,布拉酵母菌可预防高脂血症的发生。
高脂血症;益生菌;肠道菌群
高脂血症作为一种代谢疾病,与血栓形成、动脉硬化的发生有高度的相关性,是危害健康的重要疾病[1-3]。有流行病学调查显示,我国上海及常州地区部分人群高脂血症的患病率已超过25%[4-5]。如何预防高脂血症的发生,以及如何治疗高脂血症已经成为医学领域的热点问题。近年来,越来越多的研究表明,肠道菌群在脂代谢中起着重要作用,肠道菌群可以通过多种机制对血脂进行调节[6-7]。本研究旨在通过观察布拉酵母菌对大鼠血脂变化的影响,进一步探讨益生菌在高脂血症中的防治作用。
资料和方法
1 实验动物 SPF级SD大鼠40只,均为5周龄雄性,体质量(180±10) g,购于北京维通利华实验动物技术有限公司。常规饲养条件:温度20 ~22℃,湿度60% ~ 70%,光照时间12 h/d。
2 动物饲料及药物 均购自北京科澳协力饲料有限公司。普通饲料:面粉20%、麸皮25%、玉米20%、米粉10%、豆料20%、鱼粉2%、骨粉2%、食盐0.9%、维生素0.1%。高脂饲料:普通饲料78.9%+猪油10%+蛋黄粉5%+胆固醇1%+猪胆盐0.1%+全脂奶粉5%。益生菌选择布拉酵母菌散剂(法国百科达制药厂生产,0.25 g/袋)。
3 动物分组及喂养 将40只大鼠随机分为4组(采用随机数字法),每组10只。A组给予普通饲料饲喂;B组给予高脂饲料饲喂;C组给予高脂饲料饲喂,并于饲喂第70天加用布拉酵母菌散剂至第112天实验结束;D组给予高脂饲料饲喂,并于饲喂初始时加用布拉酵母菌散剂至第112天实验结束。实验开始第1天、第70天、第112天采集4组大鼠血液用于检测大鼠血脂。采用灌胃给药,剂量为0.25/16 g(相当于给予布拉酵母菌数量约3.125×108CFU),每日给药2次。配置方法为0.25/16 g溶于1 ml纯净水中。不给予药物饲喂的动物,给予同等剂量的纯净水灌胃,每日2次。限定大鼠每日进食量为1/10×体质量(kg),不限饮水。
4 血液采集方法 采用眼丛静脉采血法,采血前禁食12 h,每次采血约0.5 ml,37℃恒温水浴箱中20 min后,高速离心机离心10 min,将血清放置于离心管中并送本院检验科检验。
5 观察指标 大鼠血脂四项:血清总胆固醇(total cholesterol,TC),血清三酰甘油(triacylglycerol,TG),血清高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C),血清低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)。
6 统计学分析 数据处理选用SPSS19.0统计学软件。计量资料采用表示。组间比较采用单因素方差分析,组内比较采用配对t检验,多组间两两比较采用LSD法,由SPSS软件生成随机数字,P<0.05为差异有统计学意义。
结 果
1 各组大鼠血清TC指标比较 4组大鼠初始TC差异无统计学意义(F=0.154,P=0.926)。第70天时,
B组、C组较第1天时增高(P<0.05),A组、D组无改变(P>0.05);第112天时,A组、D组较第70天时无改变(P>0.05),而B组升高(P<0.05),C组降低(P<0.05)。第70天(F=13.194, P<0.05)及第112天(F=20.761,P<0.05),4组值组间差异显著;两两比较可得第70天时,B组、C组较A组、D组高(P<0.05),A组、D组间无统计学差异(P>0.05);第112天时,C组较B组低(P<0.05),A组、D组间无统计学差异(P>0.05)。见表1。
2 各组大鼠血清TG指标比较 各组大鼠初始TG指标差异无统计学意义(F=0.098,P=0.961)。第70天时,B组、C组较第1天时增高(P<0.05),D组降低(P<0.05),A组无改变(P>0.05);第112天时,A组、B组、D组较第70天时无改变(P>0.05),C组降低(P<0.05)。第70天(F=20.237,P<0.05)及第112天(F=40.726,P<0.05)时,4组值组间差异显著;两两比较可得第70天时,B组、C组高于A组(P<0.05),D组低于A组(P<0.05);第112天,C组低于B组(P<0.05),且低于A组(P<0.05),与D组间无统计学差异(P>0.05)。见表1。
3 各组大鼠HDL-C情况指标比较 4组大鼠初始时HDL-C指标差异无统计学意义(F=0.442,P=0.724)。第70天,B组、C组、D组较第1天降低(P<0.05),A组无改变(P>0.05);第112天,B组(P<0.05)、C组、D组(P<0.05)较第70天降低,A组无改变(P>0.05)。第70天(F=26.883,P<0.05)及第112天(F=99.356,P<0.05)时,4组值组间差异显著;两两比较可得第70天时,B组、C组、D组间无统计学差异(P>0.05),均较A组低(P<0.05);第112天时,D组低于A组、B组、C组(P<0.05),且C组低于B组(P<0.05)。见表1。
4 各组大鼠LDL-C指标比较 4组大鼠初始LDL-C指标差异无统计学意义(F=0.128,P=0.943)。第70天,B组、C组、D组较第1天时升高(P<0.05),A组较前无改变(P>0.05);第112天,A组、B组较第70天时无改变(P>0.05),C组、D组降低(P<0.05)。第70天(F=45.570,P<0.05)及第112天(F=66.223,P<0.05)时,4组值组间差异显著;两两比较可得第70天时,B组、C组较A组增高(P<0.05),D组也高于A组,但低于B组、C组(P<0.05);第112天时,C组低于B组,但高于D组(P<0.05),D组与A组无统计学差异(P>0.05)。见表1。
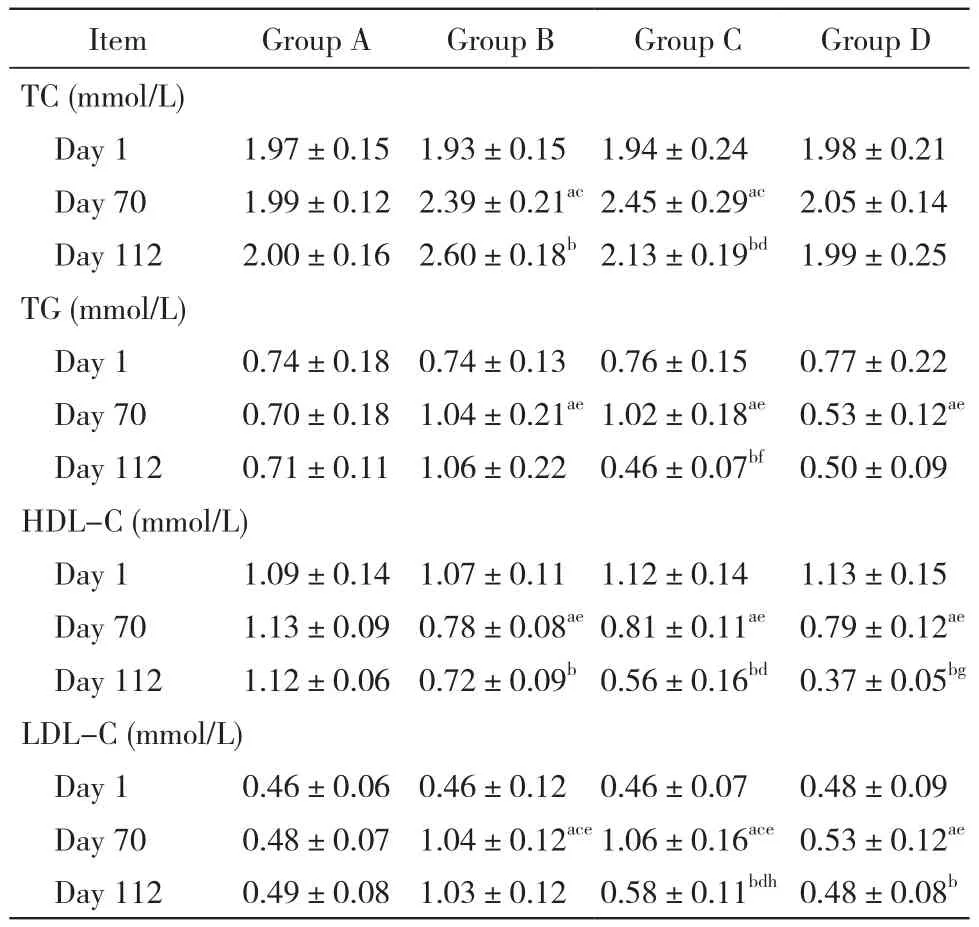
表1 各组大鼠血脂指标比较Tab. 1 Comparison of serum lipid level in four groups
讨 论
高脂血症是指由于脂肪代谢或运转异常,使血中一种或几种脂质高于正常范围。高脂血症的致病原因众多,高脂饮食、肥胖、吸烟、饮酒、遗传、运动量缺乏、激素和药物应用都是高脂血症的致病因素[8-10]。而高脂饮食对高脂血症的形成有着极为重要的影响[11]。
本研究发现,大鼠经过70 d的饲喂,饲喂高脂饲料的B组、C组大鼠TC、TG、LDL-C较初始时升高,饲喂普通饲料的A组血脂四项无显著变化。有报道显示,高脂饲料饲喂大鼠建立高脂模型时,大鼠可在4 ~ 6周形成高脂血症,血清HDL-C变化并不明显。因此本研究延长了建立高脂血症造模的时间。第70天时,B组、C组大鼠HDL-C较前有所降低。但随着时间的延长,第112天再次检测大鼠血脂时,发现B组大鼠的TG、LDL-C较第70天时无改变,而TC却进一步升高。因此,高脂饲料饲喂下可以造成大鼠血清TC、TG、LDL-C的升高,并会造成HDL-C的降低,且随高脂饲料饲喂时间的延长,TC有进一步升高的趋势,提示高脂饲料可导致大鼠高脂血症的形成。
近年来研究发现,肠道菌群与血脂间有千丝万缕的联系。高脂血症患者中的肠道优势菌群发生了明显的变化,血清脂质水平与肠道优势菌群变化具有显著相关性[12]。肠道菌群中的乳酸杆菌、双歧杆菌等菌群与胆固醇的代谢有直接关系,对降低血脂有一定作用[13]。相反,某些肠道菌群的存在则能通过提高宿主从食物中摄取能量的效率或引起低水平慢性炎症反应,导致高脂血症的发生[14]。研究表明,普通小鼠比肠道无菌小鼠脂肪量高42%,而将普通小鼠盲肠的菌群移植到无菌小鼠肠道内,会致无菌小鼠脂肪总量增加57%,提示肠道菌群可以提高小鼠从饮食中获取热量的效率[15]。
本研究选择了布拉酵母菌作为干预药物。该种益生菌应用于临床较早,可维持肠道菌群的平衡及肠道内环境的稳定,并可通过调节特定免疫应答等来保护肠道黏膜屏障[16]。布拉酵母菌在体外可以通过将胆固醇转入菌体内而降低周边胆固醇含量。但关于布拉酵母菌在动物体内有无降低血脂作用的研究较少。本研究发现,第70天时,在布拉酵母菌的干预下高脂饲料的D组TC较初始时并无升高,而TG有所降低,LDL-C虽有升高但较B组低,但HDL-C有所降低且与B组无统计学差异。第112天时,D组TC、TG较第70天均无变化,LDL-C则进一步降低且与饲喂高脂饲料前水平无统计学差异,但HDL-C水平进一步降低。以上研究显示,布拉酵母菌可有效干预大鼠高脂血症发生,尤其对TC、TG的升高有显著的抑制作用,而且长时间应用可有效抑制LDL-C的升高,但对高脂饮食诱导下HDL-C的降低无明显改善。C组大鼠在第70天时与B组大鼠TC、TG、LDL-C水平无统计学差异,但高于A组,加用布拉酵母菌干预6周后,C组大鼠TC、TG、LDL-C均较第70天时降低,且低于B组。以上研究则提示布拉酵母菌对大鼠高脂血症有一定的治疗作用,可有效降低TC、TG、LDL-C水平,但对HDL-C的升高无明显作用。
肠道菌群在血脂中的调节作用机制复杂,加深对肠道菌群在脂代谢调节中作用的研究对促进高脂血症的防治有着重要而积极的作用。
1 Cannon CP. Mixed dyslipidemia, metabolic syndrome, diabetes mellitus, and cardiovascular disease: clinical implications[J]. Am J Cardiol, 2008, 102(12A): 5L-9L.
2 Wang SH, Sun ZL, Ruan XZ, et al. Dyslipidaemia among diabetic patients with ischemic stroke in a Chinese hospital[J]. Chin Med J,2009, 122(21): 2567-2572.
3 Koren O, Spor A, Felin J, et al. Human oral, gut, and plaque microbiota in patients with atherosclerosis[J]. Proc Natl Acad Sci U S A, 2011, 108(Suppl 1): 4592-4598.
4 Wu JY, Duan XY, Li L, et al. Dyslipidemia in Shanghai, China[J]. Prev Med, 2010, 51(5): 412-415.
5 刘思浚,陆凤,胡志斌,等.常州市武进区老年人高脂血症流行病学调查[J].中华疾病控制杂志,2013,17(1):13-16.
6 Tang ML. Probiotics and prebiotics: immunological and clinical effects in allergic disease[J]. Nestle Nutr Workshop Ser Pediatr Program, 2009, 64: 219-235.
7 Denipote FG, Trindade EB, Burini RC. Probiotics and prebiotics in primary care for colon cancer[J]. Arq Gastroenterol, 2010, 47(1):93-98.
8 Su M, Fu C, Li S, et al. Prevalence of hyperlipidemia and possible risk factors in rural Chinese adults: cohort study of health population in Yuhuan rural[J]. Wei Sheng Yan Jiu, 2013, 42(5): 724-729.
9 Davis J, Juarez D, Hodges K. Relationship of ethnicity and body mass index with the development of hypertension and hyperlipidemia[J]. Ethn Dis, 2013, 23(1): 65-70.
10 Wu N, Sarna LK, Hwang SY, et al. Activation of 3-hydroxy-3-methylglutaryl coenzyme A (HMG-CoA) reductase during high fat diet feeding[J]. Biochim Biophys Acta, 2013, 1832(10):1560-1568.
11 曹宏芳,张家超,王芳,等.高脂饮食对雄性SD大鼠肠道菌群的影响[J].中国微生态学杂志,2012,24(2):102-108.
12 熊静芳,傅国胜.高脂血症患者肠道优势菌群与血清脂质水平相关性研究[J].中国微生态学杂志,2013,25(11):1282-1285.
13 易园骊.脂代谢与肠道菌群关系的研究进展[J].医学综述,2013,19(6):991-994.
14 张翼.膳食诱导肥胖大鼠的肠道菌群结构研究[D].上海:上海交通大学,2009.
15 Bäckhed F, Ding H, Wang T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proc Natl Acad Sci U S A, 2004, 101(44): 15718-15723.
16 Collignon A, Sandré C, Barc MC. Saccharomyces boulardii modulates dendritic cell properties and intestinal microbiota disruption after antibiotic treatment[J]. Gastroenterol Clin Biol, 2010, 34(Suppl 1): S71-S78.
Prevention and treatment effect of Saccharomyces boulardii on hyperlipidemia
LI Chao, CUI Lihong, WANG Xiaohui, YAN Zhihui, HE Xing, GONG Sandong, LUO Zhe, ZHENG Yan
Department of Gastroenterology, Navy General Hospital, Beijing 100048, China
CUI Lihong. Email: luckycui861@sina.com
ObjectiveTo explore the prevention and treatment effect of Saccharomyces boulardii on hyperlipidemia.MethodsForty SD rats of SPF level were randomly divided into four groups (10 rats in each group). Group A was given normal diet. Group B was given high fat diet. Group C was given Saccharomyces boulardii powder after 70 days besides high fat diet. Group D was given Saccharomyces boulardii powder from the beginning besides high fat diet. The blood of rats in 4 groups were collected for testing TC, TG, LDL-C, HDL-C on day 1, day 70 and day 112.ResultsOn day 70, the serum TC (group B: 2.39±0.21 vs 1.93±0.15, group C: 2.45±0.29 vs 1.94±0.24), TG (group B: 1.04±0.21 vs 0.74±0.13, group C: 1.02±0.18 vs 0.76±0.15), LDL-C (group B: 1.04±0.12 vs 0.46±0.12, group C: 1.06±0.16 vs 0.46±0.07) of group B and group C were higher than day 1 (P<0.01). The serum TC of group D on day 70 had no change compared with day 1 (2.05±0.14 vs 1.98±0.21, P>0.05), while TG decreased (0.53±0.12 vs 0.77±0.22, P<0.05). LDL-C was higher than day 1 (0.74±0.15 vs 0.48±0.09), but it was still lower than that in group B (0.74±0.15 vs 1.04±0.12, P<0.05) and group C (0.74±0.15 vs 1.06±0.16, P<0.05). On day 112, the serum TC (2.13±0.19 vs 2.45±0.29), TG (0.46±0.07 vs 1.02±0.18), LDL-C (0.56±0.16 vs 0.81±0.11) of group C were lower than that on day 70 and in group B (2.13±0.19 vs 2.60±0.18, 0.46±0.07 vs 1.06±0.22, 0.56±0.16 vs 0.72±0.09, P<0.01).ConclusionHigh fat feedstuff can increase rats' blood lipid significantly. Saccharomyces boulardii has preventive effect on the formation of hyperlipidemia.
hyperlipidemia; probiotics; intestinal flora
R 574
A
2095-5227(2015)10-0976-04 DOI:10.3969/j.issn.2095-5227.2015.10.004
时间:2015-08-17 15:37
http://www.cnki.net/kcms/detail/11.3275.R.20150817.1537.002.html
2015-06-16
海军后勤科研计划课题(CHJ12J027)
Supported by the Foundation of Logistics of Chinese Navy(CHJ12J027)
李超,男,硕士,主治医师。研究方向:功能性胃肠病的基础及临床研究。Email: 578655913@qq.com
崔立红,女,博士,主任医师,教授,主任,博士生导师。Email: luckycui861@sina.com
