磷酸化金纳米粒子对含铀废水的比色检测
2015-03-20王攀峰邱燕芳郑智阳
高 豹 王攀峰 邱燕芳 王 琳 郑智阳
(东华理工大学,江西 南昌 330013)
磷酸化金纳米粒子对含铀废水的比色检测
高 豹 王攀峰 邱燕芳 王 琳 郑智阳
(东华理工大学,江西 南昌 330013)
采用阿仑膦酸修饰的金纳米粒子(ALD-AuNPs)作为一种简单的比色传感器对铀(Ⅵ)进行检测。基于磷酸根对铀酰离子的螯合作用,ALD-AuNPs可与铀酰离子形成金属螯合物,诱导ALD-AuNPs聚集,致使溶液由酒红色转变为蓝色,该变化可直接通过肉眼识别,从而建立起一种简单快速且适用于现场实时检测UO22+的可视化比色检测方法。在最优的pH、TEOS加入量、底物浓度和显色时间等条件下,其他金属离子对该比色系统无干扰。当铀酰离子浓度在1.10-2.20μmol·L-1范围内,该浓度与吸光度比值(A680/A518)呈现良好的线性关系(Y=1.2188X-1.2749(R2=0.9627))。其最低检测限为2.02×10-9mol/L。
纳米金 比色检测 铀 磷酸
1 引言
铀是放射性元素和有毒化学元素,会对人体造成各式各样的癌症和基因变异[1]。我国是一个能源大国,由于经济发展的需要,核力发电也越来越重要,对铀矿的开采日益增大。由此产生的放射性含铀废水通过地表径流和地下迁移对环境和人体造成巨大影响[2,3]。因此,检测水体中是否含有铀十分重要。
目前,检测铀的方法有很多,比如电化学法[4]、色谱法[5]、荧光法[6]等。这些方法虽然灵敏度高、检测限低,但是也存在着使用成本较高、操作过程复杂、不能现场检测等缺点。而纳米金比色法操作简单、成本低、并且可以用于现场快速检测,可以通过观察纳米金溶液的颜色变化来判断待测溶液中待测组分的大致含量。纳米金比色法凭借其快速、便捷和可视化的优势引起众多学者的关注。Liu用氰尿酸修饰纳米金检测溶液中的Hg2+[7],Tripathy等人在含有硫代硫酸盐与氨的溶液中检测Cu2+[8],Mao用谷胱甘肽作还原剂与稳定剂用纳米金检测Pb2+[9]。目前,已经有人利用纳米金比色法对铀的检测进行研究。例如Zhou等人利用脱氧核酶修饰金纳米粒子[10],当铀存在时,引发金纳米粒子聚集,使溶液颜色发生变化实现对铀的可视检测。使用DNA酶作为修饰配体虽然灵敏度高,选择性好,但是DNA成链时间长且成本高。本文利用氨基与金纳米颗粒表面良好的结合能力以及磷酸基团对铀(VI)又具有优异的螯合能力,用阿仑膦酸作为修饰配体,得到磷酸化的金纳米粒子(ALD-AuNPs)。铀的加入会使得磷酸化的金纳米粒子发生聚集,从而使得溶液颜色由红色变为蓝色,实现了对铀的可视化检测,此方法反应时间短、操作简单、成本低,可用于现场快速检测。
2 实验部分
2.1 实验仪器与主要试剂
实验仪器:PHC-3C精密酸度计,TU1810型紫外-可见分光光度计。
主要试剂:氯金酸(HAuCl4),硼氢化钠,盐酸,碳酸钠,阿仑膦酸,铀标准溶液等。
其他试剂均为分析纯,实验用水为超纯水。实验所用玻璃仪器全部要用王水润洗备用。
2.2 磷酸化纳米金的制备
在250mL圆底烧瓶中加入50mL 1 mmol·L-1氯金酸(HAuCl4),移取45μL 5mmol·L-1阿仑膦酸溶液加入至圆底烧瓶中,磁力搅拌10min。然后在急速搅拌的状态下,向烧瓶中缓慢滴加新制的1mL 0.1mol·L-1硼氢化钠溶液,溶液由淡黄色逐渐变为酒红色,持续搅拌3小时,即得到阿仑膦酸修饰的纳米金(ALD-AuNPs)溶液[11]。
2.3 磷酸化纳米金可视化检测UO22+
将一定体积的ALD-AuNPs溶液,调节至不同的pH,加入等量的UO22+溶液。观察溶液颜色变化,并用紫外-可见分光光度计进行光谱扫描,以最大吸收波长比值(A680/A518)的变化情况为考察对象,分析实验结果,选择最佳的pH值。
在最佳pH值下,将一定浓度UO22+离子溶液加入到ALD-AuNPs溶液中,并用紫外-可见分光光度计进行光谱扫描,以最大吸收波长比值(A680/A518)的变化情况,分析不同时间的显色变化,确定最佳响应时间。
在最佳pH值和响应时间下,将不同浓度溶液加入到ALD-AuNPs溶液中,并用紫外-可见分光光度计进行光谱扫描,以最大吸收波长比值(A680/A518)的变化情况为考察对象,绘制浓度与吸光度比值(A680/A518)的线性关系,计算检出限。
在最佳实验条件下,将同浓度的常见金属离子与UO22+溶液加入到ALD-AuNPs溶液中,并利用紫外-可见分光光度计进行光谱扫描,以最大吸收波长比值(A680/A518)的变化情况为考察对象,研究ALD-AuNPs对UO22+的选择性。
3 结果与讨论
3.1 实验方法可行性分析
图3-1解释了ALD-AuNPs的比色检测的传感机理。研究表明了氨基可以很稳定地与纳米金颗粒结合,磷酸基对UO22+离子又具有优异的螯合效果。[11,12]因此通过Au-N共价偶联作用将阿仑膦酸修饰到纳米金颗粒的表面,得到磷酸化的纳米金(AuNPs)溶液,加入UO22+离子后使得ALD-AuNPs聚集,溶液颜色发生改变。

图3-1 水溶液中铀的检测原理图
用ALD-AuNPs溶液检测浓度为2.01μmol·L-1的UO22+离子溶液,结果如图3-2所示。未加入UO22+离子(曲线a)时的纳米金溶液呈现红色,此时纳米金处于良好的分散状态。在紫外-可见光谱上,它的特征吸收峰的位置在518nm附近,峰窄且尖。当向以上溶液中加入UO22+离子后(曲线b),溶液颜色变为蓝色,这是由于UO22+与磷氧键形成金属-配体协同作用,缩短了纳米金颗粒之间的距离,使纳米金颗粒之间发生了团聚,其表面等离子体共振吸收发生红移,在680nm处出现一个新的宽峰,溶液颜色也由红色变为蓝色。
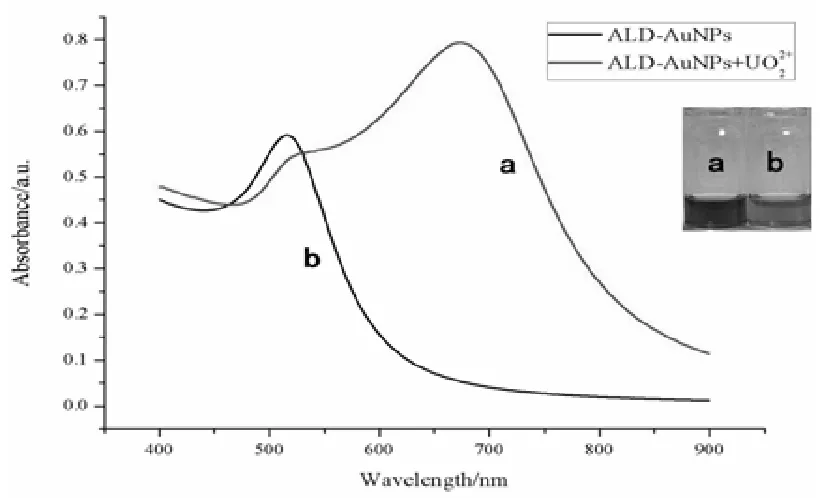
图3-2 加入2.01μmol·L-1UO22+前后的ALD-AuNPs溶液紫外-可见吸收光谱图(插图为实际照片)
3.2 pH对ALD-AuNPs比色检测铀(Ⅵ)的影响
为了选择ALD-AuNPs测定UO22+的最佳实验条件,利用单变量法考察了影响灵敏度、选择性及稳定性的主要因素。首先,以不同pH条件下的吸光度比值(A680/A518)为考察对象,研究不同的pH对测定UO22+的影响。如图3-3所示,在pH>3时,未加入UO22+时,ALD-AuNPs的吸光度比值基本不受pH的影响,表明酸度对纳米金的聚集影响很小。但是加入UO22+后,吸光度比值(A680/A518)迅速增加,在pH=4.0左右,吸光度比值达到最大。当pH值大于4.0时,由于UO22+逐渐水解,产生了包括(UO2(OH)+,(UO2)2(OH)22+,(UO2)3(OH)53+)等一系列不利于检测的水解产物。所以,比色检测的最佳pH值为4.0。

图3-3 pH改变对比色检测的铀的吸光度比值(A680/A518)变化影响
3.3 ALD-AuNPs比色检测铀的响应时间探讨
实验还比较了加入不同浓度UO22+时纳米金溶液的吸光度比值(A680/A518)与时间的关系,以此来确定体系的稳定时间。由图3-4可以看出,当UO22+的浓度为1.23μmol·L-1时,吸光度比值(A680/A518)变化不明显,但是当加入的UO22+浓度更大时,ALD-AuNPs的吸光度比值(A680/A518)有明显的增加,而且浓度越高增加越大,达到稳定的时间也越短。20min时,吸光度比值基本上都达到了稳定值。因此,选用20 min作为体系对铀的最佳检测时间。
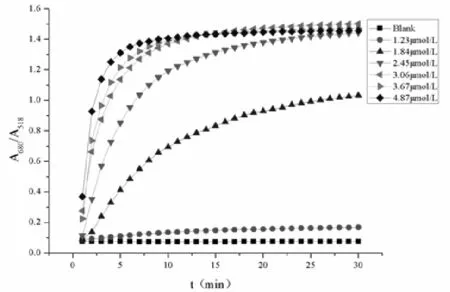
图3-4 加入不同浓度的的吸光度比值(A680/A518)随时间的变化
3.4 ALD-AuNPs对浓度的线性检测
为了验证最佳条件下ALD-AuNPs检测UO22+的灵敏度,选取不同浓度的UO22+加入到ALD-AuNPs溶液中,显色20min后进行紫外-可见吸收光谱分析如图3-5所示。当加入的UO22+浓度到0.92μmol·L-1时,体系并无明显颜色变化,随着UO22+浓度的增加,溶液颜色逐渐由红色变为紫色直至蓝色。当浓度达到1.47μmol·L-1时,溶液颜色发生明显变化,变为紫色。吸光度比值(A680/A518)与浓度的关系如图3-6所示,由图可知当UO22+的浓度在1.10-2.20μmol·L-1范围内时,吸光度比值(A680/A518)与其对应的浓度存在较好的线性关系,如图3-7,线性方程为Y=1.2188X-1.2749(R2=0.9627),ALD-AuNPs对铀的检出限(LOD)为2.02nmol·L-1(S/N=3)。
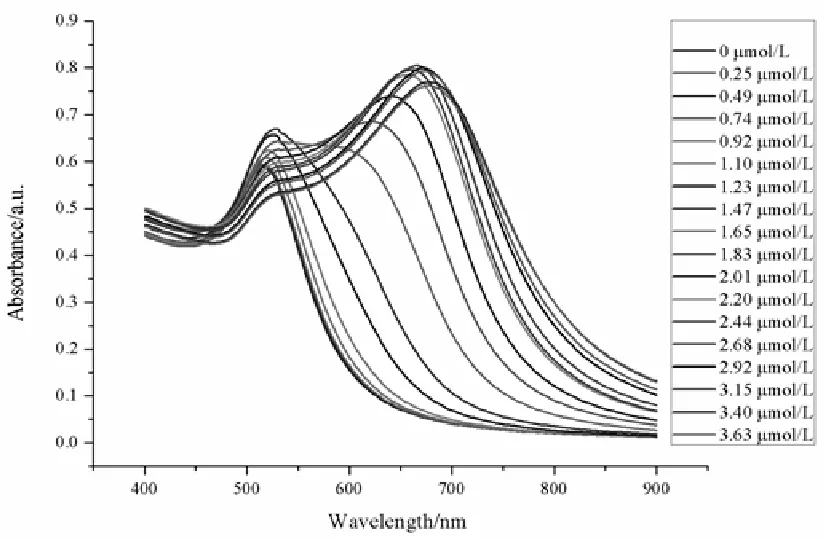
图3-5 加入不同浓度的紫外-可见吸收光谱图
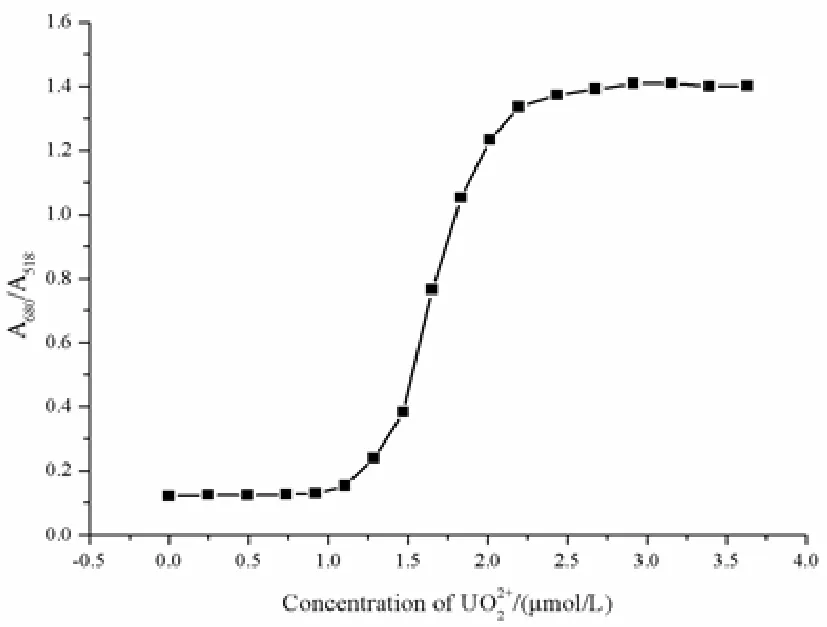
图3-6 吸光度比值(A680/A518)与浓度的关系

图3-7 的浓度在1.10-2.44μmol·L-1范围内与吸光度比值的线性关系
3.5 ALD-AuNPs检测的选择性研究
通过加入与同浓度的环境中常见重金属离子Hg2+、Co2+、Mn2+、Cu2+、Ni2+、Zn2+、Ba2+、Sr2+、Mg2+、Ca2+、K+、Na+、Fe2+、Cs+、Cd2+,来研究ALD-AuNPs探针对的选择性。如图3-8,通过ALD-AuNPs检测不同离子的紫外-可见光谱图和实际图片,可知只有加入UO22+的光谱曲线有明显的红移,溶液的颜色变为蓝色。同时,如紫外-可见光谱所示,只有加入了UO22+的样品在680 nm处出现了一个新的强的吸收峰,而其他离子的光谱图与空白基本相同,表明ALD-AuNPs溶液对UO22+具有很好的选择性,且能用肉眼直接观察到实验的结果。ALD-AuNPs溶液检测不同金属离子的吸光度比值(A680/A518)如图3-9所示,加入UO22+后,其吸光度比值与空白值相比明显增大,吸光度比值是其他金属离子的10多倍,也充分说明ALD-AuNPs溶液中的磷酸基团对UO22+具有很高的选择性。
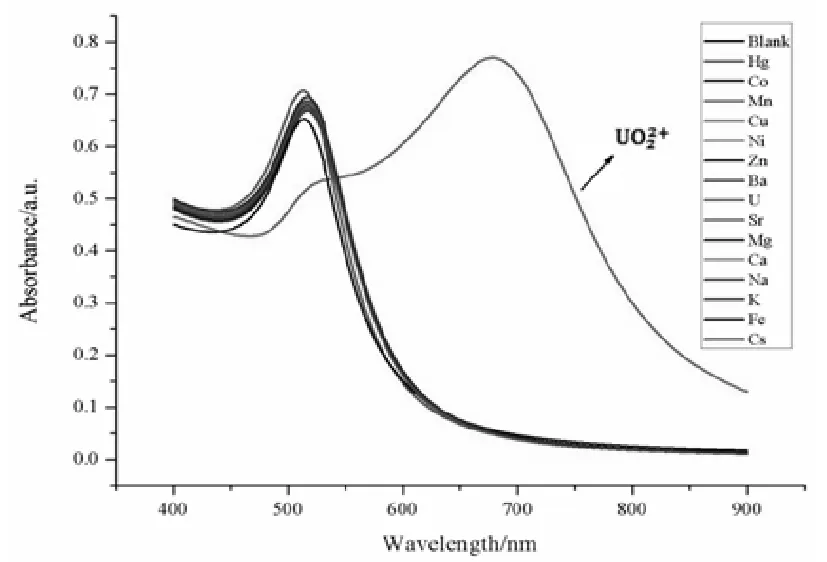
图3-8 ALD-AuNPs溶液检测不同离子的紫外-可见吸收光谱
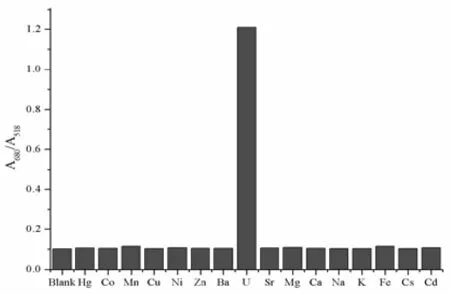
图3-9 ALD-AuNPs检测不同离子的吸光度比值(A680/A518)对比
4 结语
本文以纳米金颗粒为载体,阿仑膦酸为修饰,制成磷酸化的纳米金(ALD-AuNPs),通过磷酸基团与的金属-配体协同作用,实现了对水溶液中的简单、快速、可视化的检测。该法仅使用Uv-Vis对其进行表征,无需其他复杂仪器,也可通过肉眼观察溶液颜色的变化来判定水溶液中是否存在。实验考察了pH值和时间等因素对纳米金比色检测的影响,研究了ALD-AuNPs检测的选择性,通过理论计算出方法的检测限。实验结果表明,方法的最佳pH值为4,在此pH下,ALD-AuNPs对的最佳响应时间为25min。且ALD-AuNPs对具有很好的选择性,在最佳条件下,体系对的检出限为2.02nmol·L-1。本文为今后废水中的实时检测,提供了一种新的方向和途径,具有良好的应用前景。
[1]张珩,李积胜,铀对人体影响的机制及防治[J].国外医学(卫生学分册),2004,31(2):80-84.
[2]赵鲁雪,罗学刚,唐永金,彭芳芳,王丽超.铀污染环境下植物的光合生理变化及对铀的吸收转移[J],安全与环境学报,2014,14(2):299-304.
[3]张彬,冯志刚,马强,陈荣,广东某铀废石堆周边土壤中铀污染特征及其环境有效性[J],生态环境学报2015,24(1):156-162.
[4]Yamamura T.,Shiokawa Y.,Yamana H.,et al.Electrochemical investigation of uranium β-diketonates for all-uranium redox flow battery[J].Electrochimica Acta,2002,48(1):43-50.
[5]Thakur S.,Yadav J.,Rao D.Estimation of uranium isotope in urine samples using extraction chromatography resin[J].Radiation Protection and Environment,2012,35(2):77-85.
[6]MAlrakabi,G Singh,et al.A Bhalla,et al.Study of uranium contamination of ground water in Punjab state in India using X-ray fluorescence technique[J].Journal of Radioanalytical and Nuclear Chemistry,2012,294:221-227.
[7]Zening Liu,Jiao Hu et al.Colorimetric detection of Hg2+ions in aqueous media using CA-Au NPs[J]Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy 2012,97,737-740.
[8]Suraj Kumar Tripathy,Ju Yeon Woo and Chang-Soo Han,Surface-plasmon-based colorimetric detection of Cu(II)ions using label-free gold nanoparticles in aqueous thiosulfate systems[J].2012,23(30):5502-5508(7).
[9]Xiang Mao,Zheng-Ping Li,Zhi-Yong Tang,One pot synthesis of monodispersed L-glutathione stabilized gold nanoparticles for the detection of Pb2+ions[J].Frontiers of Materials Science,2011,5(3):322-328.
[10]Bin Zhou,Lin-Fei Shi,Yong-Sheng Wang et al.Resonance light scattering determination of uranyl based on labeled DNAzyme-gold nanoparticle system[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2013,110:419-424.
[11]Takuro Niidome,Kanako Nakashima,et al.Preparation of primary amine-modified gold nanoparticles and their transfection ability into cultivated cells[J].Chem.Commun.,2004,1978-1979.
[12]Ryan D.Ross and Ryan K.Roeder,Binding affinity of surface functionalized gold nanoparticles to hydroxyapatite[J].J Biomed Mater Res Part A 2011,99A:58-66.
