SWI在早产儿缺血缺氧性脑损伤诊断中的临床应用
2015-03-20杨阳田志雄曾俊杰
杨阳,田志雄,曾俊杰
新生儿缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)是早产儿常见疾病,也是导致早产儿急性死亡和神经系统功能障碍的主要原因之一。早产儿HIBD发病率明显高于足月儿,且早产儿HIBD的病理及临床表现与足月儿明显不同,诊断标准也有区别[1]。早期诊断和干预可以改善早产儿HIBD的预后,减少后遗症的发生。近年来研究表明,磁共振磁敏感加权成像(susceptibility weighted imaging,SWI)可以明显增加对小儿神经系统疾病诊断的敏感性及特异性[2]。本研究将SWI与常规MRI扫描序列对不同分级早产儿HIBD中出血性病灶及扩张的脑内静脉显示的检出率进行比较,旨在探讨SWI序列在早产儿HIBD诊断及分度中的临床应用价值,提高早期诊断和治疗水平。
材料与方法
1.一般资料
选取2013年1月-2014年6月在武汉大学附属中南医院经临床诊断为HIBD的早产儿为研究对象,纳入标准如下:①有缺氧的证据:PaO2<50mmHg或/和SaO2<85%,或存在因缺氧引起的酸中毒(BE<-10mmol/L);②有一定的神经系统症状体征;③有特异性的影像学改变,必须至少具有以下一项:脑室周一脑室内出血、脑室周围白质软化、脑实质梗死或出血、脑实质水肿或/和脑细胞毒性水肿(弥散加权磁共振发现脑细胞毒性水肿可确诊)等;④除外感染、电解质紊乱及先天性代谢缺陷等疾病引起的脑损伤。参照常立文等[3]推荐的早产儿HIBD分度标准,根据超声检测将早产儿HIBD分级如下:轻度,仅存在脑水肿或/和Ⅰ~Ⅱ级PVH-IVH或/和Ⅰ~Ⅱ级PVL,RI>0.75或<0.55;重度,存在Ⅲ~Ⅳ级PVH-IVH或/和Ⅲ~Ⅳ级PVL,RI>0.90或<0.50。PVHIVH分级标准:Ⅰ级,室管膜下出血;Ⅱ级,脑室内出血但无脑室扩大;Ⅲ级,脑室内出血伴脑室扩大;Ⅳ级,脑室内出血伴脑实质内出血。PVL分级:Ⅰ~Ⅱ度,无囊腔或脑室周围局部小囊腔改变;Ⅲ~Ⅳ度,脑室周围局部小囊腔改变融合成片/累及皮质。
研究共纳入对象30例,其中男18例,女12例(胎龄28~35周),中位日龄14.5d(4~37d),其中合并有9例低体重儿,12例新生儿窒息,11例新生儿呼吸窘迫综合症及8例新生儿缺血缺氧性心肌损害。临床表现包括呻吟、口吐白沫、皮肤发绀、惊厥、呼吸衰竭、肌张力异常等。所有患儿经超声检查后确定有颅内特异性影像学改变,后行MRI及SWI序列扫描。
2.检查方法
检查前对无法自然入睡的患儿给予10%水合氯醛0.5mg/kg,口服或肛门给药镇静,待其熟睡后扫描。MRI设备为Siemens 3.0T超导磁共振成像系统,18通道相控阵头颅线圈。常规行横轴面快速自旋回波(TSE)T2WI、自旋回波(SE)T1WI序列和反转恢复FLAIR序列。SWI具体参数:TR 28ms,TE 20ms,翻转角20°,FOV 230mm×200mm,矩阵298× 448,Average 0.75,扫描层厚1.2mm。采集结束时可得到两组图像,即磁矩图像和幅度图像。此后可在工作站上进行数据的进一步处理,形成最终的SWI图像。
由两位高年资的影像诊断医师盲法读片,首先结合患儿临床资料,根据其超声、MRI常规图像影像学表现对HIBD进行分级。进一步对出血灶数量、部位、范围,以及是否存在异常扩张静脉、扩张静脉的分布情况进行统计分析;结果以两位医师达成一致意见为准。
3.统计学分析
根据HIBD分类分组,采用SPSS 19.0进行统计学分析,对SWI与MRI对颅内出血灶检出采用两相关样本的非参数检验,对SWI对轻重度HIBD早产儿的颅内出血灶、静脉扩张检出率进行χ2检验,以P<0.05为差异具有统计学意义。
结 果
本组30例患儿中,常规MRI序列共检出30处颅内出血灶,其中脑实质内出血12处,硬膜下出血5处,室管膜下出血9处,脑室内出血4处。另显示双侧脑室扩大2例,脑白质斑片状异常信号6例,多发囊变灶3例。SWI序列共检出46处颅内出血灶,其中脑实质内出血20处,硬膜下出血5处,室管膜下出血14处,脑室内出血7处(表1),另显示出扩张小静脉19例,颅内出血合并小静脉扩张共14例。颅内出血灶SWI图像上表现为小圆点、索条状、斑块状低信号,亚急性期血肿呈圆形低信号或中心等信号,外周环绕低信号呈单环状改变;脑室内及硬膜下出血灶主要表现为点状、条状,新月形低信号;异常扩张静脉表现为细条状、分叉状低信号影(图1~2)。SWI序列与MRI常规序列对病灶的显示差异有统计学意义(P<0.005),尤其在显示微小出血灶个数及大小方面具有明显优势,25%微小出血灶在MRI常规序列上未见显示。
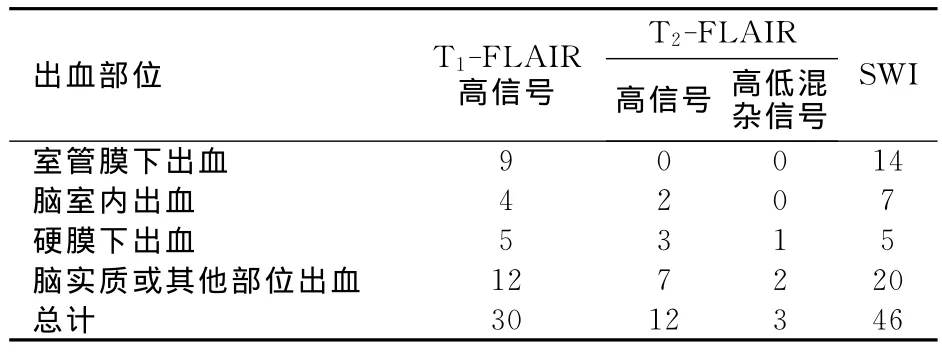
表1 早产儿HIBD出血性病灶各序列检出情况及信号表现 (个)
SWI对轻、重度HIBD脑实质内出血、静脉扩张的检出率差异有统计学差异(χ2=4.464,P=0.035;χ2=4.649,P=0.031);且重度HIBD患儿颅内出血合并异常静脉扩张检出率高于轻度HIBD患儿(χ2=5.714,P=0.017),见表2。
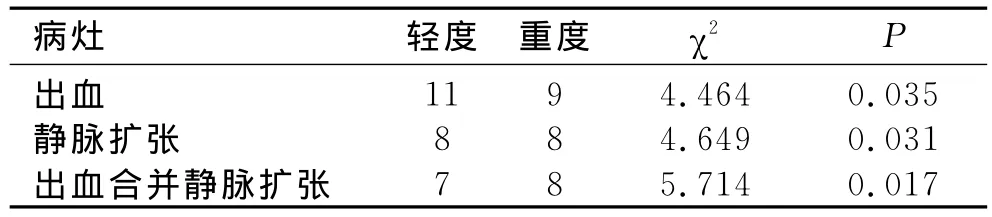
表2 早产儿不同临床分类HIBD出血及静脉扩张检出情况 (例)
讨 论
虽然早产儿发病机制、临床表现与足月儿有较大差别,但我国对缺氧缺血性脑损伤的诊断及分类仍没有明确标准。早产儿强调缺氧证据的重要性,且影像学检查为其必备条件。超声检查敏感性及分辨力较低,不能整体检出病灶,且易受操作者主观因素等影响;另一方面,头颅CT脑白质低密度不能作为诊断早产儿HIBD的依据[3]。研究资料显示,与超声检查进行比较,早产儿在生后第1周进行MRI检查,更易探查到白质损伤、出血性损伤及更多或广泛性囊腔损伤。两项MRI与神经病理对照的研究提示MRI预测病理异常的敏感度为70%,阳性率为100%[4]。本研究采纳常立文等[3]提出的早产儿HIBD分度标准,将其分为轻度及重度;轻度一般不遗留后遗症,重度脑损伤较重,易导致神经系统发育障碍,可引起脑瘫、智力低下、生长发育滞后、癫痫等后遗症。从新生儿期开始进行系统的早期动作和运动能力的检测及强化训练等,对改善早产儿智能和运动发育水平,提高早产儿生存质量具有十分重要的意义[5]。
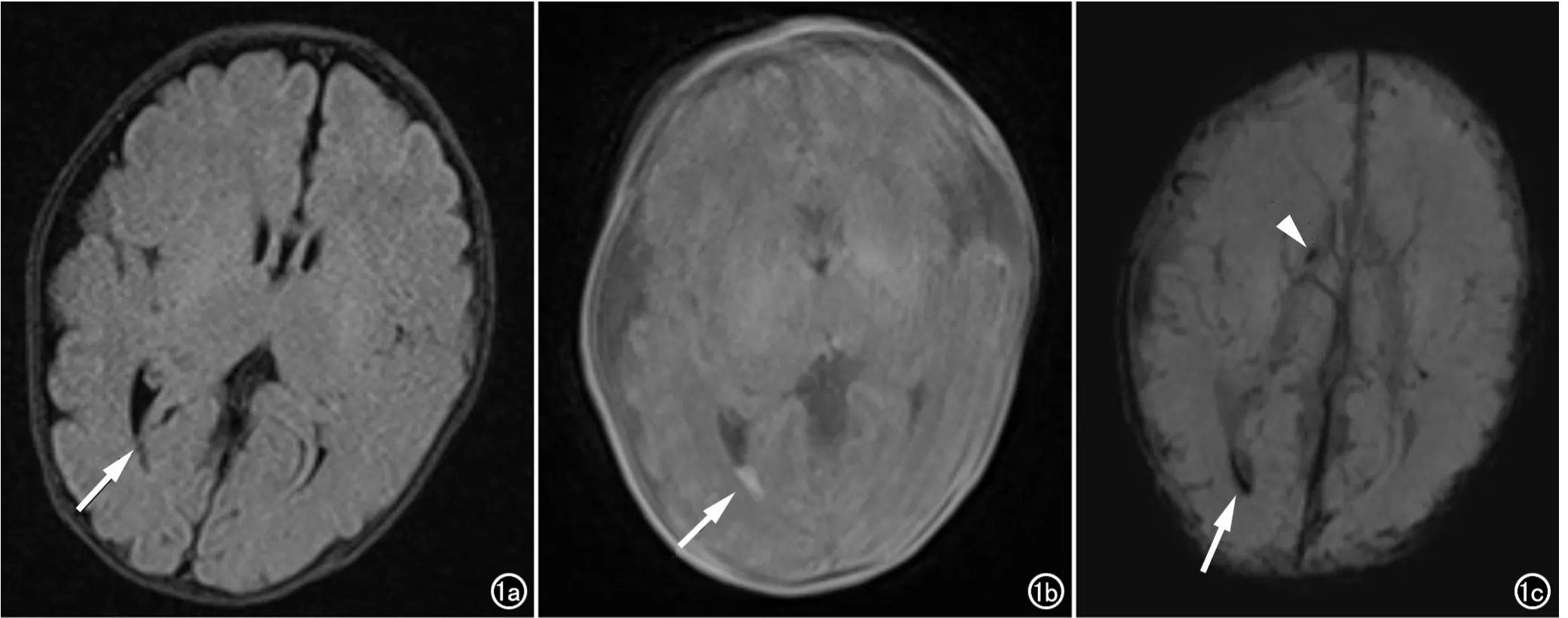
图1 男,胎龄35W,轻度HIBD。a)右侧脑室后角内见少量T2-FLAIR等信号灶(箭);b)侧脑室后角病灶T1WI呈高信号(箭),右侧基底节未见明显异常信号灶;c)SWI图像示右侧脑室后角内条带状低信号灶(箭),另右侧基底节区点状低信号灶(箭头)。
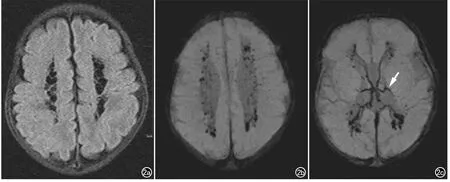
图2 男,胎龄29+5 W,重度HIBD。a)双侧脑室旁多发T2-FLAIR低信号、边界清晰囊变灶;b)SWI图像示囊变灶内伴有多发斑点状出血灶;c)室管膜下静脉可见异常扩张(箭)。
早产儿HIBD不同程度脑损伤与患儿产前、产时及产后综合作用导致的围产期窒息密切相关,主要表现为脑室周围脑白质软化灶形成及室管膜下生发基质-脑室内出血。早产儿脑室周围脑白质区血管发育不完善、血流量低,易导致脑血管自动调节功能损伤、被动压力脑循环或静脉淤滞、血栓形成[1]。特别是胎龄在32周以下的早产儿,在脑室周围的室管膜下及小脑软脑膜下的颗粒层均留存胚胎生发基质,该组织是未成熟的毛细血管网,易发生血流动力学变化而致出血和出血性脑梗塞,室管膜下出血向内可破入脑室,外渗可扩散至脑室周围脑白质。
磁敏感成像(SWI)是一种高空间分辨力的3D梯度回波MR成像技术,通过图像后处理后可以突出显示血液中产生的顺磁性物质,尤其是血液、钙化、含铁血黄素及低流速血管[6],可以清楚的显示动、静脉解剖形态的改变即低信号的微小出血灶,并对发现血管内缺氧血及血管外出血灶同样敏感[7],具有三维、高分辨力、高信噪比、薄层扫描的特点。SWI已经广泛应用于颅内出血、脑血管畸形、脑血管意外、外伤、脑肿瘤、感染及神经退行性病变[6]。
国内外多篇文献[8-11]报道,SWI对颅内出血灶敏感性、特异性均高出常规MRI序列,不仅可以显示MRI常规序列显示不了的微小出血灶,而且显示的病灶边界更清晰,范围不同程度扩大,故对新生儿合并出血灶的HIBD诊断有很高的临床价值。本研究数据显示,脑实质内出血灶在SWI序列表现为斑点状、小圆形或团片状低信号;脑室内出血及硬膜下出血多表现为铸型或新月形低信号。SWI序列检出颅内出血灶多达46处,而T1-FLAIR及T2-FLAIR序列仅分别检出30、15处,二者检出率差异有明显统计学意义,显示出SWI序列优越性;SWI序列对轻重度患儿颅内出血灶检出率之间有统计学意义,可认为SWI序列对重度HIBD出血灶检出率较轻度HIBD高,与张雪雁等[8]的结果在一定程度上相似。
由于脑组织缺氧及缺血致脑内静脉淤血及静脉压力增高,易导致脑深部静脉及皮质静脉不同程度扩张[12-13],SWI对该现象敏感性较高,而常规MRI图像一般未见显示。本研究结果显示轻、重度HIBD之间SWI检出脑室周围静脉扩张差异有统计学意义,认为重度HIBD早产儿检出率高。郭建东等[9]研究表明,新生儿HIE患儿颅内出血及颅内出血合并脑内静脉扩张在SWI序列上检出率在轻度HIE患儿组中最低,在重度组最高,与本研究结果相符。Kitamura等[12]提出了将神经系统缺血性损伤患儿颅内静脉扩张进行分级评分(1~6级),其结果表明,未见明显扩张深髓静脉或皮质静脉的患者较异常静脉扩张患者神经系统预后好。SWI技术在静脉扩张的敏感性可以明显提高HIBD诊断的准确性,并对HIBD所导致脑组织损伤的程度评估及评判预后情况提供更多的参考依据。
本研究常规MRI序列检出2例胼胝体异常信号、5例脑白质斑片状异常信号(PWMI)及4例双侧脑室旁多发软化灶(PVL);SWI序列检出3例双侧脑室旁多发软化灶合并微小出血灶(PVH-PVHI)。斑点状白质病变[14](punctuate white matter lesions,PWML)主要表现为大脑白质区T1WI高信号而T2WI呈等或低信号,常见于新生儿缺氧缺血性脑病、新生儿低血糖性脑损伤及早产儿脑损伤。SWI序列可以为将其与T1WI高信号出血灶,或者PWML合并出血区别开来[15]。
本研究存在一些不足,首先样本量偏小(n=30),统计学结果的稳定性值得进一步探讨,故下一步需要大样本量的临床研究,进一步分析不同临床分度之间颅内出血及脑内静脉扩张的数量及部位的差别;其次,可以寻找适用于早产儿的体格及神经系统功能量表,结合SWI表现,从而判断预后;另外,SWI扫描时间较长,部分患儿不能配合制动,故需要进一步缩短SWI扫描时间。总的来说,SWI可以作为早产儿HIBD的辅助诊断方法,提倡广泛应用于临床。
[1] 孟璐璐.早产儿缺氧缺血性脑病的发病机制及诊断标准的探讨[J].医学综述,2012,18(1):73-75.
[2] Bosemani T,Poretti A,Huisman TA.Susceptibility-weighted imaging in pediatric neuroimaging[J].J Magn Reson Imaging,2014,40(3):530-544.
[3] 常立文,刘敬,李文斌.早产儿缺氧缺血性脑损伤的诊断与分度探讨[J].中国当代儿科杂志,2007,(4):293-296.
[4] 陈惠金.美国神经学会新生儿神经影像指南[J].实用儿科临床杂志,2008,23(2):157-160.
[5] 夏正荣.磁敏感加权成像在新生儿缺氧缺血性脑病中的应用[J].放射学实践,2010,25(12):1313-1315.
[6] Ong BC,Stuckey SL.Susceptibility weighted imaging:apictorial review[J].J Med Imaging Radiat Oncol,2010,54(5):435-449.
[7] Haacke EM,Xu Y,Cheng YC,et al.Susceptibility weighted imaging(SWI)[J].Magn Reson Med,2004,52(3):612-618.
[8] 张雪雁,李军.新生儿缺氧缺血性脑病分度与磁敏感加权成像出血检出率的相关性研究[J].磁共振成像,2014,(3):166-169.
[9] 郭建东,苏锦权,张水兴,等.3.0T核磁共振磁敏感加权成像在新生儿缺氧缺血性脑病诊断的价值[J].临床儿科杂志,2013,(7):645-649.
[10] 杜隽,钟玉敏,王谦,等.磁敏感加权成像在新生儿颅内出血中的应用研究[J].临床医学工程,2012,19(2):161-164.
[11] 詹传银.磁敏感加权成像(SWI)在新生儿颅内出血的初步应用[D].南方医科大学,2009.
[12] Kitamura G,Kido D,Wycliffe N,et al.Hypoxic-ischemic injury:utility of susceptibility-weighted imaging[J].Pediatr Neurol,2011,45(4):220-224.
[13] Tong KA,Ashwal S,Obenaus A,et al.Susceptibility-weighted MR imaging:a review of clinical applications in children[J].AJNR,2008,29(1):9-17.
[14] Ramenghi LA,Fumagalli M,Righini A,et al.Magnetic resonance imaging assessment of brain maturation in preterm neonates with punctate white matter lesions[J].Neuroradiology,2007,49(2):161-167.
[15] 朱珍,邵肖梅,汤伟军,等.磁敏感加权成像在新生儿脑斑点状白质病变的初步应用[J].中华医学杂志,2011,91(23):1600-1604.
