探索静水高压在研制黑色素瘤疫苗方面的应用
2015-03-18刘泽强庄敏丽潘月海马占川
刘 凯 刘泽强 庄敏丽 潘月海 马占川 刘 彬
(吉林大学第一医院,长春 130000)
近年来黑色素瘤的发病率在全世界呈上升趋势[1]。因此,黑色素瘤的防治已成为全球医药卫生工作的重要任务。黑色素瘤易转移、侵袭和复发等特性,使各种治疗方法如手术、化疗和放疗均效果不佳。随着人们对免疫系统认识的深入,用免疫方法防治肿瘤成为了热点。肿瘤细胞表面抗原可被宿主的免疫系统所识别,运用免疫佐剂增强肿瘤抗原的免疫原性,诱发机体免疫应答,以达到防治肿瘤的目的[2,3]。
细胞破碎可释放肿瘤抗原。常用的细胞破碎方法有机械、非机械两种。静水高压属于机械破碎,其破坏肿瘤细胞结构,使其失去增殖、侵袭及转移的能力,但保留其免疫原性。细胞表面、胞内蛋白经高压处理后可能会暴露相应的亚单位,进而增强免疫原性。本实验采用静水高压、液氮反复冻融不同细胞破碎方法制成肿瘤疫苗免疫小鼠,通过小鼠体内荧光成像、DTH 实验等不同的指标检测,进而比较两种方法的优劣性。
1 材料与方法
1.1 材料
1.1.1 实验动物 C57BL/6J 纯系小鼠30 只,SPF级,购买于北京维通利华生物技术有限公司。雌性,体重(22 ±2)克。饲养于吉林大学第一医院转化医学院。
1.1.2 实验细胞株 鼠源性B16 黑色素瘤细胞株,含有免疫荧光基因的鼠源性B16 黑色素瘤细胞株,由吉林大学第一医院转化医学院赠予。
1.1.3 其他实验材料 DMEM 培养基(HyClone 公司),胰酶(HyClone 公司),PBS 溶液(LEAGENE 公司),台盼蓝染液,医用三通,弗氏佐剂(Sigma 公司),普通显微镜(Olympus 公司),细胞培养箱(thermo 公司),荧光素酶底物(PEL 公司),小动物活体成像系统(Caliper 公司),冻存管(CIRNING 公司),超净台(thermo 公司),DH600-0.8X2(9242)静压机(上海大隆高压设备制造厂)。
1.2 实验方法
1.2.1 肿瘤疫苗的制备 将液氮罐中取出的B16黑色素瘤细胞复苏及数次传代后,取对数生长期的细胞,用0.25%胰酶消化细胞,离心后计数细胞浓度为1.6 ×107ml-1。使用3 个柔软的无菌套分别盛装1ml 细胞悬液放入静压机中,200 mpa 压力破碎细胞30 min[4]。分别吸取1 ml 悬液于3 个冻存管中,液氮浸泡3 min,37℃水浴3 min,反复3 次。将高压破碎与冻融破碎的细胞液用台盼蓝染色,在普通光学显微镜下见两组均无完整细胞。将1.5 ml高压破碎细胞液与同体积完全弗氏佐剂分别抽吸于两个5 ml 玻璃注射器中,三通联接两注射器,反复抽推30 min,充分乳化。另取冻融破碎的细胞悬液、PBS 溶液分别充分乳化[5]。乳化后将一滴乳化液滴入纯水中,若30 min 不散开,则证明乳化完全。
1.2.2 小鼠免疫 30 只小鼠打耳号,使用随机数字表法分为6 组。每只小鼠背部皮下多点注射乳化液进行免疫,每只小鼠注射乳化液100 μl[5]。第1、3 组注射高压破碎乳化液,第2、4 组注射冻融破碎乳化液,第5、6 组注射PBS 乳化液。初次免疫后第14、28 天分别再次免疫,再次免疫使用不完全弗氏佐剂,剂量同前。
1.2.3 小鼠肿瘤的接种及测量 最后一次免疫7 d后,用含有免疫荧光基因的鼠源性B16 黑色素瘤细胞接种小鼠。第1、3、5 组小鼠行尾静脉注射浓度为1 ×106ml-1细胞悬液0.4 ml。第2、4、6 组小鼠在腹腔侧方皮下注射相同浓度的细胞悬液0.1 ml。接种肿瘤后,每日观察小鼠皮下是否长出瘤体。待长出瘤体后,用游标卡尺测量肿瘤的长径与宽径,并记录每组小鼠生存时间。
1.2.4 DTH 反应 采用足垫肿胀试验检测特异性迟发型超敏反应(DTH)。将小鼠进行分组:高压1组为高压破碎免疫后尾静脉注射肿瘤组,高压2 组为高压破碎免疫后皮下注射肿瘤组;冻融1 组为冻融破碎免疫后尾静脉注射肿瘤组,冻融2 组为冻融破碎免疫后皮下注射肿瘤组;对照1 组为空白对照免疫后尾静脉注射肿瘤组,对照2 组为空白对照免疫后皮下注射肿瘤组。小鼠在处死前1 d,于每只小鼠左前、后足垫分别注射1 ×105个(50 μl)细胞,24 h 后游标卡尺测量左、右足垫厚度,以两足垫厚度差计算肿胀反应[5]。
1.2.5 小鼠体内免疫荧光成像 小鼠称重,按小鼠每克体重10 μg 剂量腹腔注射氯胺酮。待麻药起效后按小鼠每克体重10 μg 剂量腹腔注射荧光素酶(Luciferase)。将小鼠放入活体成像系统进行体内免疫荧光成像。曝光时间为1 min。
1.3 统计学分析 采用统计软件SPSS13.0 进行统计学处理。计量资料以±s 表示,组内比较采用t检验,P<0.05 表示两组间比较差异有统计学意义。
2 结果
2.1 小鼠皮下肿瘤模型的建立 1 ×106ml-1的细胞液0.1 ml 接种于小鼠腹腔侧方皮下,成功建立小鼠黑色素瘤肿瘤模型,建模后3 d 可触摸到微小肿瘤结节,第5 天成瘤明显,成瘤率为100%。
2.2 小鼠生存时间 小鼠生存时间为从接种肿瘤至小鼠死亡。由图1 可见,高压组小鼠生存时间最长,冻融组次之,而对照组最短。各组小鼠生存时间差别有统计学意义(P<0.05)。
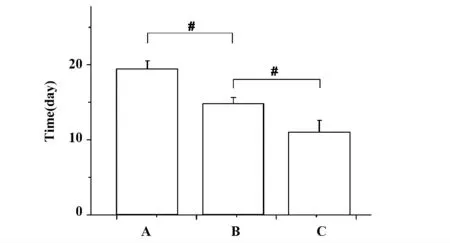
图1 各组小鼠生存时间Fig.1 Survival time of each group of mice
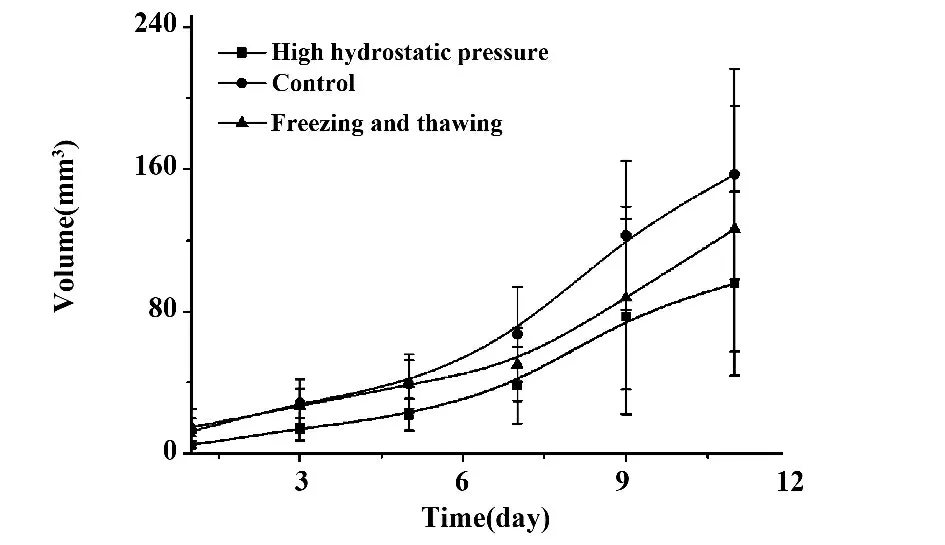
图2 每组小鼠瘤体体积与生存期Fig.2 Tumor volume and survival time of each group of mice
2.3 小鼠瘤体体积与生存期 隔日用游标千分尺记录肿瘤最长径(L)和垂直方向最大横径(W),依照下列公式计算肿瘤体积V=LW2/2(式中,V 为肿瘤体积,L 为肿瘤最长径,W 为肿瘤垂直方向的最大横径)。接种肿瘤至动物死亡的时间为小鼠生存期。荷瘤时间以肿瘤可触及时计算,直至动物死亡[6,7]。如图2 所示,自测量肿瘤第7 天开始,3 组肿瘤体积差别有统计学意义(P<0.05)。
2.4 DTH 实验 DTH 实验是评价细胞免疫最直接、最常用的在体试验,免疫效果可以通过产生迟发型超敏反应的强弱得到预测[5]。
如图所示,高压1 组、高压2 组、冻融1 组、冻融2 组与对照1 组、对照2 组之间存在显著性统计学差异(P<0.01)。而高压组与冻融组之间无统计学差异(P >0.05)。
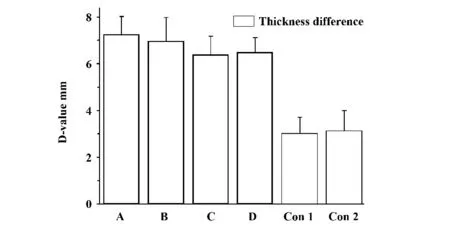
图3 DTH 实验每组小鼠前爪鼠垫厚度差值Fig.3 Difference of pad thickness of paw in mice after DTH experiment
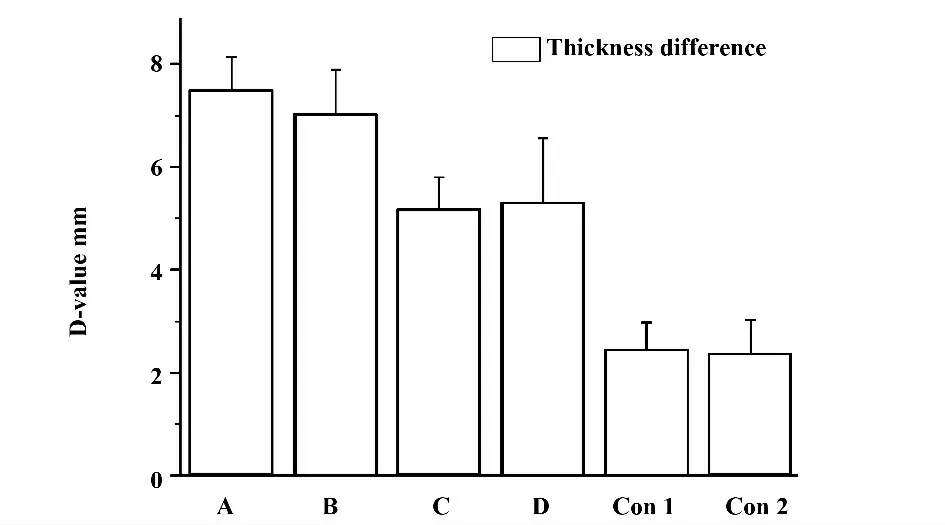
图4 DTH 实验每组小鼠后爪鼠垫厚度差值Fig.4 Difference of pad thickness of hind paw in mice after DTH experiment
如上图所示,高压组、冻融组与对照组之间均存在统计学差异(P<0.05)。与对照组比较,各实验组DTH 反应明显升高(P<0.05),但有文献表明:成瘤后随着肿瘤的增大,DTH 反应呈下降趋势[8]。
2.5 小鼠体内荧光成像 尾静脉注射肿瘤1 周后小鼠体内并未检测到明显的荧光成像(图5),表明此时小鼠体内并未形成明显转移瘤,或者形成转移瘤但体积小荧光弱,被体表皮毛覆盖。注射肿瘤2周后可检测到荧光(图6、7)。由图6 可见,冻融组比高压组荧光强度高、面积大,可见体内转移瘤生长较为旺盛。而高压组比对照组荧光强度低、面积小,可见肿瘤生长受到限制(图7)。

图5 小鼠体内荧光成像照片Fig.5 Photo fluorescence imaging in vivo
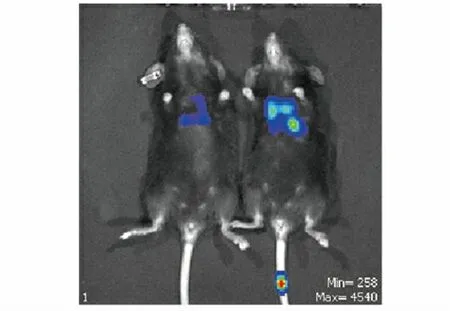
图6 尾静脉注射肿瘤2 周后成像图片Fig.6 Imaging picture of tail vein injection of tumor after two weeks

图7 尾静脉注射肿瘤2 周后成像图片Fig.7 Imaging picture of tail vein injection of tumor after two weeks
3 讨论
黑色素瘤疫苗是利用肿瘤细胞或抗原物质诱导机体产生特异性免疫反应,是一种主动特异性免疫治疗方法[9]。全细胞破碎研制肿瘤疫苗其优势在于细胞表面所有潜在的相关抗原均有可能被加工和提呈,激活多克隆淋巴细胞,具有激发免疫反应的巨大潜力。
静水高压处理对于细胞膜的流动性、通透性以及细胞的显微结构都具有明显的影响甚至破坏作用[10],使肿瘤细胞隐藏亚单位结构抗原位置暴露出来,增强了免疫原性。而且此方法制备疫苗具有不添加灭活剂、工艺简单、生产周期短、成本低廉等优点。由此可见,静水高压应用于制备疫苗具有广阔的发展前景。冻融法是将细胞冻结再融化,如此细胞膜亲水性、通透性增加,细胞内冰晶使细胞内外产生渗透压,并且胞内形成的冰晶也会破坏细胞膜[11]。
肿瘤细胞表面抗原及胞内蛋白经高压处理后,会使肽链的空间结构发生改变,暴露相应的功能单位及亚单位,增强了瘤苗的抗原性,从而可以有效地激活自然杀伤细胞(natural killer cell,NK)的活性,产生IFN-γ、粒细胞-巨噬细胞集落刺激因子(Granulocyte-macrophage colony-stimulating factor,GM-CSF)等细胞因子,利于树突状细胞(Dendritic cell,DC)存活和分化[12]。树突状细胞(DC)是体内最高效能的抗原提呈细胞,在抗肿瘤免疫中处于核心地位[13]。而DC 激活的抗原特异性T 细胞通过释放IL-2,又可以激活NK 细胞,使抗肿瘤的固有免疫应答和适应性免疫应答都得到活化和增强[14]。Rosenblatt等[15]认为将肿瘤细胞的全部抗原提呈给树突状细胞,从而激发机体产生特异性抗肿瘤反应,为T 淋巴细胞提呈了肿瘤的全套抗原,从而产生更好的抗肿瘤效果。而反复冻融可能在改变抗原蛋白空间结构及暴露蛋白质亚单位方面不如静水高压效果明显。这可能是两种疫苗效果差异的主要原因。另外反复冻融可产生许多细小冰晶,可能也对抗原蛋白产生了一定的影响。本实验对静水高压在研制黑色素瘤疫苗方面的应用进行了初步探索,同时也存在研究上的几个限制:小鼠的毛发、肿瘤表面组织及肿瘤的深度是否会对荧光成像结果产生影响,尚待进一步研究。肿瘤细胞在静水高压中的破碎方式是十分复杂的,不同的压强是否会产生不同的免疫反应。并且全细胞疫苗中主要诱导机体产生免疫反应的成分,本实验尚未阐明。且全细胞疫苗注入体内是否会产生全身的迟发型超敏反应,尚且有待进一步研究。
[1]Mei HF,Jin XB,Shen J,et al.β-defensin 2 as an adjuvant promotes anti-melanoma immune responses and inhibits the growth of implanted murine melanoma in vivo[J].PloS One,2012,7(2):e31328.
[2]Eun-Young Lee,Kyong-Su Park,Yong Song Gho,et al.Therapeutic effects of autologous tumor-derived nanovesicles on melanoma growth and metastasis[J].PloS One,2012,7(3):e33330.
[3]Colavecchia SB,Jolly A,Mundo SL,et al.Effect of lipoarabinomannan from mycobacterium avium subsp auium in freund's incomplete adjuvant on the immune response of cattle[J].Braz J Med Biol Res,2012,45(2):139-146.
[4]Wilton DJ,Ghosh M,Chary KV,et al.Structural change in a BDNA helix with hydrostatic pressure[J].Nucleic Acids Res,2008,36(12):4302-4307.
[5]周 伊,齐 旭,王一理,等.不同佐剂增强小鼠黑色素瘤瘤苗抗瘤细胞免疫效应的比较[J].肿瘤防治研究,2007,34(4):259-261.
[6]王淑瑞,齐 浩,郭 伟,等.B16 黑色素瘤移植模型的建立[J].西安文理学院学报:自然科学版,2006,9(1):18-20.
[7]曾曙光,刘启才,王素文,等.MtHSP70/HSV-tk 重组沙门菌抗小鼠黑色素瘤的作用[J].南方医科大学学报,2012,32(1):101-105.
[8]周 伊,齐 旭,王一理,等.新型佐剂SWZY 对弱免疫原性小鼠黑色素瘤瘤苗的免疫增强作用[J].细胞与分子免疫学杂志,2006,22(4):526-529.
[9]于 静,朱艳华,阎雪莹.黑色素瘤治疗方法的研究[J].哈尔滨商业大学学报(自然科学版).2014(3):266-270.
[10]白成科,李桂双,段 俊,等.高静水压对水稻种子萌发及同工酶的影响[J].高压物理学报,2003,17(4):283-289.
[11]万红贵,郭一丹,郑伟刚.几种细胞破碎方法对提取S-腺苷甲硫氨酸的研究[J].食品科技,2008,33(9):171-173.
[12]Granucci F,Zanoni I,Pavelka N,et al.A contribution of mouse dendritic cell-derived IL-2 for NK cell activation[J].J Exp Med,2004,200(3):287-295.
[13]Ferrari S,Rovati B,Porta C,et al.Lack of dendritic cell mobilization into the peripheral blood of cancer patients following standard or high-dose chemotherapy plus granulocyte-colony stimulating factor[J].Cancer Immunol Immunother,2003,52(6):359-366.
[14]Fehniger TA,Cooper MA,Nuovo GJ,et al.CD56 bright natural killer cells are present in human lymph nodes and are activated by T cell-derived IL-2:a potential new link between adaptive and innate immunity.[J].Blood,2003,101(8):3052-3057.
[15]Rosenblatt J,Vasir B,Uhl L,et al.Vaccination with dendritic cell/tumor fusing cells results in cellular and homoral antitumor immune reponses in patients with multipul myeloma[J].Blood,2011,117(2):393-402.
