CCR3 在哮喘小鼠气道组织Muc5ac 表达中的作用①
2015-03-18张建勇王秀丹郑飞彦杨红霞遵义医学院附属医院呼吸二科遵义563000
王 涛 张建勇 王秀丹 郑飞彦 杨红霞 (遵义医学院附属医院呼吸二科,遵义 563000)
支气管哮喘(简称哮喘)属于多发病、常见病,对人们的身体健康构成了严重威胁。哮喘气道炎症特征主要表现为浸润与活化嗜酸性粒细胞、活化炎症细胞、释放炎症介质及杯状细胞增生。这样则可分泌大量气道黏液。当气道炎症与气道黏液相互作用时,则哮喘患者的病情变得更加严重。因此在评价哮喘病情严重程度或估计其预后的危险因素时,应重点考虑气道黏液的高分泌。CCR3 是一种受体蛋白,可产生细胞迁移、活化效应,还可促进某些趋化因子反应。CCR3 主要存在于嗜酸性粒细胞中,当其与eotaxin-1、eotaxin-2、RANTES、MCP 等,经趋化作用刺激炎症细胞向气道黏膜迁移,使气道黏膜内炎症细胞浸润。进而诱导气道炎症的发生、发展,加剧哮喘病情[1]。本研究旨在通过应用CCR3 拮抗剂SB328437 干预哮喘组小鼠,探讨CCR3 在哮喘小鼠气道Muc5ac 表达中的作用。
1 材料与方法
1.1 实验对象 50 只6~8 周清洁级BALB/c 雄性小鼠,体重(18 ±2)g,由上海斯莱克实验动物中心提供[合格证号为:SCXK(沪)2009-0005]。
1.2 实验方法
1.2.1 主要试剂 卵清白蛋白OVA,V 级及氢氧化铝凝胶(美国Sigma 公司),小鼠抗小鼠-Muc5ac单克隆抗体(美国Neomarkers 公司),小鼠IL-4 ELISA 试剂盒及小鼠TNF-α ELISA 试剂(武汉博士德生物工程有限公司),DAB 显色试剂盒、鼠抗抗体二步法试剂盒(北京中杉生物技术有限公司),SB328437 Lot B38883(美国MERCK 公司),兔抗鼠CCR3 多克隆抗体(美国ABCAM 公司),RNAiso Reagent 试剂(美国Invitrogen 公司),荧光定量RTPCR 两步法试剂盒及荧光定量RT-PCR 引物(CCR3、Muc5ac、β-actin)均有大连TaKaRa 公司设计、生产,Icycler iQ5 荧光定量PCR 仪(美国Bio-Rad公司)。
1.2.2 制备小鼠哮喘模型分组及药物干预 (1)分组:50 只小鼠经随机数字法随机分为5 组,分别为正常对照组(NS 组)、哮喘组(AS 组)、地塞米松干预组(AS +DEX 组)、SB328437 干预组(AS +SB组)及溶剂对照组二甲基亚砜组(AS+DMSO 组),各10 只。第0 天与第10 天在其腹腔中注射0.2 ml致敏液(100 μg OVA 及2.5 mg 氢氧化铝凝胶);第14 天经1%OVA 溶液行超声雾化,30 min/次,连续7 d。正常对照组经生理盐水行致敏与雾化。(2)干预方法:地塞米松干预组、地塞米松干预组及溶剂对照组于OVA 雾化激发前1 h 分别腹腔注射SB328437(5 mg/kg)、地塞米松(2 mg/kg)及二甲基亚砜0.1 ml,1 次/d,连续7 d。小鼠于末次激发后12 h,行麻醉处死,结扎右肺,放入4%多聚甲醛中固定,将右肺上叶放入冻存管内,在-150℃冻存。后将颈部器官暴露出,在气管下段做“T”形切口,插入22G 留置针行气管插管,将0.3 ml 生理盐水缓慢注入,反复回抽3 次,经3 次灌洗(回收率>80%),为支气管肺泡灌洗液(BALF)。
1.3 观察指标及检测方法 制备肺组织的切片,在普通光学显微镜下观察。
1.3.1 AB-PAS 染色 切片脱蜡至水,后浸入阿尔辛蓝染液10 min,水洗5 min,1 次蒸馏水洗,浸入1%高点酸液10 min,水洗5min,浸入雪夫氏试剂5 min,冲洗5 min,脱水至无水酒精,二甲苯透明,中性树胶封片。
1.3.2 BALF 细胞计数及分类 在显微镜下计数细胞总数;同时将BALF 离心,将沉淀细胞行涂片,经瑞氏-姬姆萨染色,计算各种细胞的百分比。
1.3.3 免疫组织化学染色检测气道Muc5ac 及CCR3 表达 石蜡切片常规脱蜡至水,经SP 法免疫组,一抗为小鼠抗Muc5ac 单克隆抗体,兔抗为小鼠CCR3 多克隆抗体,稀释浓度均为1∶100,荧光定量RT-PCR 检测小鼠肺组织 Muc5ac mRNA、CCR3mRNA 的表达,荧光定量PCR 反应(SYBR Green Ⅰ嵌合荧光法),PCR 引物的设计和合成,小鼠CCR3 引物及内参照β-actin 引物的设计和合成,其序列如下:CCR3 引物序列:上游5'-GGCACTATGCAAATAACCCATGAA-3',下游5'-GGGTCTGTGTGCCAGAATAATGAA-3',PCR 产物179 bp,Muc5ac引物序列为上游5'-AATGACTCAATCTGCGTG-CCTTC-3',下 游5'-GGCAGTCGATGCTAATGGTGTG-3',PCR 产物13 5bp,β-actin 引物序列:上游5'-GGCCAACCGTGAAAAGATGA-3',下 游 5'-CAGCCTGGATGGCTACGTACA-3',PCR 产物168 bp。荧光定量PCR 反应条件:95℃,10 s,预变性,95℃,5 s 变性,59.3℃,20 s,退火延伸,共40 循环,55℃~95℃,10 s,共81 个循环,融解。各样本cDNA 进行荧光定量PCR 扩增。
1.4 统计学分析 经SPSS16.0 统计学软件行数据分析,计数资料经± s 表示,均数比较经方差分析。
2 结果

图1 各组肺组织病理改变(HE 染色,×200)Fig.1 A pathological changes in lung tissue chart (HE stain,×200)
2.1 小鼠肺组织HE 染色病理改变(见图1A-E)正常组小鼠支气管管壁及其周围组织结构完整而清晰,未见或见少量炎症细胞浸润。地塞米松组及SB328437 组小鼠支气管及周围组织尚清晰,有少量炎症细胞浸润。AS 组和AS +DMSO 组见支气管有明显的炎症细胞浸润,杯状细胞增生,管壁增厚,支气管狭窄。
2.2 小鼠BALF 细胞计数 各组小鼠BALF 细胞总数和细胞分类结果如表1 所示,AS 组BALF 细胞总数、嗜酸性粒细胞、淋巴细胞均较NS 组多(P 均<0.01),而单核细胞较NS 组有所减少(P 均<0.05)。AS+SB 组和AS +DEX 组细胞总数、嗜酸性粒细胞、淋巴细胞与AS 组比较明显减少(P 均<0.05),而较NS 组有所增加,AS +DEX 组细胞总数比AS+SB 组少,但其差异无统计学意义(P >0.05)。
2.3 气道组织AB-PAS 染色 结果见图2。
2.4 各组BALF 中IL-4、TNF-α 水平测定 如表2显示,AS 组、AS+DEX 组、AS+SB 组BALF 中IL-4、TNF-α 与NS 组比较均增加,其差异有统计学意义(P<0.01);AS+DEX 组和AS +SB 组BALF 中IL-4、TNF-α 水平较AS 组减少,其差异有显著统计学意义(P<0.01)。Muc5ac 阳性表达于支气管管腔内,其余肺组织未见表达。正常组、SB 组和地塞米松组Muc5ac 表达较低。
2.5 免疫组织化学法检测小鼠气道组织Muc5ac表达 结果见图3。
2.6 免疫组织化学法检测小鼠肺组织CCR3 表达结果如图4 所示,CCR3 阳性表达见于气道黏膜上皮细胞、黏膜下层平滑肌细胞及血管周围内皮细胞。CCR3 阳性表达的部位主要定位于细胞膜,细胞浆也有少量表达。NS 组在上述部位仅少量表达。哮喘组可见大量CCR3 表达,SB 组和地塞米松组表达量较哮喘组和溶剂对照组减低,但仍高于正常组。
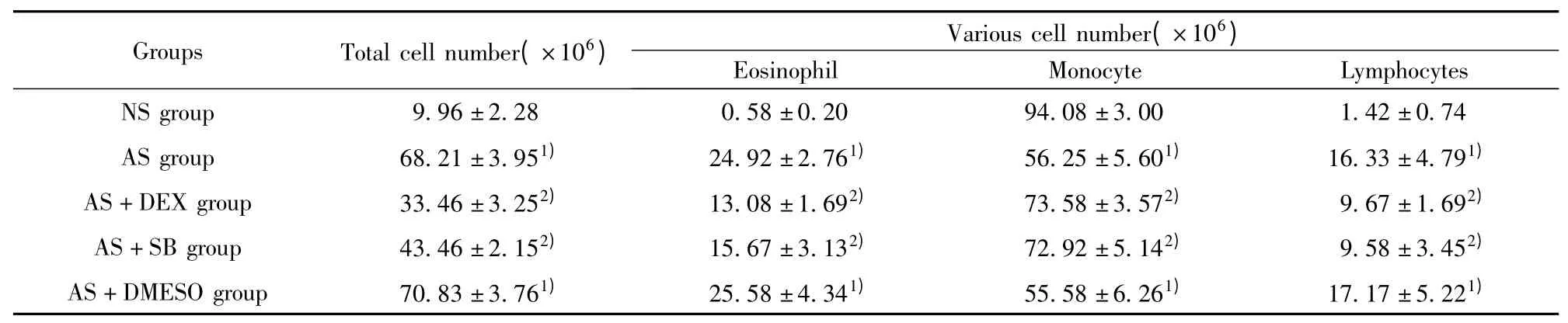
表1 各组小鼠BALF 细胞计数及白细胞分类Tab.1 BALF cell counts in each group of mice and leukocyte
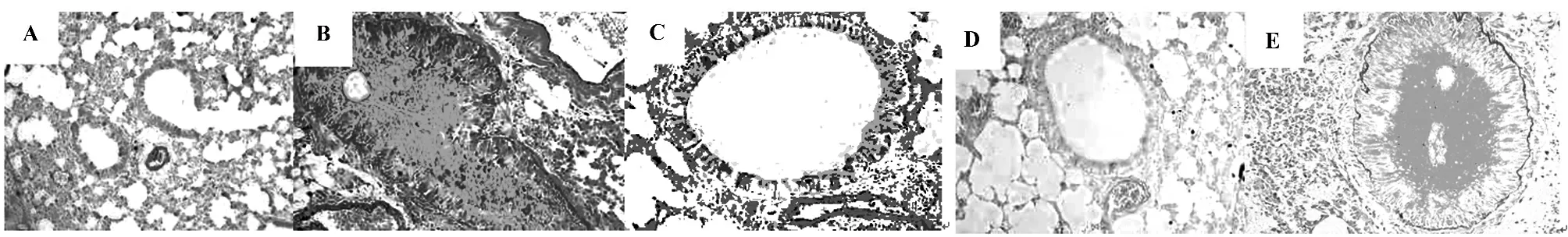
图2 各组小鼠气道组织AB-PAS 染色(AB-PAS 染色,×200)Fig.2 Airway tissues of mice in each group AB-PAS staining (AB-PAS staining,×200)

图3 免疫组织化学法检测小鼠气道组织Muc5ac 表达(免疫组化,×200)Fig.3 Immunohistochemistry assay airway tissue Muc5ac expression (Immunohistochemistry,×200)
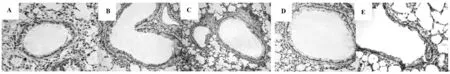
图4 免疫组织化学法检测小鼠肺组织CCR3 表达(免疫组化,×200)Fig.4 Immunohistochemical assay in mouse lung tissue CCR3 expression (immunohistochemistry,×200)
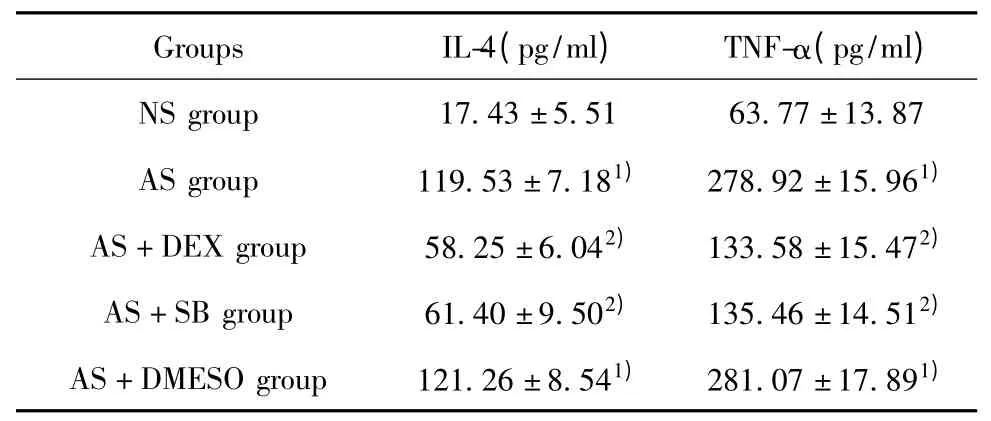
表2 各组BALF 中IL-4、TNF-α 水平测定Tab.2 BALF IL-4,TNF-α levels were measured in each group

表3 荧光定量RT-PCR 检测小鼠气道组织Muc5ac mRNA 及CCR3 mRNA 的表达Tab.3 Expression fluorescence quantitative RT-PCR to detect Muc5ac mRNA and CCR3 mRNA in airway tissue
2.7 荧光定量RT-PCR 检测小鼠气道组织Muc5ac mRNA 及CCR3 mRNA 的表达 荧光定量RT-PCR检测结果见表3:As 组、AS +DMSO 组、AS +SB 组和AS+DEX 组小鼠气道黏蛋白Mucsa mRNA 表达量较NS 组增高,其差异有统计学意义(P<0.05),AS+DEX 组和AS +SB 组表达量较AS 组降低,其差异有统计学意义(P<0.05)。
3 讨论
哮喘为遗传因素与环境因素共同导致的气道慢性炎症。嗜酸性粒细胞、肥大细胞以及淋巴细胞等多种炎性细胞都参与了气道炎症反应[2]。其中嗜酸性粒细胞是为引发支气管黏膜炎症的主要效应细胞,可导致气道黏膜损伤与气道阻塞[3]。嗜酸性粒细胞在骨髓内分化,嗜酸性粒细胞特异性趋化因子(Eotaxin)属C-C 趋化因子家族成员,通过与其唯一受体CCR3 结合后而发挥作用,能特异地聚集、趋化和激活嗜酸性粒细胞。嗜酸性粒细胞向炎症部位趋化、活化和并经脱颗粒释放炎性介质,进而导致气道慢性炎症与高反应性。因此在气道慢性炎症与高反应过程中脱颗粒释放炎症介质为重要原因[4,5]。
趋化因子受体为G 蛋白偶联蛋白,趋化因子受体分为CXCR、CCR、CR 和CX3CR。CCR3 是一个非特异性受体,主要表达于嗜酸性粒细胞上,Th2 细胞亚群、嗜碱粒细胞、肥大细胞、神经组织及气道上皮细胞均可检测到CCR3。CCR3 可与趋化嗜酸粒细胞、肥大细胞、Th2 淋巴细胞、嗜碱粒细胞结合,然后诱导到哮喘患者炎症部位,故该过程是哮喘的一个关键环节[6],其中对嗜酸性粒细胞的作用是这个关键环节的主要步骤。但对于气道高反应性的影响目前尚存在争议[7-9]。嗜酸性粒细胞脱离产物颗粒蛋白具有细胞毒作用,可经刺激嗜酸性粒细胞或者其他炎症细胞,进而导致气道炎症的发生,加重了哮喘患者的病情。
因此可看出,在气道炎症与黏液高分泌中CCR3 扮演重要角色,阻断CCR3 即可有效治疗哮喘气道炎症与抑制气道黏液高分泌。CCR3 拮抗剂可与嗜碱性粒细胞等表面的CCR3 相结合,阻断嗜酸粒细胞的趋化因子结合CCR3,进而有效避免炎症细胞向气道活化与募集。SB2328437 是一个分子量为387.4,对CCR3 有特异性选择的高分子蛋白,可有效抑制CCR3 与配体(Eotaxin-1、2、3,RANTES,MCP-2、3、4 等)结合,进而抑制对效应细胞的趋化,降低Th2 优势,并能抑制钙离子内流。新近研究表明,CCR3 拮抗剂可以抑制Eotaxin 引起Th2 细胞对小鼠肺浸润及过敏原诱导的支气管收缩。离体外周血中SB328437(C21H18N2O5)可减少释放辅助性T细胞(Th2)细胞因子[10]。
本研究显示,与正常组相比,AS 组气道炎症显著加重,在BALF 中细胞总数、嗜酸性粒细胞,IL-4和TNF-α 表达水平,气道AB-PAS 染色黏液物质阳性相对着色面积和免疫组化检测肺组织Muc5ac 和CCR3 的IOD 值,CCR3 和Muc5ac 的mRNA 表达量较NS 组明显增加。AS +SB328437 组病理学病变较AS 组明显减轻,在BALF 细胞总数、嗜酸性粒细胞和淋巴细胞均较AS 组降低(P 均<0.01),但高于NS 组(P 均<0.01),说明SB328437 可有效控制炎症细胞浸润导致的气道炎症。BALF 中IL-4,TNF-α 表达水平较AS 组明显减少(P<0.01),表明CCR3 可经IL-4、TNF-α 等细胞因子作用在气道黏液高分泌中起到重要作用。
本研究提示AS +SB328437 组在AB-PAS 气道黏液物质阳性相对着色面积和免疫组化检测肺组织Muc5ac、CCR3 的IOD 值均较AS 组明显降低(P<0.01),但高于NS 组(P<0.01)说明SB328437 能够有效抑制哮喘小鼠气道黏液物质的分泌。荧光定量RT-PCR 检测结果显示,AS +SB328437 组CCR3 和Muc5ac 的mRNA 表达量增高,但均低于AS 组(P<0.05)。基于以上研究,我们可以推导CCR3 能够介导炎症细胞向气道浸润,募集,活化IL-4、TNF-α 等细胞因子,导致气道炎症和气道黏液高分泌。SB328437 通过抑制CCR3 和炎症细胞的结合,降低IL-4、TNF-α 表达,可控制炎症细胞浸润,进而降低气道炎症与黏液高分泌,以防气道重构。
吸入糖皮质激素(ICS)已经成为哮喘的首选治疗。大部分哮喘患者选择ICS 与口服治疗,疗效良好,但对于少数糖皮质依赖性或抵抗性的哮喘患者,应找到有效药物治疗方式。而CCR3 小分子化合物拮抗剂对CCR3 有很强的选择抑制性,从而阻止嗜酸性粒细胞炎症的发生,它不同于传统的抗炎药,其不是在炎症细胞进入组织后见效,而是经调整炎症机制阻断炎症细胞进入组织,其免疫抑制副作用相对更少。这样显现出其综合优势,可将成为哮喘治疗的主要趋势。
[1]Hiroshi Nakajima,Koichi Hirose.Role of IL-23 and Th17 cells in airway inflammation in asthma[J].Immune Network,2010,10(1):1-4.
[2]Kim DY,Park BS,Hong GU,et al.Anti-inflammatory effects of the R2 peptide,an inhibitor of transglutaminase 2,in a mouse model of allergic asthma,induced by ovalbumin[J].Bri J Pharma,2011,162(1):210-225.
[3]Shin IS,Lee MY,Jeon WY,et al.EBM84 attenuates airway inflammation and mucus hypersecretion in an ovalbumin-induced murine model of asthma[J].Inter J Mol Med,2013,31(4):982-988.
[4]张 静,刘剑波.神经生长因子对哮喘小鼠肺组织γ-氨基丁酸A 受体表达的影响[J].中国免疫学杂志,2013,29(3):247-250.
[5]Xiao M,Zhu T,Wang T,et al.Hydrogen-rich saline reduces airway remodeling via inactivation of NF-κB in a murine model of asthma[J].European Rev Medical Pharmacological Sciences,2013,17(8):1033-1043.
[6]Isgro M,Bianchetti L,Marini MA,et al.The C-C motif chemokine ligands CCL5,CCL11,and CCL24 induce the migration of circulating fibrocytes from patients with severe asthma[J].Mucosal Immunol,2013,6(4):718-727.
[7]Sonar SS,Ehmke M,Marsh LM,et al.Clara cells drive eosinophil accumulation in allergic asthma[J].Eur Respir J,2012,39(2):429-438.
[8]Chu X,Wei M,Yang X,et al.Effects of an anthraquinone derivative from Rheum officinale Baill,emodin,on airway responses in a murine model of asthma[J].Food and Chemical Toxicology,2012,50(7):2368-2375.
[9]Chu X,Jiang L,Wei M,et al.Attenuation of allergic airway inflammation in a murine model of asthma by Licochalcone A[J].Immunopharmacol Immunotoxicol,2013,35(1):653-661.
[10]Wegmann M.Targeting eosinophil biology in asthma therapy[J].Am J Respir Cell Mol Biol,2011,45(4):667-674.
