C2株蓝氏贾第鞭毛虫ILP基因的克隆表达及蛋白结构分析
2015-03-17张亚粉王皓钰郝金童高红丹林志强刘阿倩雷田田王一同
张亚粉,刘 岩,王皓钰,郝金童,高红丹,林志强,刘阿倩,雷田田,王一同,余 源
C2株蓝氏贾第鞭毛虫ILP基因的克隆表达及蛋白结构分析
张亚粉,刘 岩,王皓钰,郝金童,高红丹,林志强,刘阿倩,雷田田,王一同,余 源
目的 利用大肠杆菌对C2株蓝氏贾第鞭毛虫ILP蛋白(Impact-like protein)进行克隆表达,运用生物信息学软件进行蛋白结构分析。方法 提取C2株蓝氏贾第鞭毛虫基因组DNA,PCR扩增ILP基因,构建pGM-T重组载体,挑选阳性克隆并进行序列分析;将ILP基因连入原核表达载体pET-28a(+),并转化大肠杆菌Rosetta(DE3),IPTG诱导表达。运用PSIPRED和SWISS-MODEL进行蛋白结构分析。结果 成功构建了原核表达载体pET-28a(+)-ILP,该基因全长831 bp。SDS-PAGE结果显示,目的蛋白条带出现在相对分子量约33 kD的位置,与预期相符。Western blot结果表明,大肠杆菌成功表达了重组蛋白。结论 成功克隆、表达并分析C2株蓝氏贾第鞭毛虫ILP蛋白,为蓝氏贾第鞭毛虫ILP蛋白结构与功能的研究提供了有价值的资料。
C2株蓝氏贾第鞭毛虫;克隆;表达;ILP蛋白
蓝氏贾第鞭毛虫(Giardialamblia)简称贾第虫,寄生于人和某些哺乳动物的小肠,引起贾第虫病。贾第虫具有2个细胞核和4对鞭毛,生活于厌氧或微需氧的环境中。本虫是生物进化过程中最早分化出来的真核生物之一[1-2],被称为“生物活化石”。自上世纪80年代起,国内学者已开始对本虫进行生物学实验研究[1-4]。贾第虫是真核生物进化史的早期物种,其基因组已被测序[5-7],但很多基因的功能尚不明确。蓝氏贾第鞭毛虫作为原始的真核生物,与高等真核生物相比,其基因的生物学结构与功能既有相似性又有独特性。因此,对贾第虫与高等真核生物相似基因的研究,有助于进一步了解其与高等真核生物的区别及其在生物进化中的地位。
真核生物ILP蛋白(protein impact)是一种重要的翻译调控因子,在氨基酸含量较低的情况下,能够保证基因高水平表达[8-10]。GenBank基因检索表明Morrison等在WB株蓝氏贾第鞭毛虫发现其可能具有ILP蛋白基因序列。本研究以国内C2株蓝氏贾第鞭毛虫为材料的基因克隆和表达结果表明,C2株蓝氏贾第鞭毛虫具有ILP蛋白基因序列。进而通过对该基因测序结果进行生物信息学分析,构建了ILP蛋白的高级空间结构,为进一步研究蓝氏贾第鞭毛虫ILP蛋白结构与功能的关系,以及贾第虫与高等真核生物基因功能的相似性提供了有价值的资料。
1 材料与方法
1.1 材料 C2株贾第虫由首都医科大学寄生虫学教研室提供,原核表达质粒pET-28a(+)由本实验室保存;Rosetta(DE3) 菌株由中国医学科学院北京协和医学院血液学研究所王建祥教授惠赠;组织/细胞基因组DNA提取试剂盒购自北京艾德莱生物科技有限公司;T4 DNA 连接酶、pGM-T连接试剂盒购自TAKARA公司;限制性内切酶NcoⅠ、XhoⅠ购自NEB公司;Taq DNA聚合酶、E.coliTop 10感受态细胞、Pfu DNA Polymerase、DNA Marker III、质粒小提试剂盒、琼脂糖凝胶回收试剂盒购自天根公司;Page Ruler购自Fermentas公司;His-tag标签抗体、PVDF膜购自康为世纪公司;引物由生工生物工程(上海)公司合成。
1.2 方法
1.2.1 虫体的培养 复苏用液氮保存的蓝氏贾第鞭毛虫C2株,用改良TYI-S-33培养基于37 ℃培养。48~72 h后,虫体即呈对数生长期。选取虫体生长旺盛的培养管,置4 ℃冰浴,15 min后取出,在双手掌间多次滚搓培养管,用血球计数板计数虫数,再用培养基将虫液浓度调为6×106~10×106个滋养体/mL[11]。
1.2.2 蓝氏贾第鞭毛虫基因组DNA提取 采用组织/细胞基因组DNA提取试剂盒提取蓝氏贾第鞭毛虫的基因组DNA,实验操作按说明书进行。通过紫外分光光度法鉴定基因组DNA的纯度。
1.2.3 目的基因的PCR扩增 参考GenBank报道的蓝氏贾第鞭毛虫ILP(XM 001705285)基因序列,采用Primer Premier 5软件设计特异性引物。引物中加入特异性酶切位点(下划线标示酶切位点NcoⅠ、XhoⅠ)
ILP基因上游引物序列(P1):CATGCCATGGGCATGAATGAGCAGCTAGGCGC;
ILP基因下游引物序列(P2):CCGCTCGAGCAGCCCACTACAAAAGTTTGG;
以贾第虫基因组DNA作为模板,P1、P2为引物,扩增目的序列。反应体系为50 μL:10×pfu PCR缓冲液5 μL、10 mmol/L dNTP 4 μL、模板DNA 1 μL、Pfu Taq酶0.5 μL、10 nmol/L上下游引物各2 μL。反应条件为94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,共30个循环;最后72 ℃延伸5 min。加入Taq酶0.5 μL,72 ℃延伸15 min,使扩增基因片段末端加入A尾。
1.2.4 pGM-T-ILP克隆载体的构建与序列分析 PCR产物经1.0%琼脂糖凝胶电泳,利用胶回收试剂盒进行回收,经T4 DNA连接酶催化连接pGM-T载体,转化E.coliTop10感受态细胞,并将转化菌涂于含有氨苄青霉素和X-gal及IPTG的LB平板上,37 ℃培养12 h。挑取阳性单菌落接种于5 mL LB 培养基(含100 mg/L氨苄青霉素) 的试管中, 37 ℃振荡过夜。质粒小提试剂盒提取细菌质粒,ILP基因重组载体经NcoⅠ、XhoⅠ双酶切,1%琼脂糖凝胶电泳鉴定阳性克隆,阳性克隆菌送上海生工公司测序。
1.2.5 pET-28a(+)-ILP表达载体的构建 将pET-28a(+)载体和pGM- T-ILP分别用NcoⅠ、XhoⅠ双酶切,利用胶回收试剂盒进行回收,回收产物经琼脂糖凝胶电泳估浓度后经T4连接酶催化连接,转化E.coliTop10感受态细胞。通过Kana霉素和氯霉素双抗性平板筛选阳性克隆,利用NcoⅠ、XhoⅠ双酶切进行鉴定。
1.2.6 ILP诱导表达 经双酶切鉴定正确的质粒转化Rosetta(DE3),经卡那霉素和氯霉素双抗平板筛选阳性单菌落并扩大培养,加入不同终浓度(0.5~2.0 mmol/L)的异丙基-β-D-硫代半乳糖苷(IPTG)诱导表达2~4 h。离心收集菌体、超声裂解后离心收集上清,取40 μL进行SDS-PAGE,检测目的蛋白表达。
1.2.7 Western blot鉴定重组蛋白表达 离心收集菌体、超声裂解后离心,取上清40 μL进行SDS-PAGE,300 mA转印PVDF膜0.5 h,抗His-Tag鼠源多克隆抗体作为一抗,兔抗鼠IgG抗体作为二抗进行Western blot鉴定。
1.2.8 ILP蛋白生物信息学分析 利用SWISS-MODEL (http://swissmodel.expasy.org/)和PSIPRED蛋白序列分析服务器对C2蓝氏贾第鞭毛虫ILP(XM 001705285)进行序列分析,构建ILP蛋白模型,预测其高级空间结构。
2 结 果
2.1 pGM-T-ILP克隆载体的构建 PCR扩增蓝氏贾第鞭毛虫ILP基因,1.0%琼脂糖凝胶电泳结果显示,在831 bp附近有明显条带,与预期大小相符(图1)。ILP基因重组载体经NcoⅠ、XhoⅠ双酶切,1%琼脂糖凝胶电泳,可见831 bp的ILP目的基因片段及3 037 bp的pGM-T载体电泳条带(图2)。

M: DNA marker; 1: ILP PCR product.
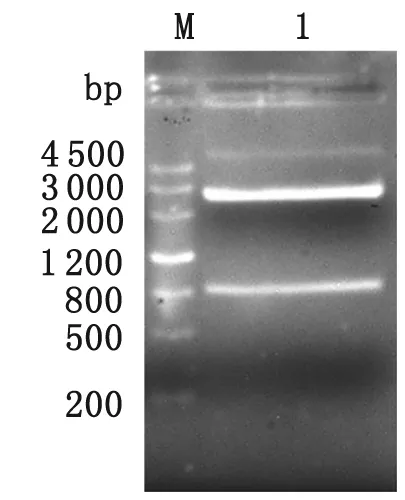
M: DNA marker; 1: pGM-T-ILP digested byNcoⅠandXhoⅠ.
图2 pGM-T-ILP重组载体NcoⅠandXhoⅠ双酶切鉴定
Fig.2 Restriction enzymes analysis of recombinant plasmid pGM-T-ILP
2.2 pET28a(+)-ILP表达载体的构建 经NcoⅠ、XhoⅠ双酶切pET28a(+)-ILP重组载体,电泳可见831 bp的ILP基因目的片段及5 369 bp的载体pET28a(+)两条电泳条带(图3)。
2.3 ILP蛋白的诱导表达鉴定 将构建好的重组质粒转化到Rosetta(DE3)中表达,菌液分别加入不同终浓度IPTG(0.5、1.0、1.5、2.0 mmol/L),未加IPTG诱导的转化菌作为阴性对照,SDS-PAGE电泳结果显示,在33 kD处出现目的条带,与预期结果一致。IPTG终浓度为1.0 mmol/L诱导4 h,ILP表达量最高(图4)。Western blot鉴定结果表明,在33 kD处出现重组蛋白(图5)。
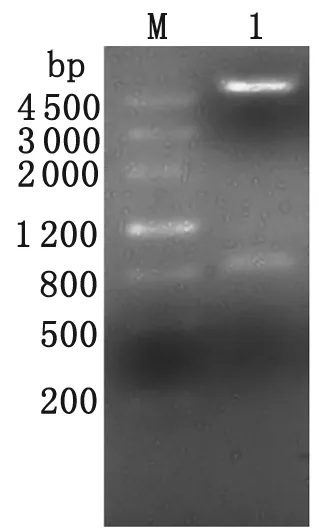
M: DNA marker; 1: pET28a(+)-ILP digested byNcoⅠandXhoⅠ
图3 pET28a(+)-ILP重组载体NcoⅠandXhoⅠ双酶切鉴定
Fig.3 Restriction enzymes analysis of recombinant plasmid pET28a(+)-ILP

M: PAGE ruler; 1-4: induced with 0.5-2.0 mmol/L IPTG for 2 h; 5-8: induced for 4 h; 9: without IPTG.
图4 不同时间、不同浓度IPTG诱导ILP蛋白表达SDS-PAGE电泳
Fig.4 SDS-PAGE analysis of the ILP protein expressed in Rosetta (DE3)
2.4 ILP蛋白生物信息学分析数据 PSIPRED蛋白序列分析结果显示,ILP蛋白全长序列主要包含6个α螺旋和7个β折叠,其余部分以无规则卷曲为主(图6)。
将ILP蛋白氨基酸序列提交至SWISS-MODEL建模服务系统,选择NMR作为建模方法,结果显示ILP蛋白与GCN2 eIF2 alpha kinase N端结构域同源性为17.7%,能够预测出ILP蛋白部分空间结构,包含3个β折叠和3个α螺旋,推测此结构可能与抑制GCN2蛋白激酶的活性相关(图7)。

M: PAGE ruler; 1: induced with 1.0 mmol/L IPTG for 4 h.
图5 ILP蛋白Western blot分析
Fig.5 Western blot analysis of the ILP protein
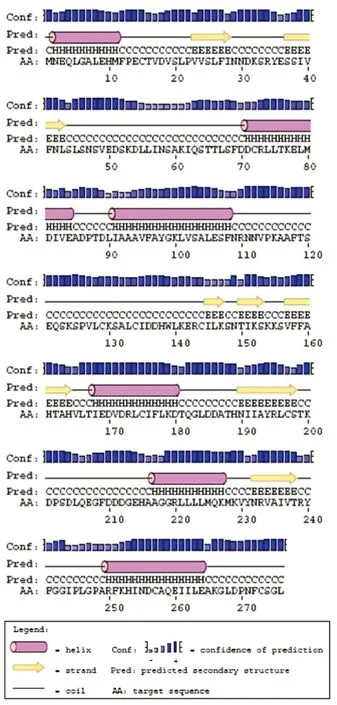
图6 PSIPRED分析ILP蛋白的二级结构
Fig.6 Secondary structure ofGiardialambliaILP protein with PSIPRED

图7 SWISS-MODEL模拟贾第虫ILP蛋白三维模型
Fig.7GiardialambliaILP structure predicted by SWISS-MODEL
3 讨 论
本研究参考GenBank报道的WB株蓝氏贾第鞭毛虫ILP(XM 001705285)基因序列设计引物,利用原核表达技术对C2株蓝氏贾第鞭毛虫ILP蛋白进行克隆表达,结果表明C2株蓝氏贾第鞭毛虫具有ILP基因序列。本研究中使用的大肠杆菌Rosetta(DE3)是BL21的改良菌种,能够补充BL21缺乏的6种稀有密码子所对应的tRNA,提高重组质粒的表达效果[12]。本研究中使用的pET28a(+)载体是原核表达中最常用的载体之一,克隆到pET28a(+)载体上的目的基因受噬菌体T7强转录及翻译信号控制,不被宿主细胞RNA聚合酶识别。无IPTG诱导剂时,克隆到pET28a(+)载体的基因实际上是被关闭的,因此不会由于表达的蛋白有毒性而引起质粒不稳定。加入IPTG诱导剂能够诱导表达T7 RNA聚合酶,启动重组蛋白表达,增加实验结果的可靠性[13]。此外,pET28a(+)载体自带His标签,Western blot检测重组蛋白表达时能够利用His标签作为重组蛋白表达的信号。
为了进一步了解C2株蓝氏贾第鞭毛虫ILP蛋白的结构与功能,本研究利用SWISS-MODEL和PSIPRED蛋白序列分析服务器对C2蓝氏贾第鞭毛虫ILP蛋白进行分析,构建ILP蛋白模型。SWISS-MODEL是日内瓦生物医学研究所(Geneva Biomedical Research Institute)建立发展起来的分子建模服务系统(Molecular Modeling Server)。基于同源建模的原理,SWISS-MODEL从布鲁克海文蛋白质结构数据库(Brookhaven PDB)中提取蛋白质查询序列的模拟结构信息,用已知结构蛋白建立未知结构蛋白的分子模型[14-15]。由于SWISS-MODEL是基于已知生物大分子结构基础上的分子建模系统,需要庞大的分子建模基础数据库才能建立正确的结构模型,有限的数据资源使得该方法具有一定的局限性。为了弥补SWISS-MODEL服务器的不足,获得ILP蛋白更多的结构信息,本研究同时采用能够根据氨基酸排列顺序预测蛋白全长二级结构的PSIPRED服务器分析ILP蛋白二级结构,结果表明ILP蛋白全长序列主要包含6个α螺旋和7个β折叠,其余部分以无规则卷曲为主,与GCN2 eIF2 alpha kinase N端结构域区域具有一定的同源性,同源区域包含3个β折叠和3个α螺旋。
本研究通过SWISS-MODEL和PSIPRED蛋白序列分析服务器成功预测出ILP蛋白与GCN2 eIF2 alpha kinase N端结构域具有一定的同源性,推测其功能可能与抑制GCN2蛋白激酶的活性相关。有研究表明ILP蛋白作为翻译调控因子,能够与GCN1/GCN1L1相互作用,抑制GCN2蛋白激酶的活性,阻止ATF4的合成,在氨基酸含量较低的情况下保证基因高水平表达[16],但是ILP蛋白发挥其调控功能的具体机制尚不明确,此外,抑制ILP蛋白表达可能导致蓝氏贾第鞭毛虫基因表达受阻,降低蓝氏贾第鞭毛虫的生长繁殖速度,对蓝氏贾第鞭毛虫的防治可能会起到一定的效果,今后的工作应围绕这些问题进一步研究。总之,本研究为进一步明确蓝氏贾第鞭毛虫ILP蛋白的结构与功能,贾第虫与高等真核生物基因功能的相似性,以及蓝氏贾第鞭毛虫的防治提供了新思路。
[1]Lu SQ. Domestic research ofGiardialamblia[J]. Acta Parasitologica Et Medica Entomologica Sinica, 1999, 6(4): 193-200. (in Chinese) 卢思奇.国内蓝氏贾第鞭毛虫研究[J].寄生虫与医学昆虫报,1999,6(4):193-200.
[2]Tian XF, Lu SQ. Cytoskeleton ofGiardialamblia[J]. World Chin J Digestol, 2005, 13(12): 1434-1436. (in Chinese) 田喜凤,卢思奇.蓝氏贾第鞭毛虫的细胞骨架[J].世界华人消化杂志, 2005, 13(12): 1434-1436.
[3]Adam RD. Biology ofGiardialamblia[J]. Clin Microbiol Rev, 2001, 14(3): 447-475.
[4]Sandhu H, Mahajan RC, Ganguly NK. Flow cytometric assessment of the effect of drugs onGiardialambliatrophozoites in vitro[J]. Mol Cell Biochem, 2004, 265: 151-160.
[5]Gardner TB, Hill DR. Treatment of giardiasis[J]. Clin Microbiol Rev, 2001, 14(1): 114-128. DOI: 10.1128/CMR.14.1.114-128.2001
[6]Ali SA, Hill DR. Giardia intestinalis[J]. Curr Opin Infect Dis, 2003, 16(5): 453-460.
[7]Triana O, Galanti N, Olea N, et al. Chromatin and histones fromGiardialamblia: A new puzzle in primitive eukaryotes[J]. J Cellular Biochem, 2001, 82(4): 573-582. DOI: 10.1002/jcb.1159/full
[8]Okamura K, Hagiwara-Takeuchi Y, Li T, et al. Comparative genome analysis of the mouse imprinted gene impact and its nonimprinted human homolog IMPACT: toward the structural basis for species-specific imprinting[J]. Genome Res, 2000, 10(12): 1878-1889. DOI: 10.1101/gr.139200
[9]Gerhard DS, Wagner L, Feingold EA. The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC)[J]. Genome Res,2004, 14 (10B): 2121-2127. DOI: 10.1101/gr.2596504
[10]Ota T, Suzuki Y, Nishikawa T, et al. Complete sequencing and characterization of 21,243 full-length human cDNAs[J]. Nat Genet, 2004, 36(1): 40-45. DOI: 10.1038/ng1285
[11]He B, Liu GW, Cao L, et al.Invitroidentification of the cytoskeleton proteins ofGiardialambliausing a MS technique[J]. J Pathog Biol, 2010, 5(12): 898-900. (in Chinese) 何冰,刘广伟,曹蕾,等.质谱技术鉴定体外蓝氏贾第鞭毛虫的细胞骨架蛋白[J].中国病原生物学杂志,2010,5(12):898-900.
[12]Wang YH, Zheng GX, Ju HM, et al. Cloning and expression of H2A gene fromGiardialamblia[J]. J Trop Med, 2011, 11(10): 1107-1110. (in Chinese) 王云华,郑国侠,巨红妹,等.蓝氏贾第鞭毛虫中国株组蛋白H2A基因的克隆与重组表达[J].热带医学杂志,2011,11(10):1107-1110.
[13]Wang Y, Yu Y, Wang WL, et al. Prokaryotic expression and purification of α-4 giardin ofGiardialamblia[J]. Chin J Zoonoses, 2011, 27(6): 465-469.(in Chinese) 王洋,余源,王卫亮,等. 蓝氏贾第鞭毛虫α-4 贾第素的原核表达及纯[J].中国人兽共患病学报,2011,27(6): 465-469.)
[14]Xia XY, Wu QY, An LM et al. A novel P20R mutation in the alpha-B crystallin gene causes autosomal dominant congenital posterior polar cataracts in a Chinese family[J]. BMC Ophthalmol, 2014, 14(1): 108-111. DOI: 10.1186/1471-2415-14-108
[15]Kumar A, Pillay B, Olaniran AO. Two structurally different dienelactone hydrolases (TfdEI and TfdEII) from Cupriavidus necator JMP134 plasmid pJP4 catalyse cis- and trans-dienelactones with similar efficiency[J]. PLoS One, 2014, 9(7): 104-109.
[16]Habibi D, Jalili RB, Forouzandeh F, et al. High expression of IMPACT protein promotes resistance to indoleamine 2, 3-dioxygenase-induced cell death[J]. J Cell Physiol, 2010, 225(1): 196-205. DOI: 10.1002/jcp.22220
Cloning, expression and protein structural analysis of ILP gene from C2Giardialamblia
ZHANG Ya-fen,LIU Yan,WANG Hao-yu,HAO Jin-tong,GAO Hong-dan,LIN Zhi-qiang,LIU A-qian,LEI Tian-tian,WANG Yi-tong,YU Yuan
(CollegeofLifeScience,NorthChinaUniversityofScienceandTechnology,Tangshan063000,China)
The aim of this study is to clone, express and analyze ILP (Impact-like protein) gene from C2Giardialamblia. Genome DNA of C2Giardialambliawas extracted with DNA extraction kit. Specific primers were designed by primer design software Primer Premier 5. ILP gene was amplified by PCR and cloned into pGM-T vector, and transformed intoE.coli(Top10) competent bacteria cells. Positive clone was chosen and the sequence was analyzed. The pGM-T-ILP recombinant vector was digested by restriction endonucleaseNcoⅠandXhoⅠ. Target gene was restructured into pET28a(+) vector at theNcoⅠandXhoⅠrestriction sites to generate recombinant expression vector pET28a(+)-ILP. The vector was transformed intoE.coliRosetta (DE3) and induced with IPTG (isopropyl β-D-thiogalactopyranoside). SDS-PAGE result showed the objective protein band in the position of the relative molecular weight was 33 kDa. Western blot analysis with His-Tag antibody indicated that the ILP gene was successfully expressed in the prokaryotic Rosetta (DE3). Our results provided valuable experimental data for further understanding the structure and function of ILP gene.
C2Giardialamblia; clone; expression; ILP gene
Yu Yuan, Email: yuyuan5188@163.com
国家自然科学基金(No. 31471954),唐山市科技支持计划项目(No.12140209A-33),河北青年科学基金(No. C2012401039)联合资助,河北联合大学培养基金(No. GP201308)
余源,Email:yuyuan5188@163.com
华北理工大学生命科学学院,唐山 063000
10.3969/cjz.j.issn.1002-2694.2015.07.005
R382.2
A
1002-2694(2015)07-0618-05
2014-09-30;
2015-05-05

Supported by the National Natural Science Foundation of China (No. 31471954), the Scientific and Technological Support Projects from Tangshan (No. 12140209A-33), the Youth Science Fund Project in Hebei Province (No. C2012401039), and the Hebei United University Training Fund (No. GP201308)
