表没食子儿茶素没食子酸酯对血管紧张素Ⅱ诱导的心肌细胞肥大的抑制作用*
2015-03-16四川省达州市中心医院消化内科635000重庆三峡医药高等专科学校基础医学部重庆4040
王 晓,陈 华(.四川省达州市中心医院消化内科 635000;.重庆三峡医药高等专科学校 基础医学部,重庆 4040)
·论 著·
表没食子儿茶素没食子酸酯对血管紧张素Ⅱ诱导的心肌细胞肥大的抑制作用*
王 晓1,陈 华2(1.四川省达州市中心医院消化内科 635000;2.重庆三峡医药高等专科学校 基础医学部,重庆 404202)
目的 探讨表没食子儿茶素没食子酸酯(EGCG)对血管紧张素Ⅱ(AngⅡ)诱导的心肌细胞肥大的抑制作用及其可能的作用机制。方法 利用原代培养的新生大鼠心肌AngⅡ(0.1 μmol/L)诱导制备心肌细胞肥大模型,检测EGCG(0.5、1.0、2.0 μmol/L)干预后,心肌细胞培养上清液一氧化氮(NO)浓度和一氧化氮合酶 (NOS)及Ca2+-ATP酶活性,同时检测心肌细胞钙调神经磷酸酶(CaN) mRNA的表达和钙调神经磷酸酶α-亚基(CnA)蛋白的表达情况。结果 对照组的AngⅡ使心肌细胞发生明显肥大,细胞内NOS和Ca2+-ATP酶活性下降,而CaN mRNA和CnA蛋白表达增加,差异有统计学意义(P<0.05);EGCG不同剂量组均明显减轻AngⅡ诱导的心肌细胞肥大程度,增加NOS和Ca2+-ATP酶活性,促进NO释放,下调CaN mRNA和减少CnA蛋白表达,差异有统计学意义(P<0.05)。结论 EGCG抑制AngⅡ诱导的心肌细胞肥大作用机制可能与EGCG增加NO释放,升高NOS和Ca2+-ATP酶活性,抑制CaN信号转导通路及降低CnA蛋白表达有关。
表没食子儿茶素没食子酸酯; 心肌细胞肥大; Ca2+-ATP酶; 一氧化氮合酶; 钙调神经磷酸酶
心脏肥大的形成是由于高血压、慢性心功能不全等多因素长期刺激发生的复杂病理过程,这期间心肌细胞和间质部分均发生明显变化,内皮缩血管肽和血管紧张素Ⅱ(AngⅡ)等因子刺激导致心肌细胞蛋白合成和体积增加,最终导致心肌重构[1]。AngⅡ是体液调节系统肾素-血管紧张素-醛固酮系统(RAAS)主要活性物质之一,其作用于心肌胞膜AT1激活多种信号级联反应,激活心肌发生增厚、重构[2]。心肌肥大己被列为心血管发病率和病死率的独立危险因素,对其发病机制和防治的研究一直是该领域的研究热点,但临床防治药物都有一定不良反应而影响临床治疗目标。流行病学研究显示黄酮类可以减少心脏疾病的病死率。绿茶中茶多酚重要的组分主要含4个单体,即表没食子儿茶素没食子酸酯(EGCG)、表儿茶素没食子酸酯(ECG)、表没食子儿茶素(EGC)和表儿茶素(EC),其中EGCG占苯多酚的30%~35%。研究表明EGCG具有抗氧化、抗炎等作用,对神经细胞损伤、糖尿病大鼠肾脏及大鼠酒精性肝损伤都具有一定的保护作用[3]。此外,EGCG能够抑制大鼠心肌肥厚胶原生成和细胞增殖,其作用机制可能与其抗氧化作用有关[4]。近年来研究证实EGCG具有抗氧化、多靶点保护心肌等功能,对心肌肥大具有潜在的防治作用[5]。本实验用AngⅡ诱导原代乳鼠心肌细胞建立心肌细胞肥大模型,通过检测心肌细胞一氧化氮(NO)、一氧化氮合酶(NOS)、Ca2+-ATP酶、钙调神经磷酸酶(CaN)和钙调神经磷酸酶α-亚基(CnA)的变化情况,探讨EGCG用于抗心肌细胞肥大的作用机制,为EGCG用于预防心血管系统疾病提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 动物 清洁级SD大鼠种鼠75只,出生1~2 d清洁级SD大鼠,重庆医科大学动物实验中心,许可证号:SYXK(渝) 20022007。
1.1.2 仪器与试剂 仪器采用Real-Time PCR扩增仪 (美国BIO-RAD公司),凝胶成像仪Mini Trans-Bloe电泳仪(美国BIO-RAD公司),电转仪(美国BIO-RAD公司),Leica光学显微镜(德国Leica Microsystems Ltd公司)。试剂采用EGCG、胎牛血清、胰酶、抗β-actin抗体、逆转录试剂盒(重庆市卓诺生物技术有限公司),AngⅡ、CnA小鼠抗大鼠单克隆抗体(Sigma公司),DMEM培养基GIBCO产品,NO测定试剂盒(江苏碧云天生物技术研究所),NOS测定试剂盒、Ca2+-ATP酶测定试剂盒(南京建成生物工程研究所)、SYBR®GREEN PCR Master Mix(Applied Bio-system公司),内参GAPDH、CaN、NOS引物(上海吉凯基因化学技术有限公司),辣根过氧化物酶(HRP)标记山羊抗小鼠IgG(H+L)(北京中杉金桥生物技术公司)。
1.2 方法
1.2.1 实验分组 50只大鼠随机分组为对照组,模型组(AngⅡ+0.1 μmol/L EGCG),EGCG低剂量(AngⅡ+0.5 μmol/L EGCG)组,EGCG中剂量(AngⅡ+1.0 μmol/L EGCG)组;EGCG高剂量(AngⅡ+2.0 μmol/L EGCG)组。EGCG粉剂用二甲基亚砜溶解后DMEM稀释,配置成浓度为0.5、1.0、2.0 μmol/L标准液备用。换无血清培养液24 h后加入0.1 μmol/L AngⅡ或0.1 μmol/L AngⅡ加上述不同剂量EGCG,置于37 ℃、5% CO2培养箱中培养8 h后检测。HE染色观察发现AngⅡ组心肌细胞体积明显增大,细胞肿胀,分界不清;AngⅡ合用EGCG组细胞明显缩小,肿胀程度减轻。
1.2.2 乳鼠心肌细胞制备 取新生1~2 d SD乳鼠心室肌切碎加入0.25%胰蛋白酶消化,D-Hank′s液混悬后用不锈钢筛过滤,加入胎牛血清终止消化、离心,弃上清液,用培养基重悬后收集心肌细胞接种于25 mL培养瓶,置于37 ℃、5% CO2细胞培养箱培养(1 h后加入0.1 mm 5′-溴-2-脱氧尿嘧啶核苷),免疫组化鉴定细胞。
1.2.3 细胞上清液NO浓度、NOS活性的测定 取上清液作心肌细胞NO、NOS活性测定。其中一部分1 000 r/min离心5 min后收集上清液,-20 ℃保存,供NO测定;其余3 000 r/min离心10 min同法收集上清液,检测NOS活性。NO和NOS均采用比色法测定,严格按试剂盒说明书要求操作。取540 nm波长测定NO2-与Griess试剂反应生成樱红色的吸光度值,根据标准曲线计算出每孔NO水平。在530 nm波长下测定的吸光度,代表NOS活性,根据吸光度的大小计算出NOS活力。
1.2.4 Ca2+-ATP酶活性测定 将培养好的心肌细胞,用无菌PBS(pH7.35~7.45)漂洗3次,给药8 h后,胰酶消化细胞,胎牛血清培养基中和胰酶,生理盐水稀释后离心20 min(3 000 r/min),弃尽上清液后破碎细胞酶促反应测定磷,根据标准曲线计算酶活性。严格按照试剂盒说明书所述方法进行操作。
1.2.5 实时反转录聚合酶链反应(RT-PCR)实验检测CaN基因表达 采用实时RT-PCR检测细胞内CaN基因的表达。从GeneBank中查出大鼠CaN基因的mRNA序列,利用美国PE公司引物设计软件Primer Express设计转移性引物,由上海吉凯基因公司合成。引物序列见表1。取1×106心肌细胞,根据Trizol试剂盒说明书操作提取总RNA,用紫外分光光度仪检测RNA纯度。采用反转录酶制备cDNA(PrimeScriptTMBuffer 4.0 μL,PrimeScriptTMRT Enzyme Mix1.0 μL,OligodT Primer 1.0 μL,Random 6 mers 1.0 μL,Total RNA 1 μL)。按SYBR®GREEN PCR Master Mix条件进行扩增。见表1。

表1 实时PCR的引物序列
1.2.6 Western-blot检测心肌细胞中CnA蛋白质的表达水平 细胞经药物处理,胰酶消化,预冷的PBS洗3次,加入裂解缓冲液100 μL,超声破碎细胞膜,15 000 r/min离心20 min,提取上清液蛋白质,考马斯亮蓝法测定样品蛋白水平。灌制10%聚乙酰胺凝胶,常规电泳,转膜,封闭。一抗CnA小鼠抗大鼠单克隆抗体(1∶1 500)4 ℃孵育过夜,加入辣根酶标记二抗(1∶3 000)室温孵育2 h,ECL显色。GAPDH作为内参对照,进行细胞间蛋白表达比较。
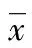
2 结 果
2.1 心肌细胞NO浓度和NOS活性的变化 与对照组比较,模型组NO的浓度和NOS的活性明显降低(P<0.05)。与模型组比较,EGCG加药组(0.5、1.0、2.0 μmol/L)上述指标均增加,EGCG各剂量组组间差异无统计学意义(P>0.05)。见表2。
2.2 AngⅡ诱导的肥大心肌细胞内Ca2+-ATP酶和CaN mRNA表达的变化 与对照组比较,模型组Ca2+-ATP酶活性明显降低,不同剂量EGCG均能使Ca2+-ATP酶活性较模型组明显升高(P<0.05)。同样EGCG各剂量组组间差异无统计学意义(P>0.05)。实时RT-PCR检测结果显示,与对照组比较,AngⅡ明显上调CaN mRNA的表达,EGCG各剂量组明显抑制AngⅡ所致CaN mRNA表达的增加。见表3。
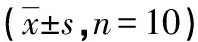
表2 EGCG对AngⅡ诱导肥大心肌细胞NO和NOS
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。

图1 EGCG对AngⅡ诱导的肥大心肌细胞中CnA
2.3 AngⅡ诱导的肥大心肌细胞中CnA蛋白表达的影响 结果表明,与对照组比较,模型组明显增加了心肌细胞CnA蛋白表达;与模型组比较,EGCG各剂量组均可以降低AngⅡ诱导心肌细胞的CnA蛋白表达量。见图1。
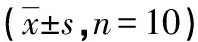
表3 EGCG对AngⅡ诱导的肥大心肌细胞中Ca2+-ATP酶
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
3 讨 论
心肌肥厚是各种因素引起心肌工作超负荷的一种适应性反应,心肌细胞肥大是心肌肥厚病理生理学变化的重要基础,内皮素-1、儿茶酚胺和体液因子AngⅡ是致心肌肥厚的重要因素。AngⅡ是经典的心肌细胞肥大的诱导剂,其诱导的心肌细胞肥大反应是心血管科研常用造模方法之一,AngⅡ诱导并参与心肌细胞的整个病理过程。AngⅡ诱导培养的心肌细胞肥大包括多条胞内信号途径及细胞直径和蛋白质合成增加等表型改变[2-6]。
本实验应用AngⅡ诱导心肌细胞的方法建立了大鼠心肌细胞肥大模型,实验心肌细胞模型出现明显心肌细胞体积增加、细胞肿胀等病理学改变形态变化;与模型组比较,EGCG不同剂量组均能抑制心肌细胞的肥大,细胞明显缩小,肿胀程度减轻。
实验模型组幼鼠心肌细胞NOS活性和NO浓度均降低,在培养的新生大鼠心肌细胞中血管紧张素通过其受体及G蛋白耦联受体,一方面引起心肌细胞肥大;另一方面抑制一氧化氮合酶活性和NO生成。在心肌肥厚的发生和发展过程中,除了致心肌肥厚的因素外,机体必然有一些防止心肌肥厚发生和发展的因子,内皮舒张因子NO是重要的候选因子之一,内源性NO可通过依赖机制减轻压力超负荷引起的心肌肥厚[7]。EGCG抑制AngⅡ诱导的细胞肥大同时明显升高NOS活性并增加心肌细胞上清液NO浓度,而心脏中NO浓度升高除可引起冠脉舒张、冠脉血流量增加和心肌收缩力下降外,在防止心肌肥厚反应中也起重要作用[8-9]。
心肌肥厚常伴有肌浆网钙泵活性降低、钙离子紊乱,心肌肌浆网Ca2+-ATP酶通过摄取和释放Ca2+在心脏的舒缩活动中发挥着重要作用[10]。实验结果显示,与对照组比较,AngⅡ诱导幼鼠心肌细胞Ca2+-ATP酶活性明显下降(P<0.05),Ca2+-ATP酶活性的降低可引起钙循环紊乱,钙超载是形成心肌肥厚的主要机制之一,也是心肌舒缩功能障碍的重要病理生理机制。CaN是目前发现的唯一受钙调素调节的丝苏氨酸蛋白磷酸酶,心肌细胞内Ca2+水平增加可激活Ca2+敏感的CaN,近年研究发现CaN在心肌肥厚的发生中发挥重要作用,抑制活性可预防心肌肥厚的发生[11]。检测结果显示EGCG不同剂量组Ca2+-ATP酶活性比对照组明显升高(P<0.05),CaN表达量反之(P<0.05)。这一结果意味着EGCG对Ca2+-ATP酶活性和CaN表达量的调节作用可能也是EGCG抗心肌细胞肥厚的机制之一。
此外,钙调素结合可诱发CnA构象改变,暴露其磷酸酶活性位点,活化的CnA激活多种心肌肥大相关基因,同时诱导原癌基因表达,使心肌胚胎化,导致心肌细胞体积增大,蛋白核酸合成增加,发生心肌重构[12]。实验结果显示EGCG各剂量组均能不同程度降低AngⅡ诱导的心肌CnA表达,抑制CaN信号通路,表明其抗心肌细胞肥大作用可能与EGCG抑制CaN信号通路有关。
综上所述,EGCG对AngⅡ诱导的心肌细胞肥大抑制的作用与EGCG促进NO的释放,调节Ca2+-ATP酶和CaN mRNA表达的增加,降低CnA蛋白表达有关。
[1]Mosterd A,Hoes AW,Bruyne MC,et al.Prevalence of heart failure and left ventricular dysfunction in the general population:the rotterdam study[J].Eur Heart J,1999,20(1):447-455.
[2]Nakagami H,Takemoto M,Liao JK,et al.NADPH oxidase-derived superoxide anion mediates angiotensin II-induced cardiac hypertrophy[J].J Mol Cell Cardiol,2003,35(7):851-859.
[3]葛斌,谢梅林,顾正伦.表没食子儿茶素没食子酸酯对大鼠高脂性脂肪肝的治疗作用及其机制研究[J].中国药理学通报,2009,25(4),510-514.
[4]盛瑞,顾振纶,谢梅林.EGCG抑制心肌肥厚胶原生成和细胞增殖[J].中国药理学通报,2006,22(9):1095-1099.
[5]崔文明,毛伟峰,杜海方.茶多酚和表没食子儿茶素没食子酸酯对血管紧张素Ⅱ诱导的心肌肥大的抑制作用[J].2008,33(3):356-359.
[6]Clerk A,Cullingford TE,Fuller SJ,et al.Signaling pathways mediating cardiac myocyte gene expression in physiological and stress responses[J].Cell Physiol,2007,212(2):311-322.
[7]Hunyady L,Turu G.The role of the AT1 angiotensin receptor in cardiac hypertrophy:angiotensin II receptor or stretch sensor[J].Trends Endocrinol Metab,2004,15(9):405-408.
[8]Massion PB,Balligand JL.Modulation of cardiac contraction,relaxation and rate by the endothelial nitric oxide synthase (eNOS):lessons from genetically modified mice[J].J Physiol,2003,546(1):63-75.
[9]Ozaki M,Kawashima S,Yamashita T,et al.Overexpression of endothelial nitric oxide synthase attenuates cardiac hypertrophy induced by chronic isoproterenol infusion[J].Circ J,2002,66(9):851-856.
[10]黄志明,梁钢,许盈.EGCG对肾缺血再灌注时细胞凋亡的影响[J].广西医科大学学报,2002,19(4):496-498.
[11]Clint L,Cai Y,Masayoshi O,et al.Role of Ca2+/calmodulin-stimulated cyclic nucleotide phosphodiesterase 1 in mediating cardiomyocyte hypertrophy[J].Circ Res,2009,105(10):956-964.
[12]Rinne A,Kapur N,Molkentin JD,et al.Isoform-and tissue-specific regulation of the Ca2+-sensitive transcription factor NFAT in cardiac myocytes and in heart failure[J].Am J Physiol Heart Circ Physiol,2010,298(6):2001-2009.
Inhibitory effect of EGCG on cardiomyocyte hypertrophy induced by angiotensinⅡ*
WANGXiao1,CHENHua2
(1.DepartmentofGastroenterology,DazhouMunicipalCentralHospital,Dazhou,Sichuan635000,China;2.DepartmentofBasicMedicine,ThreeGorgesMedicalCollege,Chongqing404202,China)
Objective To investigate the inhibitory effect of epigallocatechin gallate(EGCG) on cardiomyocyte hypertrophy induced by angiotensinⅡ(AngⅡ) and its potential mechanisms.Methods The primarily cultured cardiomyocyte AngⅡ(0.1 μmol/L) from sprague dawley neonatal rats was adopted to induce and prepare the cardiomyocyte hypertrophy model.The nitric oxide (NO) content,activity of nitric oxide synthetase (NOS) and Ca2+-ATPase activity in the supernatant fluid of cardiomyocytes culture after EGCG (0.5,1.0,2.0 μmol/L) intervention were measured.Meanwhile the mRNA expressions of calcineurin (CaN) in cardiomycytes were detected by real time reverse transcription-polymerase chain reaction (RT-PCR).The protein expression of calcineurin catalytic subunit (CnA) was detected by Western blot.Results AngⅡ in the blank control group induced significant cardiomyocytes hypertrophy,intracellular NOS and Ca2+-ATPase activity decrease,while CnA protein content and CaN mRNA expression increase(P<0.05),different doses of EGCG significantly alleviated AngⅡ-induced cardiomyocyte hypertrophic degree,increased the activity of NOS and Ca2+-ATPase,promoted the NO release,but down-regulated CaN mRNA and decreased CnA protein expression(P<0.05).Conclusion The mechanism of EGCG inhibiting Ang Ⅱ induced cardiomyocyte hypertrophy could be related with EGCG increasing NO release,elevating NOS and Ca2+-ATPase activity,inhibiting CaN signal transduction pathway and decreasing CnA protein expression.
EGCG; cardiomyocyte hypertrophy; Ca2+-ATP; NOS; CaN
重庆市基础与前沿研究计划项目(cstc2014jcyjA10049);重庆市卫生和计划生育委员会医学科研项目(20121096)。
王晓,男,主治医师,本科,主要从事消化内科方面的临床工作。
10.3969/j.issn.1672-9455.2015.16.012
A
1672-9455(2015)16-2328-03
2015-02-28
2015-04-15)
