0.1%玻璃酸钠滴眼液的抑菌效力研究
2015-03-15夏晓君董爱梅张建强
夏晓君,董爱梅,张建强
(1.解放军第107医院,山东烟台264002;2.山东省药学科学院,山东济南250101;3.山东省皮肤和黏膜给药技术重点实验室,山东济南250101)
0.1%玻璃酸钠滴眼液的抑菌效力研究
夏晓君1,董爱梅2,张建强3
(1.解放军第107医院,山东烟台264002;2.山东省药学科学院,山东济南250101;3.山东省皮肤和黏膜给药技术重点实验室,山东济南250101)
目的探索0.1%玻璃酸钠滴眼液中抑菌剂的合理添加剂量。方法根据药物成分的特性,选择适宜的抑菌剂,并对不同配比浓度抑菌剂的抑菌效果进行初步考察,筛选出适宜的供试品抑菌剂加入量。将《中国药典》规定的微生物加入供试品中进行挑战试验,测试微生物在不同时间段的存活情况。结果0.005%的苯扎氯铵对5种挑战微生物的生长有良好的抑制作用,且为最低有效剂量。结论0.005%的苯扎氯铵可作为0.1%玻璃酸钠滴眼液的抑菌剂。
0.1%玻璃酸钠滴眼液;抑菌效力;苯扎氯铵
目前,眼用制剂大多为多次使用的多剂量包装,开盖后的反复使用容易因患者或环境等因素受到污染,尤其是活性有效成分自身不具有足够的抑菌或杀菌作用时,应在制剂中添加适宜的抑菌剂。对于抑菌剂的添加与否、抑菌剂的种类和浓度等问题,一直是人们持续关注的焦点[1~3]。匹配的抑菌剂应从安全性、有效性和稳定性3个方面满足产品的需求,因此,在药物研发阶段,抑菌效力研究被当作处方工艺研究、质量研究和标准制定过程中非常重要的一个环节。近年来国内眼用制剂研发也在转型中,已经从单方面注重活性有效成分,开始全面评价产品质量,包括眼用制剂中抑菌剂的合理使用以及质量控制。欧美药典均登载了研究抑菌剂抑菌效力的方法。参考美国药典USP38相关要求,《中国药典》2010年版(二部)附录列出了抑菌效力检查法指导原则,对相关制剂包括眼用制剂中添加的抑菌剂进行了规范和约束;《中国药典》2015年版[4]参考《欧洲药典》EP8.5的相关要求继续提高了这方面的标准。
0.1%玻璃酸钠滴眼液适用于干燥综合征、干眼综合征等内因性及手术后、药物性、外伤、配戴隐形眼镜等外因性造成的角结膜上皮损伤,疗效良好。我们参考《中国药典》2015年版对0.1%玻璃酸钠滴眼液的抑菌剂浓度进行了筛选,对其抑菌效力进行了研究。
1 仪器与材料
1.1 仪器 超净工作台(ESCO,IEC6010-1);恒温数显水浴锅(国华电器,HH-2);恒温数显培养箱(上海博讯实业,BSP-250);离心机(Spectrafuge,6c);高压灭菌锅(上海博讯实业,YXO-LS-75 SI);数显鼓风干燥箱(上海博讯实业,GZX-9140 MBE);一次性刻度吸管(1、2、10 mL);一次性培养皿(Sterilin);接种环;手动菌落计数器(北京赛百奥,XK-97c);自动菌落计数器(Interscience,Scan500);超低温冰箱(Thermo scientific,700系列)。
1.2 材料 金黄色葡萄球菌(CMCC26003);铜绿假单胞菌(CMCC10104);大肠埃希菌(CMCC44102);白色念珠菌(CMCC98001);黑曲霉(CMCC98003);沙氏葡萄糖琼脂培养基(SDA);大豆酪蛋白胨琼脂培养基(TSA);Letheen中和肉汤;磷酸盐缓冲液;0.9%氯化钠溶液;含聚山梨酯80(Tween 80)的0.9%氯化钠溶液;0.1%玻璃酸钠滴眼液(山东省药学科学院)。
2 试验方法
2.1 菌液的制备 金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌于30~35℃条件下分别培养18~24 h,白色念珠菌于20~25℃条件下培养48~52 h,取各菌用适量无菌0.9%氯化钠溶液洗脱,转移至无菌离心管中用适量无菌0.9%氯化钠溶液稀释,使菌悬液浓度为107~108 cfu·mL-1。
黑曲霉于20~25℃条件下培养7 d,用适量含聚山梨酯80的无菌0.9%氯化钠溶液洗脱孢子,转移至无菌离心管中,离心(5 000~6 500 rpm×8 min)。弃上清,加适量无菌0.9%氯化钠溶液,涡旋混合,使菌悬液浓度为107~108 cfu·mL-1。
2.2 供试品情况 根据文献报道[5,6],苯扎氯铵对铜绿假单孢菌和黑曲霉抗菌活性相对较弱。苯扎氯铵含量高于0.01%时,对5种试验菌具较强的杀灭作用,而苯扎氯铵含量等于或低于0.001%时则对黑曲霉已经基本无抑制作用。因此,对苯扎氯铵含量0.01%和0.001%之间的浓度做进一步筛选,以浓度具有代表性和易于配制供试品为原则,设计0.1%玻璃酸钠滴眼液中苯扎氯铵的浓度。
设计供试品条件:a组(含0.001%苯扎氯铵的供试品)、b组(含0.003%苯扎氯铵的供试品)、c组(含0.005%苯扎氯铵的供试品)、d组(含0.01%苯扎氯铵的供试品)。上述4组供试品,装量均为5 mL,分别接种金黄色葡萄球菌、大肠埃希菌、铜绿假单孢菌、白色念珠菌菌悬液和黑曲霉孢子悬液,进行抑菌效力试验。
2.3 测定方法
2.3.1 0 h测定 各供试品组分别取磷酸盐缓冲液5支、0.1%玻璃酸钠滴眼液5支各20 mL,分别依次接种金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、白色念珠菌、黑曲霉。接种的菌悬液体积为供试品体积的0.7%。磷酸盐缓冲液梯度稀释接种后,取接近的稀释级,接种2个平皿做平行对照。接种后均放入20~25℃培养箱培养,在各测定时间点时进行梯度稀释。同时平行进行中和剂验证,菌落回收率不低于70%,说明该试验方法及材料均适用于0.1%玻璃酸钠滴眼液。
2.3.2 6 h测定 各供试品分别取0.1%玻璃酸钠滴眼液5支各1 mL,用中和肉汤梯度稀释,取浓度符合要求的稀释液于平皿中,接种2个平皿做平行对照,分别加入相应的培养基。细菌于30~35℃条件下培养3~5 d,白色念珠菌于20~25℃条件下培养3~5 d,黑曲霉于20~25℃条件下培养3~7 d,并计菌落数。
2.3.3 24 h、7 d与28 d测定 方法同6 h测定。
2.3.4 测定时间及判断标准 见表1。表中的“减少的lg值”是指各间隔时间测定的菌数lg值与1 mL(g)供试品中接种的菌数lg值的相差值。表中“A”是指应达到的抑菌效力标准,特殊情况下,如抑菌剂可能增加不良反应的风险,那至少应达到“B”的抑菌效力标准。

表1 0.1%玻璃酸钠滴眼液抑菌效力测试时间点和判断标准
2.4 中和剂的验证[4,7]6 h、24 h、7 d、28 d测定中,需要加入适宜的中和剂消除0.1%玻璃酸钠滴眼液中剩余的抑菌剂。0 h测定时,分别取中和肉汤5支各9 mL,pH 7.0无菌氯化钠-蛋白胨缓冲液5支各10 mL。在9 mL中和肉汤中分别加入0.1%玻璃酸钠滴眼液1 mL,中和10 min,作为中和剂对照组;10 mL pH 7.0无菌氯化钠-蛋白胨缓冲液作为菌液对照组,两组分别加入适宜浓度的金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、白色念珠菌、黑曲霉菌悬液各0.1 mL,混匀,使每1 mL供试液中含菌量不超过100 cfu,分别取两组个试验菌液接种至2个平皿做平行对照,加入适宜的培养基,培养计数。中和剂对照组的菌落数与菌液对照组的菌落数比值应在0.5~2.0之间。
3 实验结果
3.1 中和剂的验证结果 见表2,回收率均大于70%,表明中和肉汤满足实验要求,能够消除滴眼液中残余的抑菌能力。
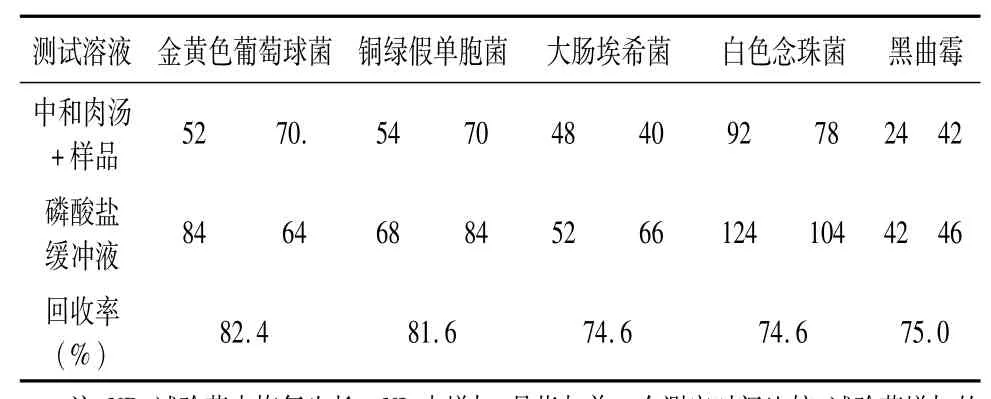
表2 中和剂验证菌落数及结果
3.2 抑菌效力测定结果 结果见表3。
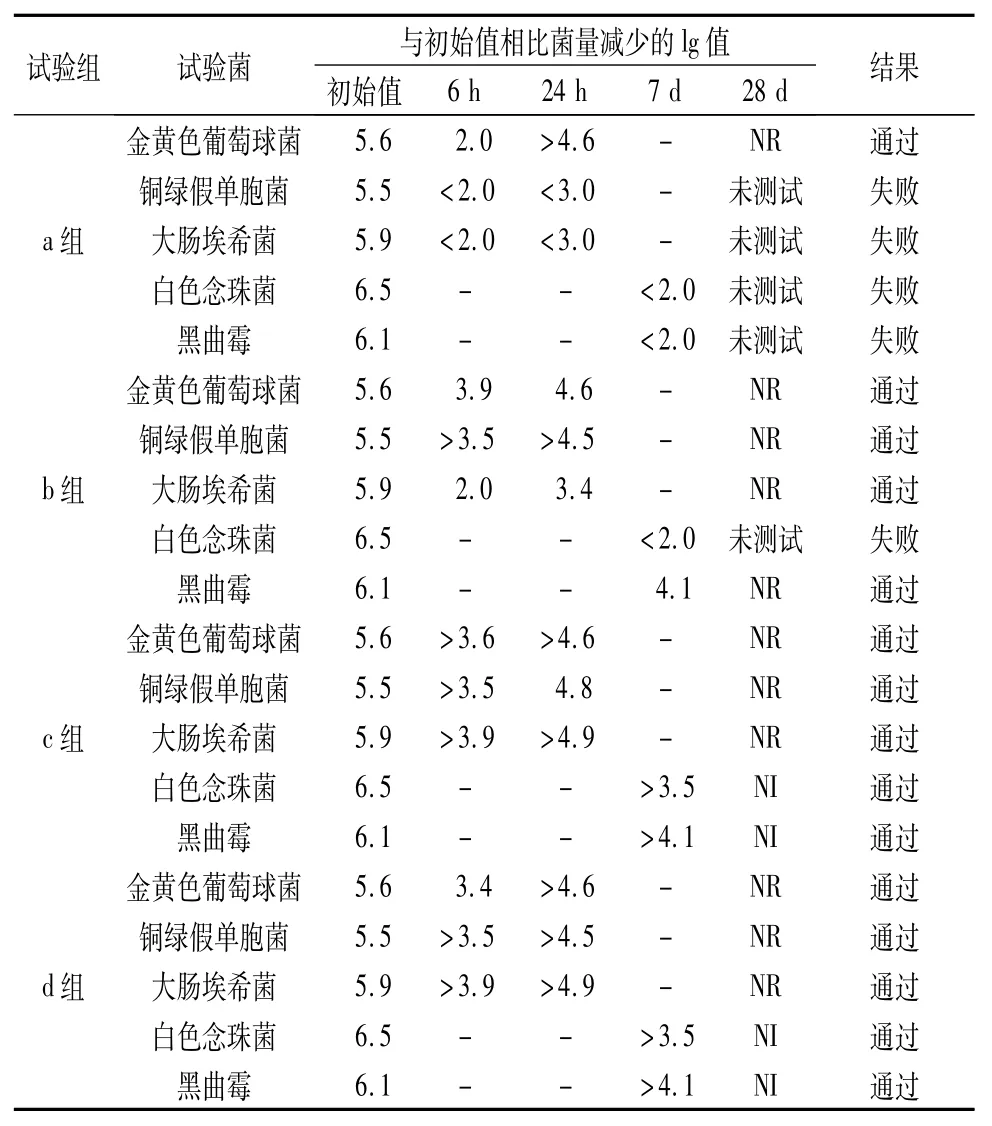
表3 试验组菌量减少lg值
试验结果表明,a、b、c、d 4组供试品对金黄色葡萄球菌均有较强的抑制作用,4组供试品对铜绿假单孢菌、大肠埃希菌、白色念珠菌、黑曲霉的抑制作用随抑菌剂浓度的增大而呈现明显的下降趋势,符合《中国药典》2015年版判断标准。其中抑菌剂含量较高的c、d组,与初始值比较,各测定时间点的菌计数结果表现出较为明显的减少趋势,尤其在对白色念珠菌的抑制作用上。以上4组试验组中,符合《中国药典》2015年版抑菌剂效力检查法结果判断“A”标准的有c、d 2组,根据“所有抑菌剂都具有一定的毒性,制剂中抑菌剂的量应为最低有效量”[5]这一原则,应选取抑菌剂含量最低的c组中的抑菌剂浓度,作为正式产品的处方浓度。
4 讨论
《中国药典》2015年版更新了抑菌效力检查法,并根据欧美药典的最新要求对抑菌效力的标准进行了提高。多剂量包装的滴眼液需要在处方中适当添加适宜的抑菌剂来保持滴眼液产品在贮存和使用过程,尤其是使用过程中具有一定的抑菌能力,同时考虑添加的抑菌剂多少都会具有一定的毒性,因此必须进行充分的试验研究,严格控制抑菌剂的种类和用量,保证用药安全。
苯扎氯铵为国内外常用的抑菌剂,若不存在严重的配伍禁忌,为大多数滴眼液中所常用[8]。按照《中国药典》2015年版抑菌剂效力检查法对0.1%玻璃酸钠滴眼液中使用苯扎氯铵的浓度进行了筛选,最终确定0.005%的苯扎氯铵可用作0.1%玻璃酸钠滴眼液的抑菌剂。处方中苯扎氯铵浓度为0.005%时,0.1%玻璃酸钠滴眼液对革兰阳性菌(金黄色葡萄球菌)、革兰阴性菌(铜绿假单孢菌和大肠埃希菌)、酵母菌(白色念珠菌)和真菌(黑曲霉)均有较强的抗菌活性,符合《中国药典》2015年版抑菌抑菌效力判断标准。
[1] 宁黎丽.眼用制剂研发过程中应关注抑菌剂的合理使用和质量控制[J].中国药学杂志,2007,42(23):1836-1838.
[2] 林吉恒,肖璜,陈万胜,等.氯霉素滴眼剂处方中硫柳汞含量的合理性分析[J].中国药师,2014,7(10):1687-1690.
[3] 安彦,唐素芳.地塞米松磷酸钠滴眼液中两种抑菌剂的分析[J].中国药业,2011,20(9):14-15.
[4] 国家药典委员会.中华人民共和国药典2015年版[S].北京:中国医药科技出版社,2015.
[5] 丁勃,巩丽萍,谢元超.阿奇霉素滴眼液抑菌剂筛选与抑菌效力研究[J].中国药品标准,2012,13(4):281-284.
[6] 胡小华.阿奇霉素滴眼液的抑菌效力测定[J].中国药师,2013,16(5):780-781.
[7] 李津,宋燕,张世磊.含防腐剂药物制剂的防腐效力检测[J].食品与药品,2009,11(6):56-60.
[8] 张琳,刘葵葵,王伶.HPLC法同时测定阿奇霉素滴眼液中阿奇霉素及苯扎氯铵的含量[J].齐鲁药事,2012,31(12):705-707.
Studies on antim icrobial effectiveness of Sodium Hyaluronate Eye Drops(0.1%)
XIA Xiao-jun1,DONG Ai-mei2,ZHANG Jian-qiang3
(1.The People′s Liberation Army 107 Hospital,Yantai264002,China;2.Shandong Academy of Pharmaceutical Sciences,Jinan 250101,China;3.Shandong Provincial Key Laboratory of Mucosal and Transdermal Drug Delivery Technology,Jinan 250101,China)
ObjectiveTo investigate the optimal concentration of antimicrobial preservative thatwas added to Sodium Hyaluronate Eye Drops(0.1%).MethodsAccording to the characteristic of ingredients,select several concentrations of antimicrobial preservative on the basis of the ingredients of the product.Test the antimicrobial effectiveness of antimicrobial preservatives at different ratio.Inoculate the concentration of testmicroorganisms to the products,then estimate the viable microorganisms in different times.ResultsThe growth of testmicroorganismswere inhibited effectively by Sodium Hyaluronate Eye Drops possess of 0.005%benzalkonium chloride which was also the minimum effective dosage.Conclusion0.005%benzalkonium chloride can be used as antimicrobial preservative for Sodium Hyaluronate Eye Drops(0.1%).
Sodium Hyaluronate Eye Drops(0.1%);Bacteriostatic potency;Benzalkonium chloride
R944.1
A
2095-5375(2015)08-0455-003
夏晓君,女,副主任药师,研究方向:医院药学,E-mail:xxj_107@126.com。
