基于ISSR分子标记的褐马鸡亲缘关系分析
2015-03-14武玉珍冯睿芝
武玉珍,冯睿芝,张 峰
1 晋中学院生物科学与技术学院,晋中 030619 2 复旦大学生物医学研究院,上海 200032 3 山西大学生命科学院,太原 030006
基于ISSR分子标记的褐马鸡亲缘关系分析
武玉珍1,冯睿芝2,张 峰3,*
1 晋中学院生物科学与技术学院,晋中 030619 2 复旦大学生物医学研究院,上海 200032 3 山西大学生命科学院,太原 030006
褐马鸡(Crossoptilonmantchuricum)是中国特有濒危鸟类,国家一级保护动物。为了保护褐马鸡种质资源,保障驯养繁育种群和再引入种群的遗传基因结构优化,采用 ISSR分子标记技术,对山西庞泉沟国家自然保护区和太原动物园两个种群35个褐马鸡进行了亲缘关系分析。从20条ISSR引物中筛选出10条扩增条带清晰稳定、重复性好的引物,共扩增出65条DNA条带,其中 77%呈多态性。两个种群各个体之间的Nei′s无偏差遗传距离和遗传相似度分析表明:个体间遗传相似性的平均值分别为0.5061与0.7591,遗传距离的平均值分别为0.4939与0.2409。用组平均法对35个褐马鸡个体进行聚类分析,结果显示:大多数同一种群的个体首先聚在一起,显示出生态地理条件相似的种群亲缘关系较近。
褐马鸡;ISSR;遗传距离;遗传相似度;聚类分析;亲缘关系
褐马鸡(Crossoptilonmantchuricum)为中国特有珍稀鸟类,国家一级保护动物,世界濒危物种。目前褐马鸡只分布在中国华北的部分地区,由于太行山和黄河的阻隔,褐马鸡的栖息地被分割成三块孤立的自然地理区域,形成了三个独立的褐马鸡种群,即山西吕梁山的中部种群、河北小五台山与北京东灵山的东部种群、陕西黄龙山的西部种群。山西省是褐马鸡分布中心和多度中心。长期以来,对于褐马鸡的研究主要集中在生物学、生态学、资源调查及保护等方面[1- 3],近年来以分子生物学技术进行褐马鸡遗传多样性方面的研究[4- 7]有少量报道,表明对褐马鸡的研究开始从宏观进入微观分子水平。但采用ISSR分子标记对褐马鸡亲缘关系的研究目前尚未见报道。ISSR (Inter-Simple Sequence Repeats)是Zietkiewicz等[8]于1994年创建的一种新的分子标记技术,它是根据基因组中广泛存在的微卫星序列,设计通用引物对基因组DNA进行PCR扩增,从而检测基因组中微卫星序列的变异。ISSR结合了SSR和 RAPD 的优点,操作简单、稳定性好、检测方便,近年来广泛应用在种群遗传多样性[9- 10]、种质资源鉴定[11- 12]、亲缘关系[13- 14]和系统发育[15]等方面的研究。
本文采用ISSR分子标记技术,对山西庞泉沟国家自然保护区和太原动物园的两个褐马鸡种群的35个个体进行亲缘关系分析, 旨在了解这两个分别代表山西野生种群和笼养种群褐马鸡的遗传背景和种质潜质,为保护褐马鸡种质资源和褐马鸡的野外放归与再引入提供科学的理论依据。
1 材料与方法
1.1 材料
实验材料:庞泉沟褐马鸡样品18份,其中肌肉样品3份,采自庞泉沟保护区繁育场死亡幼雏;血液样品15份,采自保护区繁育场混养的成年褐马鸡。太原动物园血液样品17份,均采自动物园笼养种鸡,实验样品共35份。
1.2 方法
1.2.1 DNA提取
分别取 0.34g肌肉、10—70 μL的血液,采用常规的SDS/蛋白酶K裂解, 酚/氯仿法提取基因组总DNA,详细操作参照武玉珍[16]文献。
1.2.2 ISSR引物的筛选
依据加拿大不列颠哥伦比亚大学(UBC)公布的第9套ISSR引物序列,参照Abbot[17]与白秀娟[18]的研究结果,选择其中的20条引物(表1),均由北京奥科公司合成。通过4个随机样本的选择,从20条ISSR引物中筛选出10条扩增产物稳定、条带清晰、重复性好的引物,再对全部材料进行PCR扩增。
1.2.3 ISSR-PCR扩增
在25μL反应体系中含有10×PCR Buffer 2.5μL、25mmol/L Mg2+2μL、1.25 mmol/L dNTP 4μL、5.0 μmol/L引物5.0μL、2 U/μL Taq酶0.5μL、10 ng—150 ng/μL DNA模板1 μL,余量由ddH2O补足,在PTC- 150 PCR仪上进行扩增。PCR反应条件为:94 ℃预变性5 min,94 ℃变性45 s,退火温度38—54 ℃ 45 s,72 ℃延伸1 min,40个循环,最后72 ℃延伸7min。每条引物的PCR反应退火温度见表1。
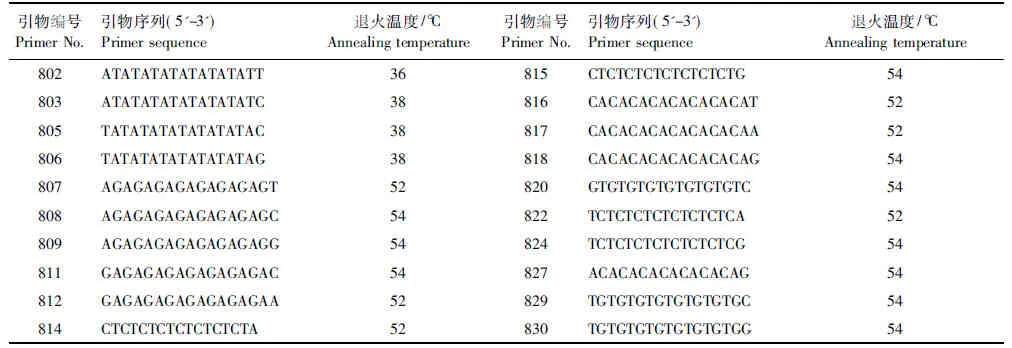
表1 ISSR引物序列Table 1 ISSR primer sequences
1.2.4 电泳检测
PCR产物用1.5%的琼脂糖凝胶进行电泳,DNA marker为DL2000 (购自大连宝生物公司),采用凝胶成像系统观察拍照,并记录电泳结果。
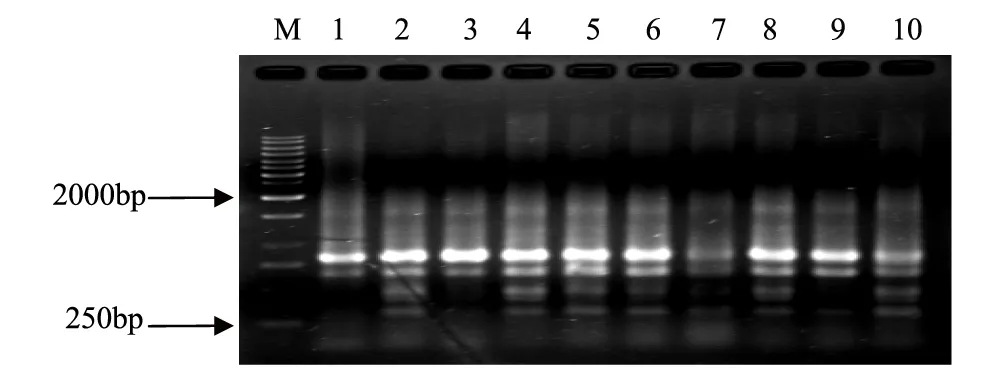
图1 引物ISSR 811对太原动物园1—10号样品扩增的指纹图谱Fig.1 Profile of the Brown-eared pheasant from Taiyuan Zoo by primer 811
1.2.5 谱带分析
ISSR扩增谱带以 0、1数据统计,在同一引物,同一位点,根据扩增产物的有(1)无(0)得到二元资料,形成ISSR分析的原始数据矩阵(0,1)矩阵。利用PhylTools6.0软件计算两个种群各个体之间的Nei′s无偏差遗传距离和遗传相似度,应用组平均法对褐马鸡35个个体的(0,1)原始矩阵进行聚类分析,得到聚类结果。
2 研究结果
2.1 ISSR扩增图谱
本实验中共试验了20 条ISSR 引物, 其中10条可扩增出清晰条带, 将其用于供试35个样本PCR扩增,引物编号分别为806、807、808、809、811、812、815、816、817和818,除806外,引物的退火温度在50℃以上, 保证了PCR 反应较高的特异性。10条引物共扩增出65条清晰稳定的条带,扩增片段大小在300—2000bp之间,每个引物扩增的位点从5到9不等,平均为6.5,65个扩增位点中有50个位点具有多态性,多态性位点比率为76.9%。引物对部分样品的扩增结果见图1—图3。
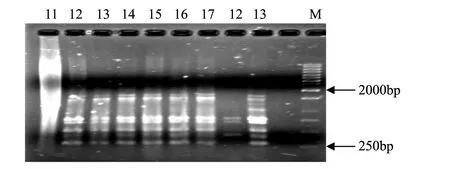
图2 引物ISSR 811扩增的太原动物褐马鸡11—17号样和庞泉沟12、13样品的指纹图谱Fig.2 Profile of the Brown-eared pheasant from Taiyuan Zoo and Pangquangou Nature Reserve by primer 811
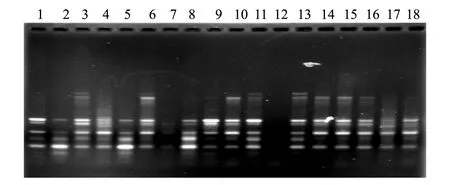
图3 引物ISSR811扩增的庞泉沟自然保护区褐马鸡样品的指纹图谱Fig.3 Profile of the Brown-eared Pheasant of Pangquangou Natural Reserve using primer 811
2.2 遗传距离与遗传相似系数
利用PhylTools软件计算出了褐马鸡两个种群各个体之间的Nei′s遗传距离(表2和表3)、遗传相似系数(表4和表5)。
从表2可以看出:太原动物园17个个体间的遗传距离为0.0000—0.5348,平均值为0.2409。其中,dwy8与dwy6之间遗传距离最大为0.5348,其次是dwy1与 dwy10间为0.5000,而dwy7与dwy2,dwy9与dwy5,dwy12分别与dwy5、dwy9,dwy13与dwy3,dwy14分别与dwy3、dwy13,dwy16与dwy15,dwy17与dwy4间遗传距离为0.0000。

表2 太原动物园17只褐马鸡之间的Nei′s 遗传距离Table 2 Nei′s Genetic distance of the 17 individuals of Brown-eared pheasant from Taiyuan Zoo
1—17 分别为:dwy 1—17 号个体
从表3可以看出:庞泉沟保护区18个个体间的遗传距离在0.000—1.000之间,平均值为0.4939。其中,pqg2与pqg5、pqg 8、pqg14—18,pqg3与pqg5,pqg4与pqg5、pqg 8、pqg14—18,pqg5与pqg8、pqg12,pqg7与pqg11,pqg8与pqg11,pqg11与pqg16遗传距离最远为1.0000;其次是pqg10与pqg2、pqg4以及pqg9与pqg11间遗传距离为0.8182;而pqg4与pqg2、pqg12与pqg3、pqg15与pqg14遗传距离最近为0.0000。
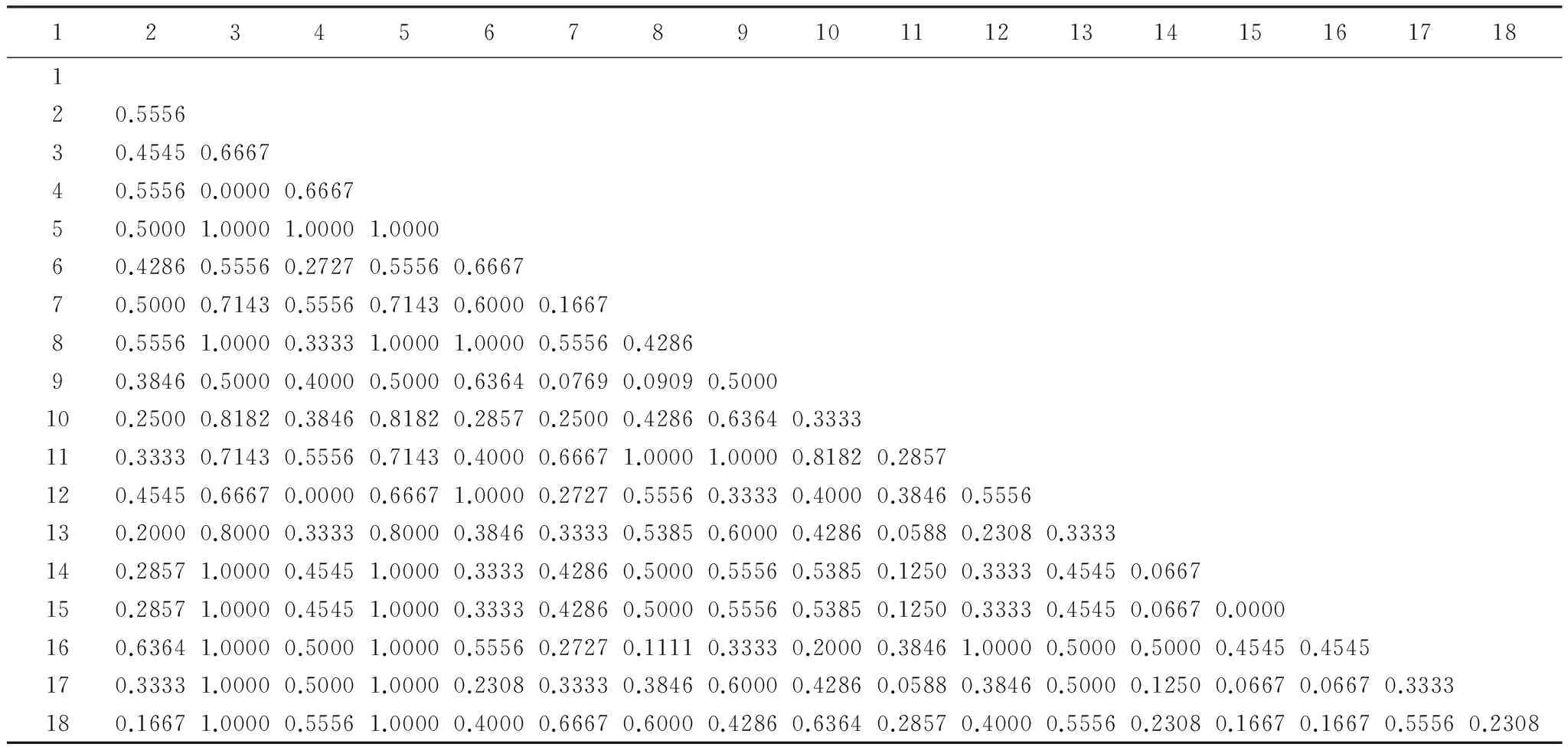
表3 庞泉沟自然保护区18只褐马鸡之间的Nei′s 遗传距离Table 3 Nei′s Genetic distance of the 18 individuals of Brown-eared pheasant from Pangquangou Nature Reserve
1—18 分别为:pqg 1—18 号个体
从表4可以看出:太原动物园种群中,dwy7与dwy2,dwy9与dwy5,dwy12分别与dwy5、dwy9,dwy13与dwy3,dwy14分别与dwy1、dwy4,dwy16与dwy15,dwy17与dwy4之间遗传相似度最高为1.0000,遗传距离最近;而dwy8与dwy6之间遗传相似度最低为0.4615,遗传距离最远。

表4 太原动物园17只褐马鸡之间的Nei′s 遗传相似系数Table 4 Nei′s Genetic similarities of 17 individuals of Brown-eared pheasant of Taiyuan Zoo
1—17 分别为:dwy 1—17 号个体
从表5可以看出:庞泉沟自然保护区种群中,pqg4与pqg2,pqg12与pqg3,pqg15与pqg14遗传相似度最高为1.0000,遗传距离最近;而pqg2、pqg4分别与pqg5、pqg8、pqg14、pqg15、pqg16、pqg17、pqg18,pqg5分别与pqg3、pqg8、 pqg12,pqg11与pqp8、pqg7,遗传一致度最低为0.0000,遗传距离最远。

表5 庞泉沟自然保护区18只褐马鸡之间的Nei′s 遗传相似系数Table 5 Nei′s Genetic similarities of 18 individuals of Brown-eared pheasant of Pangquangou Nature Reserve
1—18 分别为:pqg 1—18号个体
2.3 亲缘关系聚类图
应用组平均法对褐马鸡35个个体的(0,1)原始矩阵进行聚类分析,结果见图4。从图4看出:35个个体聚为3类,其中24(pqg7)为单独一类;太原动物园除dwy7外,其它个体聚为一类;庞泉沟自然保护区的个体聚为一类。大多数同一种群的不同个体首先聚在一起,显示出明确的生态地理条件相似的种群优先相聚,也就是说生态地理条件相似的种群亲缘关系较近。pqg7显示出与两个种群的其他个体亲缘关系相对较远;dwy6与动物园种群的其他个体亲缘关系相对较远;dwy7显示出与庞泉沟种群具有较近的亲缘关系。

图4 用Between-groups linkage法构建的褐马鸡两个种群35个个体的ISSR聚类图Fig.4 ISSR dendrogram of 35 individuals from two populations of Brown-eared pheasant using Between-groups linkage
3 分析与讨论
3.1 ISSR实验的稳定性
要获得一个物种不同种群的遗传背景信息,必需检测大量的样本,检测方法的稳定性也是非常重要的。ISSR引物一般是由17bp的碱基组成,对基因组DNA具有快速、高效、灵敏的检测特性,而且可重复性好,操作简便、成本较低,实验的稳定性较高[19]。由于ISSR的稳定性受Mg2+浓度、引物浓度、退火温度等因素的影响,因此,进行ISSR大量样本的扩增前,先对ISSR反应的条件进行了优化,采用统一的PCR反应条件。对20条ISSR引物进行了筛选,其中有10条引物能扩增出条带清晰且具多态性的带型。在这10条引物中(AG)n与(CA)n各有3条,(GA)n有2条,说明褐马鸡基因组中存在大量的(CA)、(AG)二核苷酸重复序列。在引物筛选的过程中,退火温度较高的引物扩增效果均较退火温度低的好,筛选出所选用的10条引物只有1条退火温度较低,其它9条引物退火温度均较高。在ISSR图谱中出现某种群的特征条带,引物815的扩增图谱只有庞泉沟种群的个体出现大于1000 bp 的片段,引物811、812、809对庞泉沟自然保护区种群的扩增有特异性。引物811可以将这35个个体区分开。因此,只要引物选择合适,扩增出种群的特征性谱带,有助于种群的遗传结构分析,为进一步克隆、测序,寻找种群特有的分子标记提供了可能。
应用mtDNA标记和ISSR标记两种方法,对这两个褐马鸡种群进行了遗传多样性的研究[5,7],二者的结果基本一致,这表明无论用线粒体DNA标记(mtDNA),还是细胞核DNA标记(ISSR),研究的结果基本相同,可以互为印证。这说明ISSR标记是一种研究种群遗传多样性、遗传结构、种质资源及亲缘关系的稳定有效工具。
3.2 亲缘关系分析
山西庞泉沟国家自然保护区与太原动物园两个褐马鸡种群个体间遗传相似性的平均值分别为0.5061与0.7591,遗传距离的平均值分别为:0.4939与0.2409,35只褐马鸡个体总的Nei′s遗传距离和相似性系数平均值分别为:0.3723和0.6310。分析表明两个种群的遗传变异有差异,但差异未达到统计学显著性水平,两个种群个体之间亲缘关系较近。聚类分析结果表明:遗传距离较近的个体聚在一起,然后与遗传距离较远的个体再聚。遗传距离较近的个体亲缘关系近,而遗传距离较远的个体,亲缘关系较远。大多数同一种群的不同个体首先聚在一起,显示出生态地理条件相似的种群优先相聚,但也存在不同种群聚在一起的情况。如图4中pqg7单独聚为一类,显示出与两个种群亲缘关系较远,推测可能是来自保护区分布较远的不同种群的后代。图4中dwy7与庞泉沟种群聚为一类,显示出与庞泉沟种群有较近的亲缘关系,推测这两个褐马鸡种群可能具有共同的亲源。这一结论与太原动物园饲养褐马鸡的历史相符合。太原动物园1959年由芦芽山(宁武县)提供褐马鸡种源,开始试验人工饲养,曾经4次较大数量补充野生种源,1979—1983年从芦芽山补充60余只,1992年和2014年分别从庞泉沟自然保护区补充野生种源8只、6只,2011年从芦芽山补充野生卵孵化9只。到2000年建成了全国最大的褐马鸡人工饲养繁育基地,为全国各地动物园提供褐马鸡种源和观赏鸡。
两个种群遗传相似性和遗传距离的差异(表2—表5),反应出两个种群饲养方式的不同。庞泉沟自然保护区的个体间遗传相似性的平均值低于太原动物园,遗传距离的平均值高于太原动物园,说明庞泉沟种群个体间的亲缘关系较远,动物园种群个体之间的亲缘关系较近。这种状况与两个种群不同的饲养方式有关。庞泉沟自然保护区繁育场采取仿野生的散养、混养方式,并且每年从保护区野外捡拾褐马鸡卵进行孵化补充种群,繁育场的种群虽然有可能近亲繁殖,但因为不断有新种源补充,群体的亲缘关系仍较远。太原动物园从1996年起选配12对成年褐马鸡实行“一夫一妻”的分笼配对繁殖饲养,这种方式有效避免了近交繁殖,但是种源有限,更新也较慢,群体的亲缘关系仍比较近。因为饲养的用途不同,所采取的饲养方式也不同。
本试验对褐马鸡两个种群35个个体进行遗传距离聚类及亲缘关系分析,可作为优质种源和再引入亲本选择时的理论依据。作为亲本应尽量选择遗传距离大于0.5的组合,同时避免遗传距离小于 0.25的亲本组合。可重点选择庞泉沟自然保护区野生种群的pqg2、pqg4分别与pqg5、pqg8、pqg14、pqg15、pqg16、pqg17、pqg18,pqg5与pqg3、pqg8、 pqg12,pqg11与pqp7、pqg8等,这些个体之间遗传相似性最低(0.0000),遗传距离最远(1.0000),亲缘关系最远,可以作为优质亲本种源。
3.3 ISSR标记在野生动物研究中的应用前景
ISSR标记常用作一种植物(农作物、药材等)多个品种、品系之间亲缘关系的区分和鉴定。但野生动物个体之间外部形态差异不大,亲缘关系主要与生态地理环境有关,特别是像褐马鸡这种飞行能力较差的地栖鸟类。应用ISSR标记技术可以有效分辨动物个体之间的亲缘关系,同时可以筛选出亲缘关系较远的个体,如独自聚为一类的pqg7个体(图4),作为人工饲养繁育的优质种源和褐马鸡再引入的原始种源。栖息地的破碎化致使我国的褐马鸡被分割为3个孤立种群(山西、河北、陕西),各种群之间因地理阻隔难有基因交流,遗传多样性较低[5,7]。以ISSR标记研究褐马鸡亲缘关系、寻找发现优质种源,对褐马鸡的种群发展和科学保护具有重要的学术价值和现实意义。
ISSR标记作为以PCR为基础的分子标记,除具有操作简单、成本低、快速、灵敏的优点外,还有所需 DNA模板量少、稳定和多态条带丰富等优点,是研究物种遗传背景的有效工具。ISSR标记已广泛应用于植物的遗传连锁图谱构建、种质资源鉴定、基因定位、植物分类、进化和遗传多样性等研究[20],而在动物研究中应用较少[21],仅有少数家禽与水产鱼虾蟹的研究。ISSR标记用于濒危野生动物的研究则更少,仅见东北虎[18](Pantheratigrisaltaica)、金钱豹[22](Pantherapardus)和北海狮[23](Eumetopiasjubatus)、獐(Hydropotesinermis)[24]等研究,而用于珍稀野生鸟类的研究鲜见报道。本研究将ISSR标记技术用于中国特有的濒危鸟类——褐马鸡的亲缘关系研究,扩展了鸟类遗传背景和系统进化等方面的研究手段,是有意义的尝试和探索,对其他野生动物的遗传分析也不失为一种便捷稳定的方法。由于采样数量及引物数量较少,检测到的位点有限,对褐马鸡圈养和野生种群亲缘关系的全面评价,有待于进一步深入研究。
致谢:山西省自然保护区管理站张龙胜教授、山西庞泉沟国家自然保护区管理站武建勇高级工程师及太原动物园卫泽珍副主任、孟庆珍兽医师等对样品采集中给予帮助,特此致谢。
[1] 李宏群, 廉振民, 刘晓莉. 中国褐马鸡的研究现状及其保护措施. 延安大学学报: 自然科学版, 2009, 28(2): 92- 96.
[2] 张国钢, 郑光美, 张正旺, 郭建荣, 王建平, 宫树龙. 山西芦芽山褐马鸡越冬栖息地选择的多尺度研究. 生态学报, 2005, 25(5): 952- 957.
[3] 武玉珍, 冯睿芝. 褐马鸡的濒危原因及保护措施. 中国家禽, 2013, 35(8): 49- 50.
[4] 冯宁, 杨淑娟, 徐振武, 高学斌, 王万云, 尹祚华. 褐马鸡地理种群的遗传多样性研究. 陕西师范大学学报: 自然科学版, 2007, 35(S1): 77- 80.
[5] 武玉珍, 王孟本, 张峰. 褐马鸡圈养种群的mtDNA控制区多态性. 生态学报, 2010, 30(11): 2958- 2964.
[6] 武玉珍, 冯睿芝, 张峰. 珍禽褐马鸡线粒体DNA控制区结构和亲缘关系. 生态学杂志, 2013, 32(12): 3243- 3249.
[7] 武玉珍, 冯睿芝. 褐马鸡圈养种群ISSR标记的遗传多样性. 林业科学, 2013, 49(11): 103- 108.
[8] Zietkiewicz E, Rafalske A, Labuda D. Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification. Genomics, 1994, 20(2): 178- 183.
[9] 吴则焰, 刘金福, 洪伟, 潘东明, 郑世群, 何中声. 孑遗植物水松不同年龄级种群遗传多样性的ISSR分析. 生态学杂志, 2012, 31(8): 1911- 1916.
[10] 张杰, 王佳, 李浩宇, 张慧荣, 王迎春. 濒危植物蒙古扁桃不同地理种群遗传多样性的ISSR分析. 生态学报, 2012, 32(14): 4443- 4452.
[11] 孙利娜, 席梦利, 徐进, 吴祝华, 施季森. 百合辐射突变体的ISSR鉴定技术研究. 现代农业科技, 2011, (1): 219- 221.
[12] 范付华, 杨勇胜, 李庆宏, 邓勇, 文晓鹏. 利用ISSR分析技术鉴定贵州枇杷新种质的研究. 北京林业大学学报, 2012, 34(4): 52- 57.
[13] 刘本英, 李友勇, 唐一春, 王丽鸳, 成浩, 王平盛. 云南茶树资源遗传多样性与亲缘关系的ISSR分析. 作物学报, 2010, 36(3): 391- 400.
[14] 严华, 张冬梅, 罗玉兰, 鲁琳. 38种国兰亲缘关系的ISSR分析. 分子植物育种, 2010, 8(4): 736- 741.
[15] 权俊萍, 何树兰, 彭峰, 郑玉红, 夏冰. 部分百里香属植物分子系统学研究. 西北植物学报, 2008, 28(8): 1566- 1572.
[16] 武玉珍. 濒危鸟类褐马鸡遗传多样性及保护研究 [D]. 太原: 山西大学, 2008: 12- 18.
[17] Abbot P. Individual and population variation in invertebrates revealed by inter-simple sequence repeats (ISSR). The Journal of Insect Science, 2001, 1: 8.
[18] 白秀娟. 圈养东北虎ISSR指纹分析初报. 兽类学报, 2004, 24(1): 90- 92.
[19] 郑芳, 吕秀玲, 孙红英, 周开亚, 赵强, 高伟, 徐信荣. ISSR标记在河蟹种质检测中的应用. 中国水产科学, 2007, 14(1): 46- 51.
[20] 周延清. DNA分子标记技术在植物研究中的应用. 北京: 化学工业出版社, 2005: 143- 161.
[21] 林杰君, 鲍毅新, 刘军, 张旭. ISSR分子标记及其在动物遗传结构研究中的应用. 生态学杂志, 2012, 31(5): 1319- 1326.
[22] 朱军, 王立斌, 郭东龙, 马恩波, 任竹梅. 基于ISSR标记技术的金钱豹遗传多样性分析. 山西大学学报: 自然科学版, 2008, 31(2): 244- 247.
[23] Koyama S, Fujita S, Hirota T, Satoh T, Obara Y, Hoshino H, Wada A, Burkanov V N, Wada K. Genetic structure of steller sea lion (Eumetopiasjubatus) rookeries in the sea of Okhotsk. Zoological Studies, 2008, 47(6): 781- 787.
[24] 林杰君, 鲍毅新, 刘军, 王艳妮, 张旭. 舟山群岛四个养殖獐种群遗传多样性和遗传结构. 生态学报, 2013, 33(11): 3460- 3469.
Analysis on genetic relationship of Brown-eared pheasant (Crossoptilonmantchuricum) based on ISSR molecular marker
WU Yuzhen1, FENG Ruizhi2, ZHANG Feng3,*
1SchoolofBiologyScienceandTechnology,JinzhongUniversity,Jinzhong030619,China2InstituteofBiomedicalSciences,FudanUniversity,Shanghai200032,China3SchoolofLifeScience,ShanxiUniversity,Taiyuan030006,China
The Brown-eared pheasant (Corossoptilonmantchuricum) is a critically endangered endemic to China, listed in the national first-class protected bird in China. At present, the distribution area of the Brown-eared pheasant was isolated by Yellow River and Taihang Mountains to form the three regions and the three isolated populations. Those isolated geographic populations are the middle population located in Lvliang Mountains, Shanxi; the east population in Dongling Mountains, Beijing and Xiaowutai Mountains, Hebei and the west population in Huanglong Mountains, Shaanxi, among which Shanxi is the distribution center and abundance center of the Brown-eared pheasant. So far the most researches concerning the Brown-eared pheasant mainly focus on biological, ecological, resource investigation and protection. Using molecular biological method to the research of genetic diversity of the Brown-eared pheasant is still at the initial stage. For the protection of germplasm resources of the Brown-eared pheasant and to optimize the genetic structure of captive populations and further reintroduction, we detected the genetic relationship of 35 individuals in two populations in Shanxi from Pangquangou Nature Reserve and Taiyuan Zoo were studied by using ISSR markers. Ten pairs of primers with repeatable clear and stable bands from 20 pairs of ISSR primers for 35 samples of the two populations were selected, and 65 DNA bands were amplified with polymerase chain reactions, 77% of which were polymorphic bands. PhylTools software was used to calculate Nei′s genetic distance and genetic similarity of each individual from the two populations. The analysis from Nei′s genetic distance and genetic similarity of individuals from each other showed that the means of genetic similarity of individuals from the two populations were 0.5061 and 0.7591, and the means of Nei′s genetic distance were 0.4939 and 0.2409, respectively. As a whole, the means of Nei′s genetic distance and genetic similarity of all 35 individuals are 0.3723 and 0.6310, respectively, which indicated that the genetic variation of individuals in the two populations were at low level, with relatively close genetic distance. We also performed cluster analysis using group average clustering method with (0, 1) matrix and Nei′s genetic distance of the 35 individuals. The results showed that the samples with close genetic distance had close genetic relationship. Most individuals from the same population were grouped together; it indicated that those from similar ecological and geographical environment had the closer relationship. The individuals from Pangquangou Nature Reserve had lower genetic similarity and further genetic distance with each other than the individuals from Taiyuan Zoo, which indicated that those from Pangquangou Nature Reserve had further genetic relationship than those from Taiyuan Zoo. This may due to the free-ranging method and the annual supplement of picking up wild eggs and hatching in Pangquangou Nature Reserve. With this approach, we can easily identify genetic relationship of individuals and select those with relatively far genetic distance for high quality germplasm resource. This method would serve as a novel tool in the research of endangered birds.
Crossoptilonmantchuricum; ISSSR; genetic distances; genetic similarity; cluster analysis; genetic relationship
科技部科技基础性工作专项(2011FY110300); 山西省自然科学基金资助项目(2012011034- 3); 山西省回国留学人员科研资助项目(20100012)和山西省教改资助项目(J2011088)
2014- 08- 05;
2014- 12- 10
10.5846/stxb201408051563
*通讯作者Corresponding author.E-mail: fzhang@sxu.edu.cn
武玉珍,冯睿芝,张峰.基于ISSR分子标记的褐马鸡亲缘关系分析.生态学报,2015,35(4):1059- 1067.
Wu Y Z, Feng R Z, Zhang F.Analysis on genetic relationship of Brown-eared pheasant (Crossoptilonmantchuricum) based on ISSR molecular marker.Acta Ecologica Sinica,2015,35(4):1059- 1067.
