紫色达利菊缩合单宁对大肠杆菌的抑制作用
2015-03-14刘秀丽王玉玺李元恒许中军侯勇跃
刘秀丽 王玉玺 李元恒 许中军 金 龙 ,4 侯勇跃*
(1.内蒙古自治区农牧业科学院,呼和浩特 010031;2.加拿大农业与农业食品部列桥研究中心,列桥 T1J4B1,加拿大;3.中国农业科学院草原研究所,呼和浩特 010010;4.东北农业大学动物科学与技术学院,哈尔滨 150030)
大肠杆菌(Escherichia coli,E.coli)O157∶H7是一种食源性致病菌,可引起人类腹泻、出血性肠炎,部分病人很快转为溶血性尿毒综合征,病死率很高。大肠杆菌已严重威胁到人类的健康,成为全世界重要的公共卫生问题之一。目前,世界上已有30多个国家报告有其感染的病例,尤其美国、加拿大和日本是流行较广的国家。据报道,美国每年用于防治因此菌引起的疾病花费约为4.5亿美元[1]。我国首次分离到大肠杆菌O157∶H7是在1986年江苏省徐州市[2-3],之后在其他14个省市都分离到了该病菌,但没有引起爆发。在1999—2000年间,我国首次在江苏淮北地区爆发了大规模由大肠杆菌O157∶H7引起的人感染并导致急性肾衰竭的疫情,病死率极高,1999年的病死率为87.37%;而2000年的病死率为89.47%,之后波及到安徽和河南等省份[3]。此次爆发也是世界上迄今为止规模最大,时间最长,发病原因最复杂,死亡人数最多的一次。反刍动物被认为是该致病菌的最主要宿主和传播源[4-5],因为放牧条件下粪便的长期暴露会造成环境的污染,或者是屠宰过程中携带者对畜产品的污染,到目前为止,还没有有效的措施防治该病的发生,主要是以抑制该致病菌的排出为主,因此,认为寻找安全、绿色、无毒等的天然抗生素将成为有效的策略。缩合单宁(condensed tannins,CT)作为植物的次生代谢产物,具有抑制大肠杆菌生长的特性,已成为目前研究的热点。紫色达利菊(purple prairie clover,Dalea purpurea Vent.,PPC)是一种适口性极好的豆科牧草,广泛分布在北美草原上,具有较好的抗旱性,在营养生长期和盛花期的平均干物质消化率在50%~65%,而蛋白质的平均含量在12%~20%[6]。在植物的不同生长阶段,动物都愿意采食。研究表明,PPC含有很高的CT,含量分布在58~94 g/kg DM[7]。CT 对大肠杆菌的抑制作用具有物种依赖性,研究显示,从9种不同的牧草中分离的CT,仅仅在PPC中表现出了较强抗大肠杆菌 O157∶H7 生长的作用。Jin 等[8-9]连续 3 年对春、秋2季草场放牧试验中的肉牛粪便研究发现,长期给牛饲喂PPC可以有效减少粪中大肠杆菌O157∶H7 的排出。Huang 等[10]也对羊进行了大肠杆菌抑制的体内试验,口服接种5株大肠杆菌混合培养物后,在28 d内采集粪样做平板涂布并计大肠杆菌数,发现饲喂PPC使羊排出的大肠杆菌数减少。但是,由于反刍动物复杂的消化系统,很难判断CT对大肠杆菌发生作用的具体部位。
因此,本文在结合前人试验研究[11-13]的基础上,通过体外模拟反刍动物瘤胃和大肠环境,探讨CT含量高的PPC在牛体内对大肠杆菌生长的影响。针对其所含CT对大肠杆菌抑制的研究,主要集中在对细胞外膜的通透性、蛋白质和脂质体的作用,对细胞凝聚、形态变化方面的影响[14],本研究通过开展以非致病性大肠杆菌ATCC 25922为研究模型,以红豆草所含CT作为对比,观察PPC的CT对大肠杆菌细胞内膜的影响,来评价PPC的CT对大肠杆菌内膜通透性的影响,从而为阐明牧草所含CT抑制细菌细胞生长的机理奠定理论基础。
1 材料与方法
1.1 试验动物和材料
试验牛:带有瘤胃瘘管的安格斯肉牛5头,来自加拿大农业部莱斯布里奇研究中心养殖场,健康,正常喂养饲粮(其中没有添加含有CT高的PPC和红豆草)。
牧草:PPC、红豆草和苜蓿(alfalfa)均为加拿大农业部莱斯布里奇研究中心反刍动物营养实验室基地种植、采集并冻干,经带1 mm筛孔粉碎机粉碎,备用。
PPC的CT和红豆草的CT:加拿大农业部莱斯布里奇研究中心反刍动物营养实验室提取,纯度均大于98.0%。
试验菌株:非致病性大肠杆菌(菌株ATCC 25922)和致病性大肠杆菌 O157∶H7(菌株H4420N和E318N的新鲜菌液按1∶1混合)均来自加拿大农业部莱斯布里奇研究中心的微生物保藏中心。
1.2 主要试剂及培养基的配制
主要试剂及培养基(麦康凯培养基、普通琼脂培养基和普通肉汤培养基)等均按使用说明进行配制,备用。
1.3 主要仪器设备
荧光显微镜(2420A,Leica,德国);紫外分光光度计(SP-8001,Metertech);微孔板读数仪(Thermo,美国);96 孔微孔板(Coring,美国);高速离心机(SLA-1500,Thermo,美国);恒温培养箱(Thermo,美国);冻干机(Goldfisch,美国)
1.4 方法
1.4.1 体外模拟试验评价PPC对肉牛瘤胃和大肠中大肠杆菌生长的抑制作用
实验室测定PPC和苜蓿营养水平[15]相近(表1),而只有 PPC含有高浓度 CT[8],所以本试验以PPC和苜蓿为底物来培养大肠杆菌,以比较二者在反刍动物瘤胃和大肠环境下的生长来评价PPC的抑菌效果。
1.4.1.1 菌种活化
将实验室保存冻干菌种经常规方法进行活化3代后,备用。
1.4.1.2 PPC 对大肠杆菌在瘤胃中生长的抑制作用
晨饲前,从试验牛取瘤胃液200 m L,用4层纱布进行过滤,滤液直接加入3 000 m L缓冲液[16]中,并放置在50℃磁力搅拌器上进行搅拌。一直保持通入CO2,维持厌氧环境。预先称好用1 mm筛孔粉碎机粉碎的PPC和苜蓿牧草各200 mg,分别放入20 m L的螺口玻璃管中。取5 m L上述混合液,加入离心管中,同时加入100μL大肠杆菌菌悬液(105CFU/m L),同时通 CO2,并将盖子盖好,37 ℃振摇(120 r/min)培养,并分别在 0、1.5、3.0、6.0、24.0 h 的时间点取样,通过麦康凯培养基平板涂布,计大肠杆菌菌落数。每个样3个重复, 涂布3个平板。共重复3次。
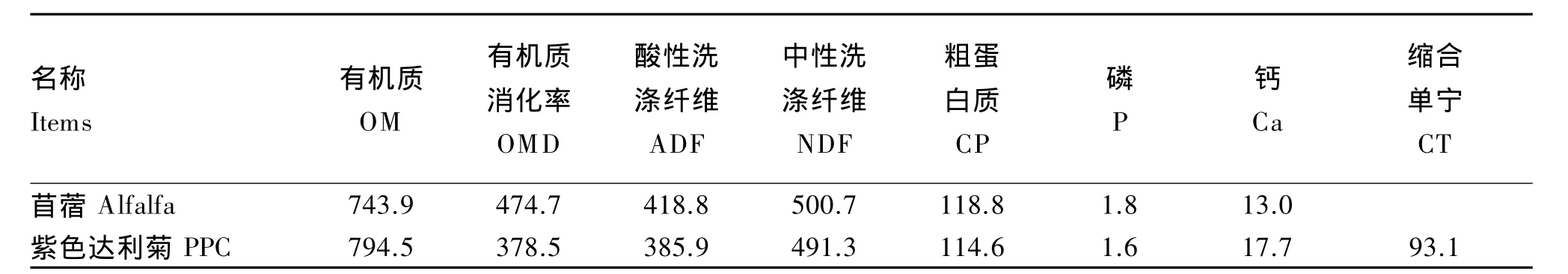
表1 盛花期苜蓿与PPC的营养水平(干物质基础)Table 1 Nutrient levels of alfalfa and PPC harvested at the full-flowering(DM basis)(n=5) g/kg
1.4.1.3 PPC 对大肠中大肠杆菌的抑制作用
取直肠粪样 50 g,加缓冲液 1 000 m L[16],搅拌,用纱布过滤到烧瓶中,50℃磁力搅拌器上搅拌,通入CO2,保持厌氧。预先称好用1 mm筛孔粉碎机粉碎的PPC和苜蓿牧草各200 mg,分别放入20 m L的螺口玻璃管中。取5 m L上述液体加入到玻璃管中,每管中同时加入100μL菌液(105CFU/m L),37 ℃振摇(120 r/m in)培养,并分别在 0、1.5、3.0、6.0、24.0 h 的时间点取样,通过麦康凯培养基平板涂布,计大肠杆菌菌落数。每个样品做3个重复,涂布3个平板。共重复3次。
1.4.2 PPC的CT对大肠杆菌内膜的影响
在前期研究中发现红豆草的CT和PPC的CT都有抑菌作用,但PPC的CT对大肠杆菌的抑菌效果要比红豆草CT强[16]。因此,为了解PPC的CT抑制大肠杆菌的作用机理,选择了以红豆草的CT为比对,观察PPC的CT对大肠杆菌内膜的影响。
1.4.2.1 菌悬液制备
从普通琼脂平板培养基上挑取单个菌落,接种到M 9培养基(M 9矿物质盐11.28 g,酪蛋白氨基酸5 g,加去离子水到1 000 m L,溶解后,121℃高压30 m in。再无菌加入已高压30%葡萄糖15 m L,0.1 mol/L 氯化钙溶液 1 m L,1 mol/L 硫酸镁溶液2 m L,混匀即可)中。在细菌培养过程中,试验组:分别加入PPC的CT和红豆草的 CT[10μg/m L,此浓度的选择是基于PPC的CT的最小抑菌浓度(m inimum inhibition concentration,M IC)(25%~50%)所设定];对照组:不加入 CT培养的菌悬液。每组3个重复,培养3瓶,均培养10 h。收获菌体,离心(15 600×g,10 m in)2 次;用pH 7.4磷酸盐缓冲液(phosphate buffered solution,PBS)重悬菌体,并调整OD420 nm 为1.0,备用。
1.4.2.2 PPC 的 CT 对大肠杆菌内膜通透性的影响[17]
内膜通透性的测定是通过测定细菌细胞膜内释放的β-D-半乳糖苷酶的能力来判断。邻-硝基苯-β-D-半乳糖苷(o-nitrophenyl-β-D-galactoside,ONPG)是β-D-半乳糖苷酶的底物,它被酶水解后生成半乳糖和黄色的邻-硝基苯酚(ONP),ONP在410~420 nm处有紫外吸收。试验组按19∶1混合菌悬液和ONPG溶液(30 mmol/L),对照组用双蒸水取代ONPG,放置在室温(22℃)下,备用。旋涡混匀 30 s后,分别在 0、40、80、120、160 m in时取出2 m L,11 000×g离心3 m in。取上清液进行微孔板点样,200μL/孔,在416 nm波长下进行读数。
1.4.2.3 CT在不同pH条件下对细胞内膜通透性的影响[17]
大肠杆菌为兼性厌氧,最适生长pH为6.8~8.0,pH 低于 6.0 或高于 8.0 则生长缓慢。因此,在上述 1.4.2.1中所述的前处理中,对离心后的菌体进行重悬时,选择利用不同 pH 的 PBS(5.3、6.8、7.4、8.0、9.0),对在培养过程中经过处理的细菌菌体进行重悬,观察不同情况下内膜通透性在不同时间点(0、40、80、120、160 m in)的变化。
1.4.2.4 CT 在不 同温 度下 对 大 肠 杆 菌 内膜通透性的影响
在上述 1.4.2.1中所述的前处理中,对离心后的菌体进行重悬时,每个时间点的样品分别分成2份,一份放置在室温(22℃),一份放置在4℃,观察不同情况下内膜通透性在不同时间点(0、80、120、300 m in)的变化。
1.5 数据分析
试验数据是经SAS 9.2分析软件m ixed程序进行分析。处理为主要因素,试验重复及每个试验中的重复为随机因素,每个时间点数据单独分析,以P<0.05作为差异显著性的标准。
2 结果
2.1 PPC和苜蓿底物瘤胃环境中大肠杆菌生长的影响
如图1所示,针对大肠杆菌ATCC 25922,在体外瘤胃液试验的0~3.0 h取样中,PPC对瘤胃液中大肠杆菌ATCC 25922的数量没有表现出抑制作用,同苜蓿组变化基本一致,PPC组与苜蓿组无显著差异(P<0.05);在 6.0 h 取样中发现,随着细菌生长繁殖加快,同苜蓿组相比,PPC对大肠杆菌ATCC 25922生长表现出了抑制作用,数量显著降低(P<0.05);在 24.0 h 取样中 PPC 仍然对大肠杆菌ATCC 25922表现出了抑制作用,数量显著降低(P<0.05)。针对大肠杆菌 O157∶H7,在 6 h 取样中发现,随着细菌生长繁殖加快,同苜蓿组相比,PPC对大肠杆菌O157∶H7生长表现出了抑制作用,数量显著降低(P<0.05);在 24.0 h 取样中,随着细菌本身数量的减少,与苜蓿组相比,PPC仍然对大肠杆菌O157∶H7生长表现出了抑制作用,数量显著降低(P<0.05)。
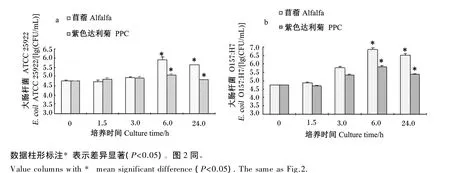
图1 PPC和苜蓿底物对大肠杆菌ATCC 25922(a)和大肠杆菌O 157∶H 7(b)在瘤胃环境中生长的影响Fig.1 Influence of PPC and alfalfa substrates on grow th of E.coil ATCC 25922(a)and E.coil O157 ∶H7(b)in the rum inal condition
2.2 PPC和苜蓿底物对大肠环境中大肠杆菌生长的影响
如图2所示,同苜蓿组相比,在0~24.0 h取样中,随着细菌的不断生长繁殖、数量的持续增加,PPC对大肠中大肠杆菌ATCC 25922和大肠杆菌O157∶H7 生长表现出了抑制作用,在 1.5~24.0 h数量显著降低(P<0.05)。
2.3 PPC的 CT和红豆草的 CT对大肠杆菌ATCC 25922细胞内膜通透性的影响
2.3.1 CT对细菌细胞内膜通透性的影响
如图3所示,和无CT培养的菌悬液相比,随着时间的增加,在培养大肠杆菌ATCC 25922过程中加入10μg/m L PPC的CT和红豆草的CT的菌悬液有着较高的ONP含量,说明CT可以使细菌细胞内膜的通透性增加,膜内物质ONP不断地释放,但是2种CT间差别不大。
2.3.2 不同 pH条件下,CT对细菌细胞内膜通透性的影响
如图 4所示,在 pH 为 5.3~9.0,2 种 CT 对大肠杆菌内膜通透性的变化趋势并不一致。PPC所含CT对细菌细胞内膜的通透性影响最大,随着pH的增加,环境由偏酸到偏碱,内膜通透性逐渐增大;而红豆草中所含CT随着pH的增加对内膜通透性的影响很小,尤其是在碱性和中性环境(pH 7.4、8.0、9.0)中,影响不大,在酸性环境(pH 5.3、6.8)中细胞内膜的通透性有所增加。
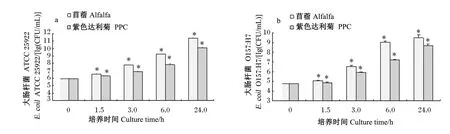
图2 PPC和苜蓿底物对大肠杆菌ATCC 25922(a)和大肠杆菌O 157∶H 7(b)在大肠环境中生长的影响Fig.2 Influence of PPC and alfalfa substrates on grow th of E.coil ATCC 25922(a)and E.coil O157 ∶H7(b)in the large intestinal condition
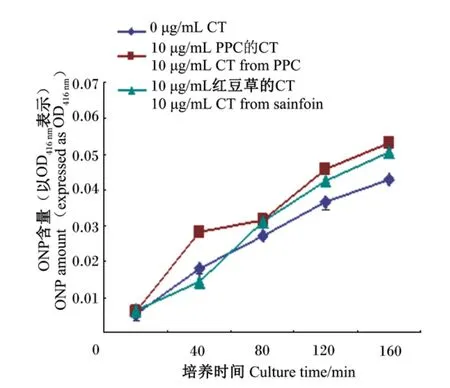
图3 PPC的CT和红豆草的CT对大肠杆菌ATCC 25922细胞内膜通透性的影响Fig.3 Influence of CT from PPC and sainfoin on cell inner-membrane permeability of E.coil ATCC 25922
2.3.3 不同温度条件下,CT对细菌细胞内膜通透性的影响
如图5所示,不同温度条件下,CT对大肠杆菌细胞内膜通透性均有变化。随着时间的增加,加CT和无CT培养的细菌细胞内膜的通透性都是增加的。但是,在4℃条件下,经过CT培养的大肠杆菌的β-D-半乳糖苷酶的释放量小,ONP含量增长非常缓慢,细菌生长明显受到抑制;而在室温条件下,随着时间的延长,加CT培养的细菌细胞的内膜通透性增加;但当100 m in以后,经红豆草的CT培养的细菌通透性有所下降。
3 讨论
大肠是大肠杆菌在动物体内的主要寄宿处,试验表明CT能在此处抑制其生长,具有重大意义。单就CT本身来说,将其同时置入反刍动物瘤胃和大肠环境下,其在大肠中抑菌作用要比在瘤胃中的大,因为瘤胃中的干扰因素较多,尤其是蛋白质的含量要高的多。而实际上,CT在大肠中的抑菌作用可能要受到其在前消化道中因素的影响,抑菌作用变小,因为动物采食含CT植物后,CT首先要在前消化道中和其他物质如蛋白质发生作用,从而削弱了它到大肠后的作用。Molan等[18]试验表明 CT浓度大于400μg/m L时,大量的瘤胃微生物被抑制。已经被证实CT具有对瘤胃微生物细胞壁的结合作用,从而阻止其生长和降低蛋白酶的活性;通过与木质素结合,从而影响微生物对纤维素的利用,同时也可直接抑制瘤胃纤维素降解菌的生长。此外,由于CT具有结合蛋白质的能力,与饲料蛋白质结合从而减少了瘤胃微生物对氮的利用或者多酚与微生物细胞壁和微生物分泌的细胞外酶相结合,从而抑制微生物的大量增殖。当富含CT的饲草被动物咀嚼后,不溶的CT与其他底物结合物的生成,同时,在瘤胃的酸性环境中,CT有可能与细菌细胞结合成聚合体等[19],都能间接影响微生物的生长。从红豆草中提取的CT被发现对4种瘤胃细菌[溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)A38、牛链球菌(Streptococcus bovis)45S1、反刍兽普雷沃氏菌(Prevotella ruminicola)B14和嗜淀粉瘤胃杆菌(Ruminobacter amylophilus)WP225]细胞壁都有结合作用[19],同时有试验表明经反刍动物咀嚼后释放的高浓度自由CT,能够与瘤胃微生物释放的酶相结合并抑制瘤胃碳水化合物的发酵[20]。在革兰氏阳性(G+)细菌中也发现了CT对其生长和蛋白质酶的抑制,以及对细胞形态的影响[21],所以也假定CT是通过对细菌细胞壁进行选择性抑制的。
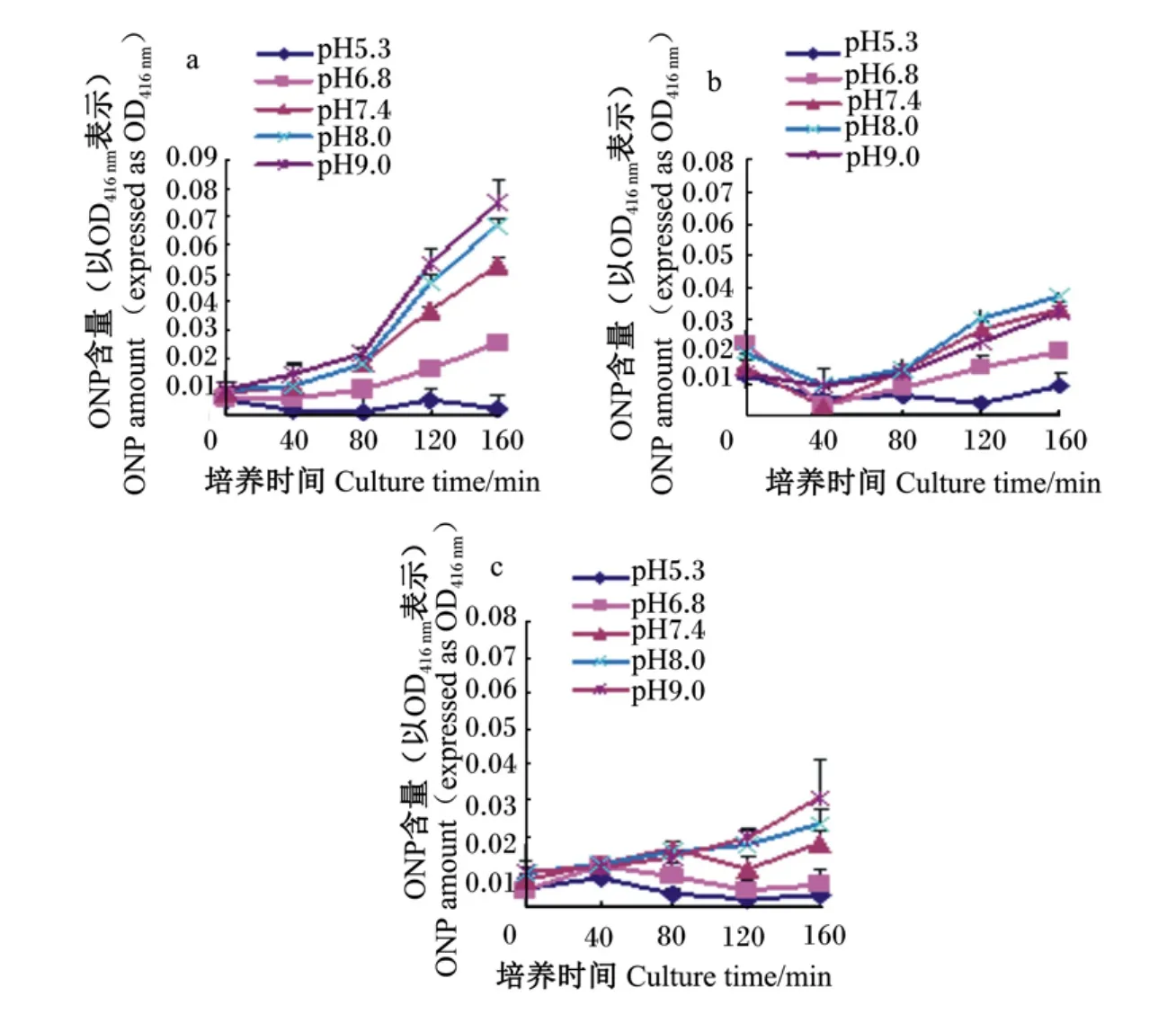
图4 不同pH条件下,PPC的CT(a)、红豆草的CT(b)和无CT(c)对大肠杆菌ATCC 25922细胞内膜通透性的影响Fig.4 Influence of CT from PPC(a)and sainfoin(b),and w ithout tannin(c)on cell inner-membrane permeability of E.coil ATCC 25922 under different pH conditions
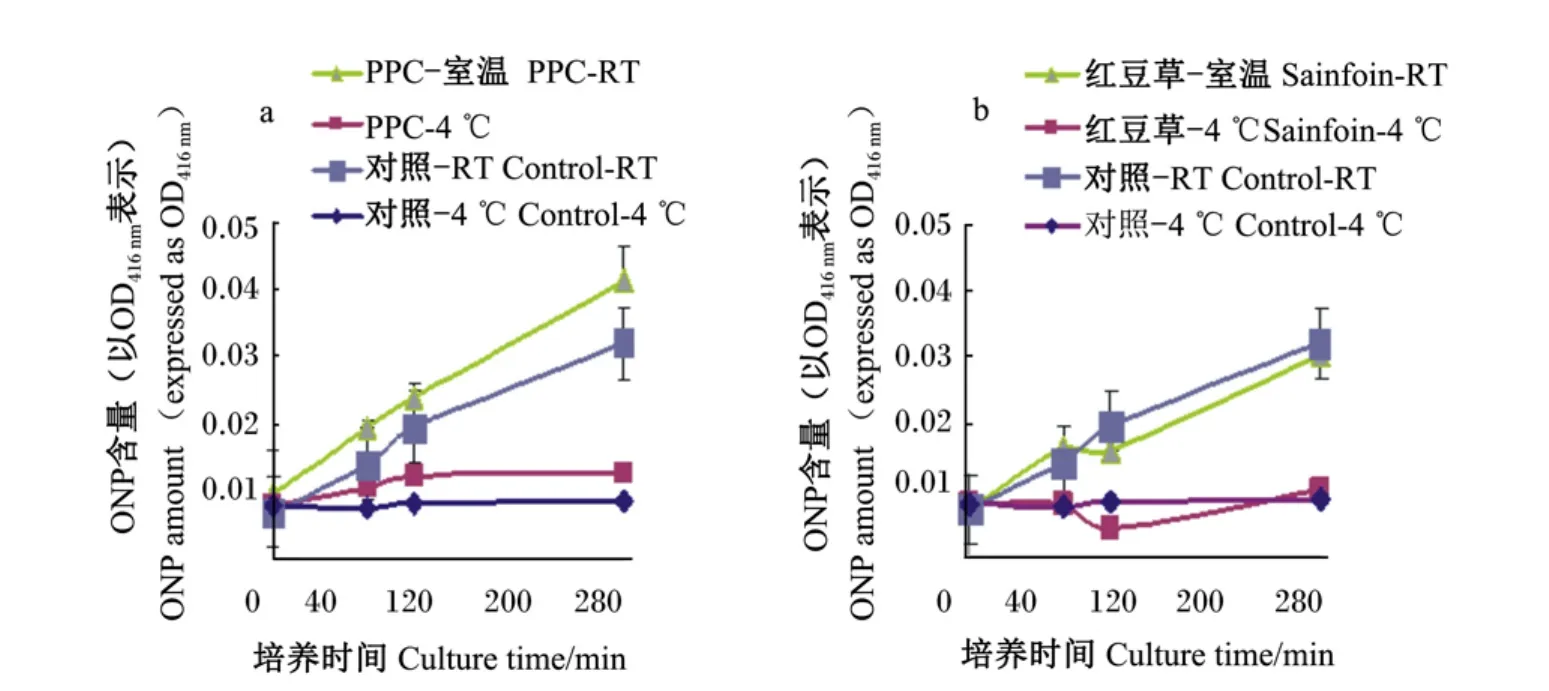
图5 不同温度条件下,PPC的CT(a)和红豆草的CT(b)对大肠杆菌ATCC 25922细胞内膜通透性的影响Fig.5 Influence of CT from PPC(a)and sainfoin(b)on cell inner-membrane permeability of E.coil ATCC 25922 under different tem perature conditions
Je等[17]在对甲壳素通过干扰细菌内膜和外膜的研究中也表明,甲壳素有效的干扰了由脂多糖构成的外膜中高度带负电的低聚糖单元。因为革兰氏阴性(G-)细菌的内膜结构是由类似于磷脂酰甘油和双磷脂酰甘油的阴离子脂质构成,也是与阳离子结合的部位,因此也干扰了内膜结构。在PPC的CT对大肠杆菌的外膜通透性试验中,我们也证实了CT明显的增加了外膜的通透性[14],因此,对内膜的影响可能也是通过相同的机制进行。
关于绿茶中的多酚类化合物儿茶酚素,已被证明具有干扰细胞膜完整性、抑制细胞代谢重要过程的作用,如氧化磷酸化以及干扰膜内外物质的转运过程。儿茶素组群中的一些成分如表儿茶素(epicatechin)和表儿茶素没食子酸酯(epicatechin gallate)就是通过引起细菌细胞膜的破坏并干扰外膜中脂质体的变化而起到杀菌作用的[22-25]。
4 结 论
PPC在瘤胃及大肠环境下均具有抑制大肠杆菌体外生长的作用,其所含CT抑制大肠杆菌生长的机理部分与其增加细胞内膜的通透性有关,且细胞内膜通透性受到生长环境,如温度和pH的影响。
[1] FRENZEN P D,DRAKE A,ANGULO F J.Econom ic cost of illness due to Escherichia coli O157 infections in the United States[J].Journal of Food Protection,2005,68(12):2623-2630.
[2] 李洪卫,景怀琦,逄波,等.徐州市2000年肠出血性大肠埃希菌O157∶H7感染性腹泻的调查[J].中华流行病学杂志,2002,23(2):92-95.
[3] 汪华,景怀琦,李红卫,等.江苏省淮北地区肠出血性大肠埃希菌O157∶H7感染性腹泻并发急性肾衰的研究[J].中华流行病学杂志,2004,25(11):24-26.
[4] SHENG H Q,LIM JY,KNECHT H J,et al.Role of Escherichia coli O157∶H7 virulence factors in colonization at the bovine term inal rectalmucosa[J].Infection and Immunity,2006,74(8):4685-4693.
[5] HULSE J H.Polyphenols in Cereals and Legumes[C]//36th annual meeting of the Institute of Food Technologist.St Louis M issouri:[s.n.],1979.
[6] 金龙.紫色达利菊提取缩合单宁对大肠杆菌和瘤胃氮代谢以及瘤胃微生物的影响[D].博士学位论文.哈尔滨:东北农业大学,2011.
[7] BERARD N C,WANG Y,W ITTENBERG K M,et al.Condensed tannin concentrations found in vegetative and mature forage legumes grown in western Canada[J].Canadian Journal of Plant Science,2011,91(4):669-675.
[8] JIN L,WANG Y S,IWAASA A D,et al.Effect of condensed tannins on rum inal degradability of purple prairie clover(Dalea purpurea Vent.)harvested at two grow th stages[J].Animal Feed Science and Technology,2012,176(1/2/3/4):17-25.
[9] JIN L,WANG Y S,IWAASA A D,et al.Purple prairie clover(Dalea purpurea Vent)reduces fecal shedding of Escherichia coli in pastured cattle[J].Journal of food Protection,2015,78(8):1434-1441.
[10] HUANG Q Q,JIN L,XU ZW,et al.Effects of purple prairie clover(Dalea purpurea Vent.)on feed intake,nutrient digestibility and faecal shedding of Escherichia coli O157∶H7 in lambs[J].Animal Feed Science and Technology,2015,207:51-61.
[11] JIN L,ZHANG Y,IWAASA A D,et al.Fecal shedding of Escherichia coli of cattle grazing pasturesw ith and w ithout purple prairie clover(Dalea purpurea Vent)[C]//CSAS/SCSA annual meeting.Halifax Canada:[s.n.],2011.(Abstract)
[12] 李元恒,金龙,韩国栋,等.植物单宁在反刍动物营养和健康养殖作用中的研究进展[J].草地学报,2013,21(6):1043-1051.
[13] WANG Y S,JIN L,OM INSKI K H,et al.Screening of condensed tannins from Canadian prairie forages for anti-Escherichia coli O157∶H7 w ith an emphasis on purple prairie clover(Dalea purpurea Vent)[J].Journal of Food Protection,2013,76(4):560-567.
[14] LIU X L,HAO Y Q,JIN L,etal.Anti-Escherichia coli O157∶H7 properties of purple prairie clover and sainfoin condensed tannins[J].Molecules,2013,18(2):2183-2199.
[15] 王鑫,马永祥,李娟.紫花苜蓿营养成分及主要生物学特性[J].草业科学,2003,20(10):39-41.
[16] 刘秀丽.植物缩合单宁对大肠杆菌的抑制作用及抑菌机理的研究[D].博士学位论文.呼和浩特:内蒙古农业大学,2013.
[17] JE JY,KIM S K.Chitosan derivatives killed bacteria by disrupting the outer and innermembrane[J].Journal of Agriculture and Food Chem istry,2006,54(18):6629-6633.
[18] MOLAN A L,WAGHORN G C,M IN B R,et al.The effect of condensed tannins from seven herbages on Trichostrongylus colubriformis larval m igration in vitro[J].Folia Parasitologica,2000,47(1):39-44.
[19] JONESG A,MCALLISTER T A,MUIR A D,et al.Effects of sainfoin(Onobrychis viciifolia Scop.)condensed tannins on grow th and proteolysis by four strains of rum inal bacteria[J].Applied and Environmental M icrobiology,1994,60(4):1374-1378.
[20] BARRY T N,MANLEY T R.Interrelationships between the concentrations of total condensed tannin,free condensed tannin and lignin in Lotus sp.and their possible consequences in rum inant nutrition[J].Journal of the Science of Food and Agriculture,1986,37(3):248-254.
[21] SM ITH A H,MACK IE R I.Effect of condensed tan-nins on bacterial diversity and metabolic activity in the rat gastrointestinal tract[J].Applied and Environmental M icrobiology,2004,70(2):1104-1115.
[22] RATTY A K,SUNAMOTO J,DAS N P.Interaction of flavonoids w ith 1,1-diphenyl-2-picrylhydrazyl free radical,liposomalmembranes and soybean lipoxygenase-1[J].Biochem ical Pharmacology,1988,37(6):989-995.
[23] KITANO K,NAM K Y,KIMURA S,et al.Sealing effects of(-)-epigallocatechin gallate on protein kinase C and protein phosphatase 2A[J].Biophysical Chem istry,1997,65(2/3):157-164.
[24] TERAO J,PISKULA M,YAO Q.Protective effect of epicatechin,epicatechin gallate,and quercetin on lipid peroxidation in phospholipid bilayers[J].Archives of Biochem istry and Biophysics,1994,308(1):278-284.
[25] IKIGAIH,NAKAE T,HARA Y,et al.Bactericidal catechins damage the lipid bilayer[J].Biochim ica et Biophysica Acta(BBA):Biomembranes,1993,1147(1):132-136.
